
- •Минобрнауки россии
- •305040, Г. Курск, ул. 50 лет Октября, 94. Оглавление
- •Раздел 3. Квантовая физика и физика атома 5
- •Раздел 4. Ядерная физика и физика элементарных частиц 45
- •Раздел 3. Квантовая физика и физика атома
- •3.1. Корпускулярно-волновой дуализм свойств частиц. Волны де Бройля. Принцип неопределённостей Гейзенберга
- •3.1.1. Соотношение неопределенностей
- •Примеры решения задач
- •3.2. Уравнение Шрёдингера
- •3.3. Простейшие задачи квантовой механики
- •3.3.1. Прохождение частиц через потенциальный барьер
- •3.3.2. Движение частиц в одномерной яме с абсолютно непроницаемыми стенками
- •3.4. Спектр атома водорода. Правила отбора. Теория Бора для водородоподобных систем
- •3.5. Модель атома водорода Бора
- •3.6. Квантовомеханическая модель атома водорода
- •3.7. Векторная модель атома
- •Принцип запрета Паули
- •Если учесть наличие спина у электрона, то .
- •Раздел 4. Ядерная физика и физика элементарных частиц
- •4.1. Радиоактивность. Состав атомных ядер.
- •4.2. Превращение атомных ядер
- •4.2.1. Законы радиоактивного распада
- •4.2.2. Активность радиоактивного вещества
- •4.3. Ядерные реакции. Элементарные частицы
- •4.3.1. Искусственная радиоактивность, ядерные реакции
- •4.3.1. Законы сохранения в ядерных реакциях
- •4.3.2. Основные характеристики элементарных частиц
- •4.3.3. Изотопический спин
3.4. Спектр атома водорода. Правила отбора. Теория Бора для водородоподобных систем
Теоретическое введение
В 1905 году Дж. Томсоном была предложена модель атома, который представлял собой шар с равномерно распределенным положительным зарядом, внутри которого находятся электроны.
В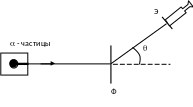 1911 году Резерфорд, бомбардируя -частицами
(
1911 году Резерфорд, бомбардируя -частицами
(![]() м/с) металлическую фольгу, определял
углы их рассеяния на атомах мишени,
регистрируя сцинтилляции на экране,
покрытом сернистым цинком.
м/с) металлическую фольгу, определял
углы их рассеяния на атомах мишени,
регистрируя сцинтилляции на экране,
покрытом сернистым цинком.
Так как некоторые -частицы отклонялись на большие углы, Резерфорд пришел к выводу о существовании ядра атома, в котором сосредоточен весь положительный заряд и почти вся масса атома.
Ядро
создает сильное электрическое поле,
так как имеет малый объем. Резерфорд
разработал количественную теорию
рассеяния -частиц
по углам
![]() которая предполагала взаимодействие
-частицы
и ядра атома по закону Кулона как для
точечных зарядов.
которая предполагала взаимодействие
-частицы
и ядра атома по закону Кулона как для
точечных зарядов.
-частица
при центральном попадании в ядро
сближается на расстояние, которое можно
найти. Посчитав, что вся кинетическая
энергия -частицы
![]() расходуется
на потенциальную энергию взаимного
отталкивания
расходуется
на потенциальную энергию взаимного
отталкивания
![]() ,
можно получить:
,
можно получить:
=![]()
При подстановке значений получаем, что размер ядра равен
![]() м.
м.
3.5. Модель атома водорода Бора
Теоретическое введение
Возникшее противоречие ядерной модели атома с классической электродинамикой (которое заключалось в том, что электрон, двигаясь ускоренно, должен терять энергию на излучение электромагнитных волн и за короткое время ~10-8 с упасть на ядро), было разрешено Нильсом Бором в 1913 году. Бор ввел постулаты, противоречащие классическим представлениям.
Атом может находиться в определенных энергетических состояниях, при которых он не излучает и не поглощает энергию. Из бесконечного множества электронных орбит в действительности реализуются только дискретные орбиты, удовлетворяющие квантовым условиям.
При переходе атома из одного энергетического состояния с энергий
 в другое с
в другое с
 излучается или поглощается квант
энергии
излучается или поглощается квант
энергии
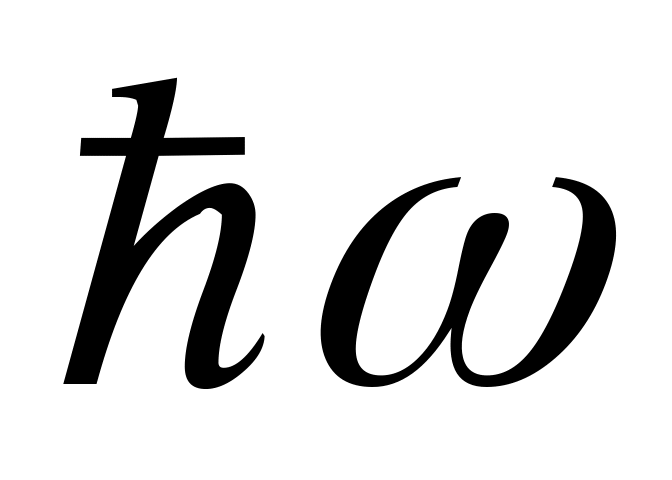 .
.
![]() .
.
Стационарные орбиты электрона определяются главным квантовым числом, которое разрешает только определенные значения момента импульса электрона.
![]()

С уществование
дискретных уровней энергии атома было
доказано немецкими физиками Франком и
Герцем в1914 г. В этих опытах использовался
триод, заполненный парами ртути. Между
К
и С
создавалось ускоряющее напряжение,
которое плавно менялось, а между С
и А
- постоянное поддерживалось задерживающее
напряжение. Зависимость анодного тока
I
от ускоряющего напряжения U,
полученная в опыте, оказалось, имела
максимумы. Это свидетельствовало о том,
что при соударениях электронов с атомами
электроны могли испытывать неупругие
столкновения, когда их энергия была
равна энергии возбуждения атома.
уществование
дискретных уровней энергии атома было
доказано немецкими физиками Франком и
Герцем в1914 г. В этих опытах использовался
триод, заполненный парами ртути. Между
К
и С
создавалось ускоряющее напряжение,
которое плавно менялось, а между С
и А
- постоянное поддерживалось задерживающее
напряжение. Зависимость анодного тока
I
от ускоряющего напряжения U,
полученная в опыте, оказалось, имела
максимумы. Это свидетельствовало о том,
что при соударениях электронов с атомами
электроны могли испытывать неупругие
столкновения, когда их энергия была
равна энергии возбуждения атома.
Согласно закону Ньютона электрону центростремительное ускорение сообщает кулоновская сила
![]() (1)
(1)
+е – заряд ядра атома
Откуда
![]()
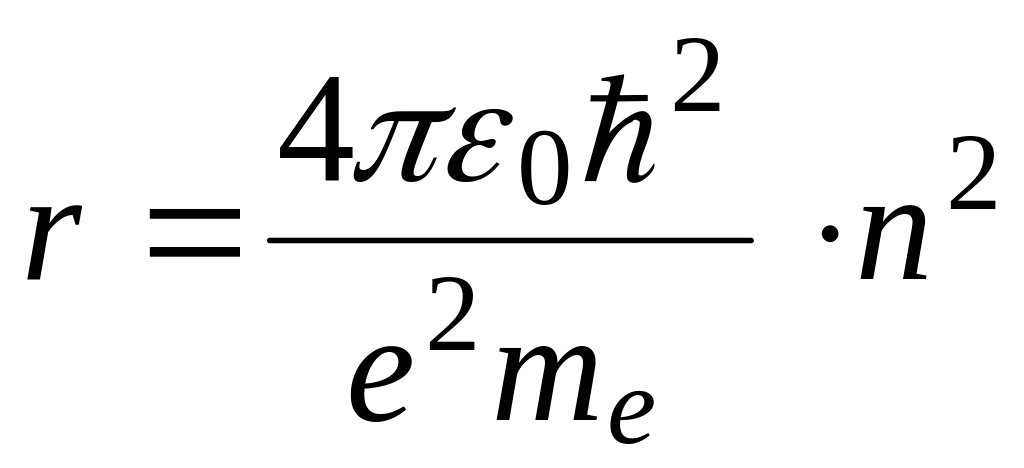 ,
где n
= 1,2, 3, … (2)
,
где n
= 1,2, 3, … (2)
При
n
= 1
![]() м
– радиус первой боровской орбиты.
м
– радиус первой боровской орбиты.
Энергия атома водорода:
![]()

Подставив сюда (2), получим разрешенные энергии атома водорода:
![]() ,
где
,
где
n = 1,2,3,…
Частота спектральной линии при переходе атома из состояния с энергией n в состояние с энергией m определяется:
![]()
![]()
![]() (4)
(4)
![]() с-1
с-1
В ычисленные
по формуле (4) частоты оказались в полном
согласии с экспериментом. Однако модель
Бора была не последовательно классической,
но и не квантовой. При помощи данной
теории невозможно в принципе объяснить
закономерности спектров многоэлектронных
атомов.
ычисленные
по формуле (4) частоты оказались в полном
согласии с экспериментом. Однако модель
Бора была не последовательно классической,
но и не квантовой. При помощи данной
теории невозможно в принципе объяснить
закономерности спектров многоэлектронных
атомов.
Таким образом, теория Бора являлась переходным этапом в развитии квантовой физики.
Теория атома водорода, построенная Бором, подтверждалась экспериментальным определением частот излучения атома водорода, которые называются серями.
Бальмер установил, что частоты волн водорода, излучаемые в видимом диапазоне, определяются по формуле Бора и соответствуют переходу на второй энергетический уровень со всех выше лежащих.
Эту серию назвали серией Бальмера
![]() ,
n
= 3, 4, 5,…
,
n
= 3, 4, 5,…
Серия Лаймана
![]() ,
n
= 2, 3, 4, 5,…
,
n
= 2, 3, 4, 5,…
