
Хімічна кінетика. Загальні положення
Розділ фізичної хімії, присвячений закономірностям протікання хімічних процесів у часі, називається хімічною кінетикою.
Метод знаходження рівнянь, що визначають швидкість хімічних реакцій, у які в якості перемінних входять тільки концентрації реагуючих речовин, заснований на використанні основного постулату хімічної кінетики, одержав назву формальної кінетики.
Хімічні реакції протікають з різними швидкостями. Наприклад, реакція нейтралізації протікає практично миттєво, у той час як взаємодія водню з киснем при кімнатній температурі й у відсутності каталізатора протікає надзвичайно повільно. Науку про швидкості хімічних реакцій називають хімічною кінетикою.
Якщо реагенти (або реагенти і каталізатор) знаходяться в різних фазах, то реакція називається гетерогенною; якщо ж реакція протікає в одній фазі, то називається гомогенною. Гомогенні реакції протікають в обсязі, гетерогенні - на поверхні розділу фаз.
На швидкість хіміко-технологічного процесу в основному впливають:
- агрегатний (фазовий) стан і фізико-хімічні властивості вихідних реагентів, проміжних і кінцевих речовин;
- фізико-хімічні властивості середовища, у якому проводяться хімічні і фазові перетворення;
- кінетичні особливості процесу, якось: характер зміни концентрації, розходження заданого і стехіометричного співвідношення реагентів, порядок і молекулярність реакцій, енергія активації, розмір і властивості поверхні розділу фаз реагуючих речовин та продуктів;
- число стадій і необхідність істотної зміни на кожній послідовній стадії таких найважливіших характеристик процесу, як температура, тиск, концентрація, співвідношення реагентів;
- наявність або спеціальне введення хімічних регуляторів перетворень - як ініціаторів, так і інгібіторів;
- використання факторів інтенсифікації протікання процесу (каталізаторів, імпульсів і ін.);
- гідродинамічна характеристика умов контакту реагентів;
- особливості массо- і теплообміну з зовнішнім середовищем;
- комплекс операцій і методів обробки реакційних мас у сполучених з реактором апаратах.
2. Основи формальної кінетики. Швидкість хімічної реакції
Під час перебігу будь-якої хімічної реакції відбувається зміна концентрацій речовин, що беруть у ній участь, при чому концентрація реагентів зменшується, а концентрація продуктів збільшується. Це графічно зображується у вигляді кінетичної кривої. На рис.1. наведено кінетичні криві для реагенту (1) та для продукту (2).

Рис.1. Кінетичні криві для реагенту (1) та для продукту (2).
Прийнято позначати початкову концентрацію реагенту с0 =а ,поточну концентрацію реагенту:
с =
а-х, продукту – х. якщо взяти на кінетичнїй
кривій 1 дві довільні точки з координатами
с1, t1
та с2, t2, то
зміна концентрації Δс = с2 – с1
відбувається протягом часу Δ
t = t2
- t1.
Відношення цих двох величин з урахуванням
того, що Δс є вд’ємною величиною, можна
вважати середньою швидкістю
![]() реакції на відрізку Δ t,
тобто
реакції на відрізку Δ t,
тобто
![]() (1)
Поступово зменшуючи с та t
до нескінченно малих величин, приходимо
до визначення істинної швидкості
хімічної реакції
(1)
Поступово зменшуючи с та t
до нескінченно малих величин, приходимо
до визначення істинної швидкості
хімічної реакції
![]() (2)
(2)
Коли реакція завершується , то її швидкість прямує до нуля. Логічно пов’язати зменшення швидкості реакції зі зменшенням концентрації реагенту. Фізично і математично це зручно зобразити як степеневу залежність, тобто
![]() (3)
(3)
де n – порядок реакції; k – константа швидкості. Константа швидкості має розмірність: [час-1*конц.1-n].
При перебігу реакції
![]() (1)
(1)
зліва праворуч концентрація речовин А1 і А2 зменшується, а концентрація речовин А3 і А4 збільшується.
Швидкість реакції (1) визначається зміною концентрації реагентів за одиницю часу. Для реакцій, що протікають при постійному об'ємі в закритих системах, швидкість реакції виражають рівнянням
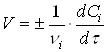 (2)
(2)
де vi і Сi - відповідно стехіометричний коефіцієнт і концентрація i-го реагенту в момент часу τ.
Швидкість реакції завжди позитивна. Тому в рівнянні швидкості реакції (2) ставлять знак плюс, якщо швидкість реакції визначають по зміні концентрації кінцевої речовини за одиницю часу, і знак мінус, якщо швидкість визначається по зміні концентрації початкової речовини.
Відповідно до закону діючих мас швидкість реакції V пропорційна добуткові концентрацій реагуючих речовин у ступенях, рівних їхнім стехіометричним коефіцієнтам у рівнянні швидкості реакції. Для елементарної реакції (1), що протікає зліва праворуч (пряма реакція), швидкість реакції V виражається рівнянням
![]() (3)
(3)
де k1 - стала пропорційності - константа швидкості прямої реакції;
С1 і C2 - концентрації речовин A1 і А2. Якщо в реакції бере участь не один, а декілька (А, В тощо) реагентів, то кінетичне рівняння таке:
![]()
Величини nА, nВ тощо називаються порядками реакції за відповідними реагентами, тобто
![]()
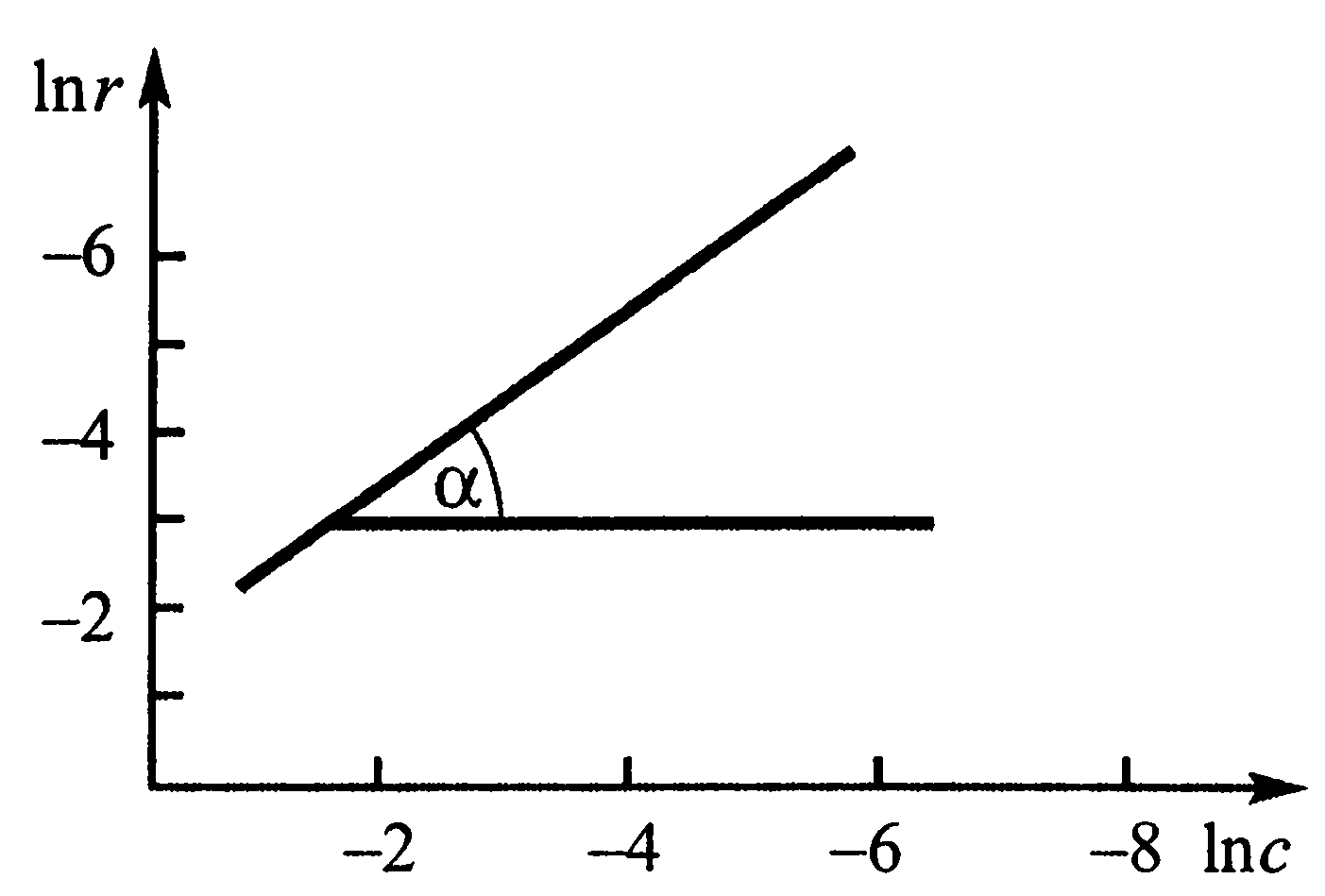
Наайбільш загальний метод визначення порядку реакції запропоновано Я. Вант – Гоффом. Логарифмуючи рівняння (3), маємо
![]()
Таким чином, n = tgα на графіку, що побудований в координатах lnr - lnc (рис.2). Величини знаходять з кінетичної кривої (рис.1) шляхом графічного або чисельного диференціювання.
Часто швидкість процесу V виражають зміною кількості dNи вихідної речовини або його концентрації dCи, кількості або концентрації продукту dNп і dCп, а також ступеня перетворення β за час dτ:
![]()
![]()
![]()
![]()
![]()
Реальний процес хімічних взаємодій є підсумком протікання рівнобіжних і послідовних простих реакцій, кожна з яких йде зі швидкістю, обумовленою особливостями умов процесу в системі.
По числу молекул, що беруть участь в елементарному акті хімічного перетворення, розрізняють реакції мономолекулярні, бімолекулярні і тримолекулярні. Оскільки імовірність одночасного зіткнення трьох часток мала, тримолекулярні реакції зустрічаються рідко.
Однобічна хімічно необоротна елементарна реакція першого порядку може бути представлена рівнянням
А → Продукти реакції
Швидкість реакції першого порядку дорівнює:
![]() (6)
(6)
де
![]() -
коефіцієнт швидкості процесу, (константа
швидкості реакції);
-
коефіцієнт швидкості процесу, (константа
швидкості реакції);
С - поточна концентрація речовини А.
Інтегруючи рівняння (6), одержимо
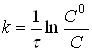 (7)
(7)
де С0 і С - початкова і поточна концентрації речовини А.
Таким чином, у координатах lnc - t для реакції 1-го порядку маємо пряму лінїю (рис.3.), при чому |tgα| = k, а відрізок на осі ординат дорівнює lnc0 (це дозволяє знайти с0, якщо початкова концентрація невідома, шляхом екстраполяції).
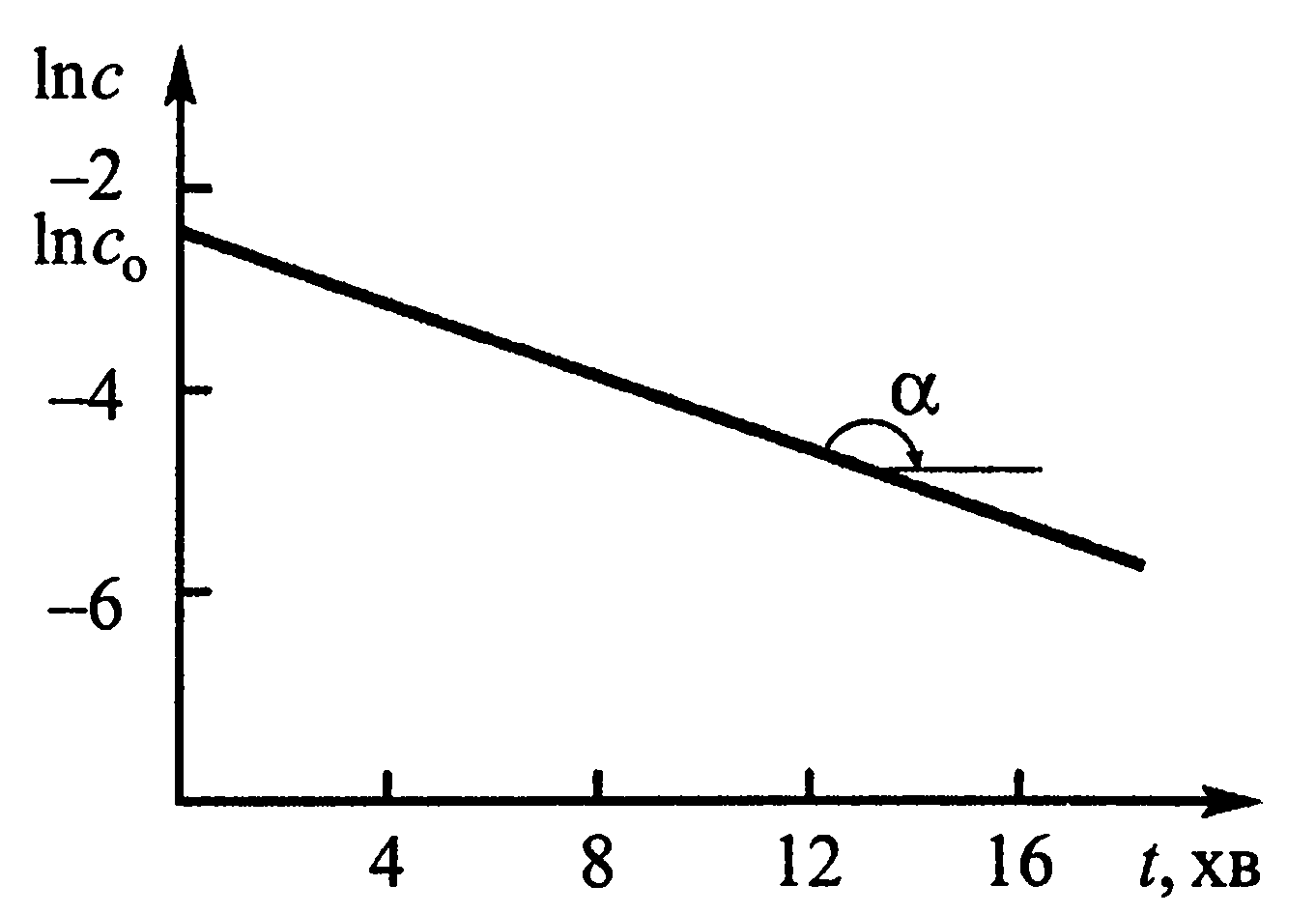
Рис.3. Кінетична крива для реакції першого порядку в напівлогарифмічних координатах
Рівняння (7) можна представити у вигляді
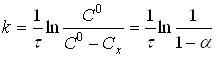 (8)
(8)
де Сх - зміна концентрації речовини А за час τ;
![]() -
ступінь перетворення.
-
ступінь перетворення.
Якщо
![]() ,
то
,
то
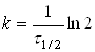 (9)
(9)
![]() (10)
(10)
де
![]() -
час напіврозпаду, тобто час, протягом
якого прореагує половина речовини.
-
час напіврозпаду, тобто час, протягом
якого прореагує половина речовини.

Рис.4.Визначення періоду напівперетворенння τ1/2
Однобічна хімічно необоротна реакція другого порядку схематично може бути представлена рівнянням
А1 + А2 → Продукт (продукти) реакції
Швидкість реакції другого порядку дорівнює
![]() (11)
(11)
де С1 і С2 – поточні концентрації А1 і А2.
Інтегруючи рівняння (11), одержуємо
 (12)
(12)
Якщо С1=С2=С, то рівняння (11) прийме вигляд
![]() (13)
(13)
і після інтегрування
 (14)
(14)
при С=С0/2
 (15)
(15)
![]() (16)
(16)
Таким
чином для реакції 2-го порядку період
напівперетворення залежить не лише від
константи швидкості, що в цьому випадку
має розмірність [час-1*конц.-1],
але й від початкової концентрації с0
. Для реакції 2-го порядку, згідно з
рівнянням (7), кінетична крива випрямлюється
в координатах lnc - t
доводить, що n=1, а в
координатах 1/c – t,
що n=2. Час
напівперетворення
![]() для
реакції другого порядку зворотньо
пропорційний початковій концентрації
реагуючих речовин.
для
реакції другого порядку зворотньо
пропорційний початковій концентрації
реагуючих речовин.
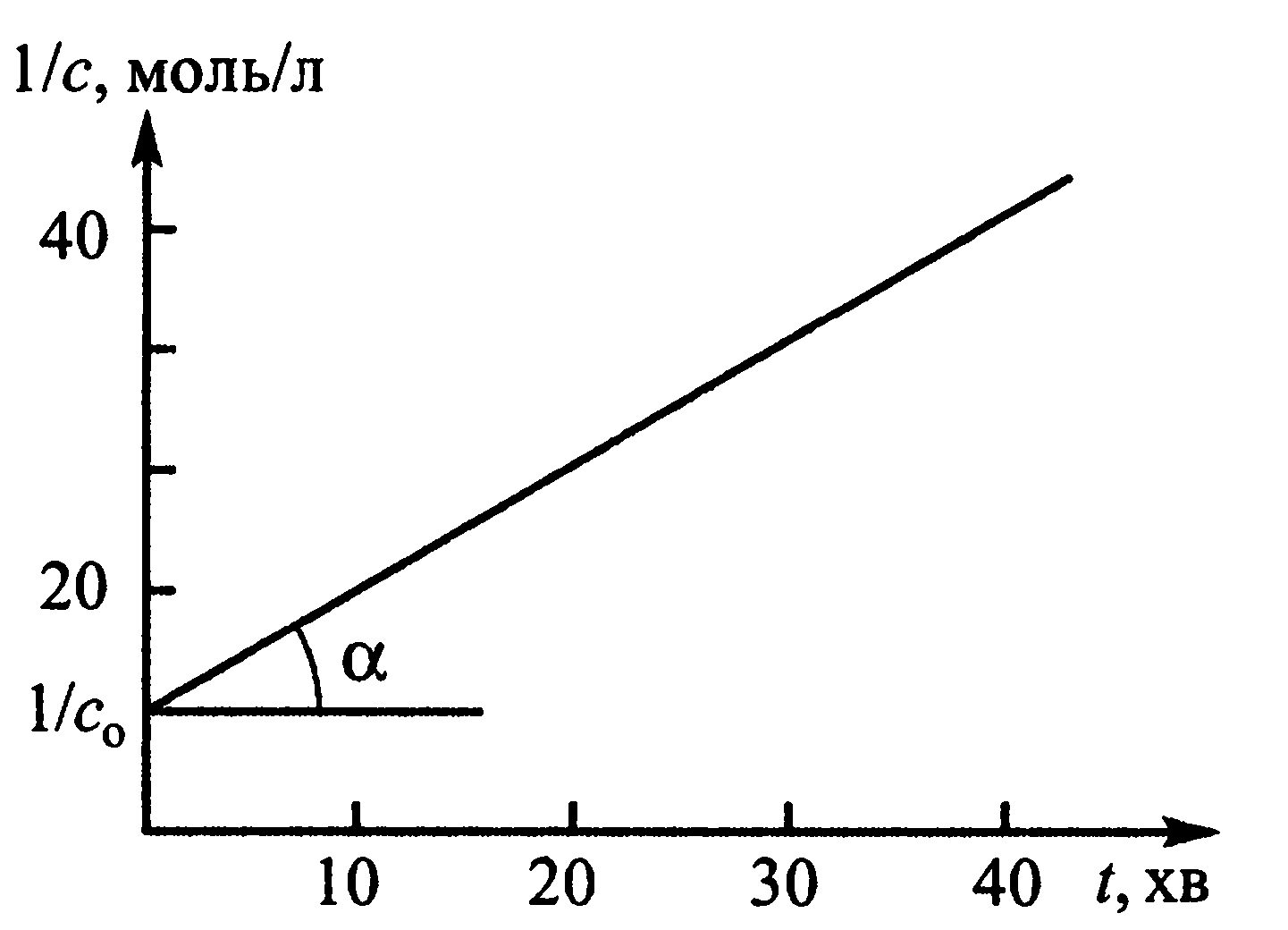
Рис.5. Кінетична крива для реакції 2-го порядку в координатах 1/c – t
У випадку однобічної реакції п-го порядку
А1 + А2 + А3 + ... → Продукт (продукти) реакції
![]() де
швидкість реакції дорівнює
де
швидкість реакції дорівнює
![]() (17)
(17)
Інтегруючи рівняння (17), одержимо
 (18)
або
(18)
або
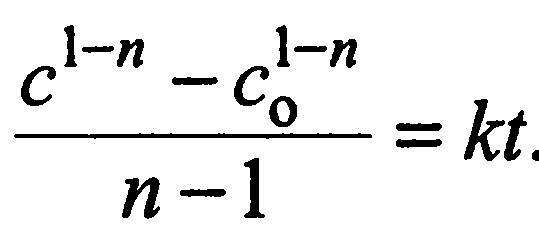
Якщо С=С°/2, то
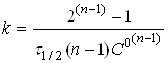 (19)
(19)
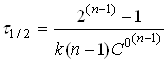 (20)
(20)
Час
напівперетворення реакції п-порядку
зворотно пропорційній початковій
концентрації реагентів у ступені (п-1).
k τ ½ = ln 2.
Звідси
τ ½ =
![]() =
=
![]() .
.
Таблиця - Кінетичні характеристики простих гомогенних реакцій
Кінетична характеристика |
Порядок хімічної реакції |
|||
n = 0 |
n = 1 |
n = 2 |
n = 3 |
|
1 Диференціальне кінетичне рівняння |
|
= KC. |
= KC 2. |
= KC 3. |
2 Інтегральне кінетичне рівняння |
З 0 - С = kt |
C = C 0 ∙ e-kt |
(
|
(
|
3 Константа швидкості реакції, її розмірність |
k =
|
k =
|
k =
|
k =
|
4 Час напівперетворення |
τ ½ =
|
τ ½ =
|
τ ½ =
|
τ ½ =
|
5.функція, лінійно залежить від часу |
C |
ln C |
|
|
Порядок реакції визначають, використовуючи дослідні дані про зміну концентрації реагуючих речовин з часом. Якщо в реакції бере участь кілька речовин, необхідно визначити приватні порядки стосовно кожної з цих речовин.
Існує кілька способів визначення приватного порядку і порядку реакції.
2.1 Методи визначення порядку реакції

Метод Вант-Гоффа
![]()
