
- •Раздел 6.: органические лекарственные
- •1. Образование йодоформа.
- •2. Образование сложного эфира с уксусной кислотой.
- •1. Ф и з и ч е с к и е свойства:
- •Раствор формальдегида
- •1.Реакция «серебряного зеркала» (выполняется полумикрометодом).
- •2. Реакция основана на способности формальдегида вступать в реакцию конденсации с фенолом в присутствии концентрированной серной кислоты.
- •Гексаметилентетрамин (уротропин)
- •Количественное определение:
1.Реакция «серебряного зеркала» (выполняется полумикрометодом).
К раствору нитрата серебра прибавляют раствор гидроксида аммония до растворения образующегося осадка, прибавляют раствор формальдегида, нагревают. Если пробирка была чистой, образуется серебро в виде зеркала, если она была грязной, то образуется серебряный осадок.
1 в.
AgNO3
+ NH4OH
AgOH + NH4NO3
в.
AgNO3
+ NH4OH
AgOH + NH4NO3
2AgOH Ag2O + H2O
O O
// //
A g2O + H – C H – С + 2 Ag
\ \
H OH
изб.амм. формальдегид муравьиная кислота
р-ра AgNO3
2в. AgNO3 + 2NH4OH = [Ag(NH3)2]NO3 + 2 H2O
O
// t0 C
H – C - Н + 2 [Ag(NH3)2]NO3 + H2O 2Ag ↓ + NH3↓ +
O
//
+ 2NH4NO3 + H – C
\
ONH4
2. Реакция основана на способности формальдегида вступать в реакцию конденсации с фенолом в присутствии концентрированной серной кислоты.
Т.В.: в фарфоровую чашку поместить на кончике глазной лопаточки салициловой кислоты, прибавить несколько капель концентрированной H2SO4 и раствор формальдегида. Образуется красное окрашивание.
Химизм:
 О О
О О
// 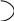 //
//

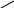

 H
/ C
// Н С – Н2О
H
/ C
// Н С – Н2О
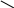 \
+ Н – С + ОН
\
+ Н – С + ОН
\ ОН \ ОН Н2SO4 (к)
ОН ОН р-я конденсаций
О H O
 \\
| //
[O]
\\
| //
[O]
 С
_____ С
______ /
C
С
_____ С
______ /
C
/ | \ H2SO4 конц.
 НО
H
OH
НО
H
OH
\ р-я окис-я
НО O[H – H2O]
метилен – бис – салициловая кислота
 O
H O
O
O
H O
O
\\ | // H //
 С
C ==== / C
C
С
C ==== / C
C
 /
\ +
\
/
\ +
\
H
 O
OH OH
O
OH OH
\
HO O OH
хиноидная структура.
O O
\\ //
C ———— C ———— C
// \ \
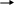 HO
OH
HO
OH
O
HO О
//
С
| \
OH ОН
ауриновый краситель.
Количественное определение: Метод йодометрический, титрование
обратное.
Основано на способности формальдегида окисляться.
Окисление проводят иодом в щелочной среде, так как молекулярный иод не может окислять формальдегид. В щелочной среде окисляющая способность иода увеличивается за счет образования гипоиодита.
ХАРАКТЕРИСТИКА МЕТОДА:
Метод иодометрии, обратное титрование.
Рабочий раствор: 0,1 н р-р иода (избыточное точное количество)
0,1 н р-р натрия тиосульфата.
Вспомогательные вещества: 1 р-н р-р натрия гидроксида, 1 н р-р серной кислоты.
Т.В. : отмерить пипеткой с грушей определенный объем лекарственного средства, помещают в мерную колбу, довести водой до метки.
Отмерить объем разведения в колбу для титрования, прибавить избыточное точное количество 0,1 н р-ра иода и 1 н р-р гидроксида натрия. Смесь оставляют на несколько минут.
ХИМИЗМ:
I 2 + 2 NaOH NaOI + NaI + H2O
гипоидит
натрия
О O
// //
Н – С + NaI + NaOH H – C + NaI + H2O
 \
часть \
\
часть \
Н ONa
формиат натрия
Т.е. при взаимодействии иода со щелочью образуется гипоидит натрия, который окисляет формальдегид до кислоты, но в щелочной среде образуется соль. На окисление формальдегида расходуется часть гипоиодита натрия. Какое – то количество его остается в растворе, так как рабочего раствора натрия брали заведомый избыток. Чтобы узнать сколько гипоиодита (сколько 0,1 н р-ра иода) осталось, в колбу для титрования прибавить после стояния 1 н р-р серной кислоты. Жидкость приобретает красно-бурый цвет от выделившегося молекулярного иода.
N aOI + NaI + H2SO4 I2 + Na2SO4 + H2O
Выделившийся иод оттитровать 0,1 н р-ром натрия тиосульфата. Расчет ведут по разности между количеством иода и натрия тиосульфата.
I 2 + 2NaS2O3 2NaI + Na2S4O6
(VI2 – VNa2S2O3) * T*100*Vм.к.
% = ———————————————
а * V мер. пипетки
ХРАНЕНИЕ: в хорошо укупоренных склянках, в защищенном от
света месте, при температуре не ниже 90 С.
ПРИМЕНЕНИЕ: 1. для дезинфекции инструментов, одежды, помещения, рук.
2. оказывает дубящее действие на кожу, применяется при повышенной потливости ног.
3. для консервации анатомических и биологических
препаратов, 0,5-1% р-ры, 1:1000, 1:3000;
«формидрон», формалиновая мазь, лизоформ.
