
- •Раздел 6.: органические лекарственные
- •1. Образование йодоформа.
- •2. Образование сложного эфира с уксусной кислотой.
- •1. Ф и з и ч е с к и е свойства:
- •Раствор формальдегида
- •1.Реакция «серебряного зеркала» (выполняется полумикрометодом).
- •2. Реакция основана на способности формальдегида вступать в реакцию конденсации с фенолом в присутствии концентрированной серной кислоты.
- •Гексаметилентетрамин (уротропин)
- •Количественное определение:
1. Ф и з и ч е с к и е свойства:
низшие альдегиды – это газы, жидкости, имеющие неприятный запах.
высшие альдегиды – это твердые вещества, обладающие приятным цветочным запахом.
2. Ф а р м а к о л о г и ч е с к и е свойства:
- усиливает токсичность соединения;
- придает наркотическое и дезинфицирующее свойства (антисептические);
- строение углеводородного радикала влияет на характер действия на организм:
О
//
Н – С формалин антисептическое действие
\
Н
O
//
ССl3 – C H2O снотворное действие
\
H
хлоралгидрат
О
//
СН2ОН – (СНОН)4 – С общеукрепляющее действие
\
Н
глюкоза
Что видим: - введение в структуру галогена повышает наркотическое
(снотворное действие);
- удлинение углеводородного радикала усиливает
физиологическую активность (но до бесконечности это не происходит, так как приводит к повышению токсичности).
3. Х и м и ч е с к и е свойства альдегидов обусловлены наличием в молекуле альдегидной группы:
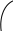
 δ-
δ-
О
δ+ //
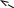 –
С
–
С
Н
В альдегидной группе в карбониле атомы углерода и кислорода имеют разную электроотрицательность.
- Какой из них более отрицательный? Ответ: атом кислорода.
Из этого следует, что электронная плотность сдвинута от атома углерода к атому кислороду, поэтому атом кислорода будет иметь частично отрицательный заряд, а атом углерода будет иметь частично положительный заряд. Стремясь компенсировать нехватку электронов он будет оттягивать на себя электронную плотность водорода, поэтому водород приобретает подвижность. По этой причине наиболее характерными для альдегидов будут реакции окисления (часто их называют «альдегидными реакциями»). Такими реакциями являются реакции «серебряного зеркала» и реакция с Cu(OH)2 при t0.
С другой стороны атом углерода в альдегидной группе находится в состоянии sp2 – гибридизации (что значит этот тип гибридизации?).
п О П – связь расположена перпендикулярно.
 δ
//
δ δ – связи
δ
//
δ δ – связи
– С 1200
\ δ
Н
Атом углерода является электрофильным центром и по месту разрыва – связи альдегидами будут свойственны реакции электрофильного присоединения. Эти реакции очень много (присоединение водорода, воды, спиртов – курс органической химии).
Кроме этого для альдегидов характерны реакции:
- взаимодействия с аминами и их производными;
- реакции полимеризации, конденсации.
Фармакопейными лекарственными средствами из группы альдегидов являются: раствор формальдегида, хлоралгидрат, гексаметилентетрамин.
Раствор формальдегида
Solutio Formaldehydi
О
//
Н – С хим. название: метаналь.
\
Н
Содержание формальдегида 36,5 – 37,5 %.
ПОЛУЧЕНИЕ: окисление метилового спирта.
Исходные вещества: метиловый спирт, катализатор - медь,воздух.
Метиловый спирт нагревают до 500 С, при этом легко образуются пары спирта. Через нагретый спирт пропускают воздух, который насыщается парами метилового спирта. Смесь воздуха с парами метилового спирта пропускают через трубку с раскаленной медной спиралью. На поверхности медной спирали идет окисление спирта.
1 .
2Сu
+ O2
2CuO
.
2Сu
+ O2
2CuO
O
CuO //
2 . CH3OH + CuO H – C + H2O + Cu
\
H
формальдегид
Газ формальдегид пропускают в воду до образования раствора с его концентрацией 36,5% - 37,5 %, то есть получают фармакопейный препарат.
Описание: прозрачная, бесцветная жидкость. Острого своеобразного запаха. Стабилизируют прибавлением метилового спирта.
Особое свойство: при хранении выпадает осадок (параформ) вследствие реакции полимеризации, поэтому нельзя хранить раствор формальдегида при температуре ниже 90 С.
 O
O
O
O
// //
n
 H
– C
H
– C
H
– C
H
– C
\ \ n
H H
РАСТВОРИМОСТЬ: смешивается с водой и спиртом.
ПОДЛИННОСТЬ: основана на восстановительных свойствах препарата:
