
- •Конспект
- •Глава 1. Состав и свойства газовой фазы при высоких температурах
- •1.1.Термодинамика реакций горения окиси углерода и водорода.
- •Co молей
- •3.2.Состав и кислородный потенциал газовой фазы.
- •1.3. Реакция водяного газа.
- •1.4 Взаимодействие углерода с кислородом, двуокисью углерода и водяным паром
- •1.5.1. Реакция взаимодействия углерода с двуокисью углерода.
- •1.5.3. Взаимодействие углерода с водяным паром
1.5.3. Взаимодействие углерода с водяным паром
Водяной пар взаимодействует с углеродом в соответствии с двумя реакциями:
(1) С+Н2О
= СО+Н2; ![]() =131,7
кДж (31465 кал)
=131,7
кДж (31465 кал)
(2) С+2Н2О = СО2+2Н2; =98,9 кДж (21710 кал)
Эти реакции проходят одновременно. Поэтому, кроме водорода и водяного пара, в равновесной газовой фазе присутствуют оба оксида углерода (СО и СО2). Однако, относительное развитее каждой из этих реакций зависит от температуры. При повышении температуры выход СО увеличивается по сравнению с СО2. Таким образом, при высокой температуре первая реакция получает большее развитие. В этом случае равновесная газовая фаза содержит больше монооксида углерода.
Влияние температуры на сдвиг равновесия этих реакций также связанно с величиной и знаком их тепловых эффектов. Тепловой эффект первой реакции больше, чем для второй. Поэтому температура сильнее влияет на сдвиг равновесия первой реакции. В результате газовая фаза обогащается СО.
Поскольку газовая фаза для этих реакций включает те же компоненты, что и реакция водяного газа, равновесие:
Н2О + СО = Н2 + СО2
также должно иметь место в этой системе. Кроме того, должно иметь место и равновесие реакции газификации углерода:
СО2 + С = 2СО
Общее равновесие в системе будет иметь место только в том случае, когда все частные реакции находятся в состоянии равновесия.
Это сложное равновесие можно представить схематически в следующем виде:
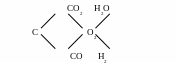
Присутствие твердого углерода в системе приводит к тому, что равновесный состав газовой фазы для реакции водяного газа уже не может быть произвольным.
Соотношение между СО и СО2 должно соответствовать константе равновесия реакции газификации углерода:
СО2
+ С = 2СО; 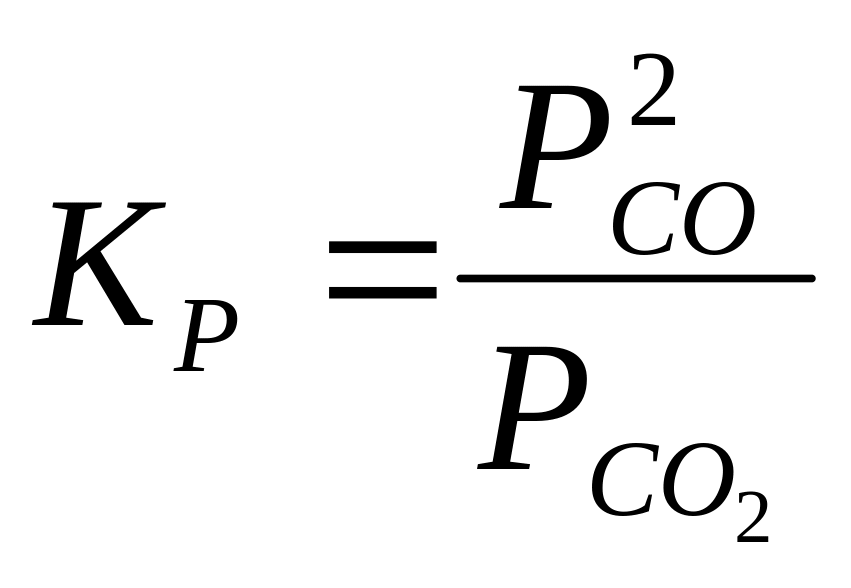
Таким
образом, величина отношения
![]() для реакции водяного газа становится
вполне определенной. В связи с этим,
величина отношения
для реакции водяного газа становится
вполне определенной. В связи с этим,
величина отношения
 также становится определенной. Поэтому,
в присутствии твердого углерода,
равновесие реакции водяного газа
характеризуется строго определенным
составом газовой фазы.
также становится определенной. Поэтому,
в присутствии твердого углерода,
равновесие реакции водяного газа
характеризуется строго определенным
составом газовой фазы.
Чем выше температура, тем больше отношение СО/СО2 и соответственно, больше величина отношения .
Когда температура достаточно велика, равновесная газовая фаза для реакции водяного газа в присутствии твердого углерода характеризуется очень большой величиной . Это значит, что газовая фаза содержит практически только СО и Н2. При этих условиях вторая реакция С+2Н2О = СО2+2Н2 практически не происходит. Кислородный потенциал такой газовой фазы – низкий.
Понижение давления в системе вызывает сдвиг равновесия реакции СО2 + С = 2СО в направлении образования большого количества СО. Это ведет к увеличению отношения СО/СО2, то есть к увеличению величины и соответственно к увеличению величины . Таким образом, понижение давления влияет на равновесие этой системы так же, как и повышение температуры.
На практике водяной пар иногда вводится в горн доменной печи вместе с дутьем. В этом случае, в связи с очень высокой температурой в горне доменной печи, взаимодействие Н2О с углеродом кокса происходит только по реакции С+Н2О = СО+Н2 и водяной пар полностью превращается в водород.
