
- •Конспект
- •Глава 1. Состав и свойства газовой фазы при высоких температурах
- •1.1.Термодинамика реакций горения окиси углерода и водорода.
- •Co молей
- •3.2.Состав и кислородный потенциал газовой фазы.
- •1.3. Реакция водяного газа.
- •1.4 Взаимодействие углерода с кислородом, двуокисью углерода и водяным паром
- •1.5.1. Реакция взаимодействия углерода с двуокисью углерода.
- •1.5.3. Взаимодействие углерода с водяным паром
ПРИАЗОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ТЕОРИИ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
ТАРАСЮК Л.И.
Конспект
лекций по теории металлургических процессов
для студентов специальности «Металлургия черных металлов»
Мариуполь - 2010
Глава 1. Состав и свойства газовой фазы при высоких температурах
Металлургические процессы представляют сложную комбинацию физико-химических превращений, происходящих при высоких температурах. Газовая фаза различного состава участвует в большинстве высокотемпературных металлургических процессах.
В процессах производства чугуна и губчатого железа высоко температурная газовая фаза характеризуется восстановительными свойствами. Взаимодействуя с оксидами железа, такая газовая фаза обеспечивает их восстановление. В процессах высокотемпературного рафинирования чугуна и некоторых цветных металлов газовая фаза имеет окислительный характер и является источником кислорода.
В процессах черной и цветной металлургии высокотемпературная газовая фаза включает такие компоненты, как O2, CO, CO2, H2, H2O. В зависимости от состава и температуры газовой фазы, ее окислительные и восстановительные свойства изменяются.
Методы термодинамики оказались очень полезными для исследования высокотемпературных свойств газовой фазы.
1.1.Термодинамика реакций горения окиси углерода и водорода.
Целью термодинамического анализа реакций горения является определение равновесного состава газовой смеси при данной температуре, давлении и исходном составе смеси.
Реакция горения окиси углерода может быть записана в следующей форме :
2СО(Г) + О2 (Г) = 2СО2 (Г) (1)
![]()
Реакция, записанная в такой форме, не отражает действительного механизма превращения; она только указывает на стехиометрическое соотношение между реагентами. Записанное уравнение указывает только на тот факт, что из двух молей СО и одного моля О2 получается в результате реакции два моля СО2.
Однако, для термодинамического нам нет необходимости знать точный механизм процесса. Такие важные величины как тепловой эффект и изменение энергии Гиббса, характеризующие реакцию, зависят только от начального и конечного (равновесного) состояний системы и не зависят от пути, по которому система переходит из начального состояния в конечное.
Горение
окиси углерода сопровождается значительным
выделением тепла. Величена теплового
эффекта, приведенная выше, соответствует
комнатной температуре. Для расчета
величены теплового эффекта этой реакции
при другой температуре необходимо
использовать уравнение температурной
зависимости теплоемкостей участвующих
в реакции веществ и величину
![]() .
.
В соответствии с законом Кирхгоффа, изменение Н с температурой характеризуется изменением теплоемкости системы:
-
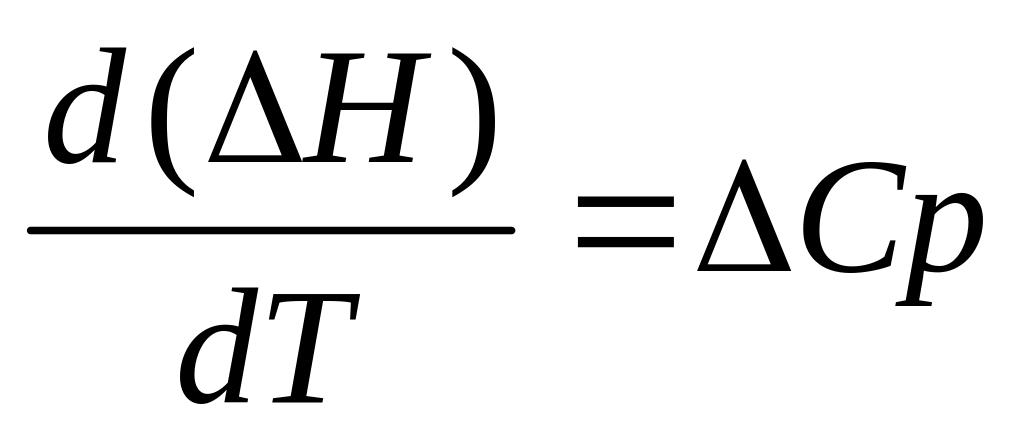
(2)
где Ср – изменение теплоемкости системы в результате реакции. Эта величена Ср представляет разность между теплоемкостями начальных и конечных веществ:
-
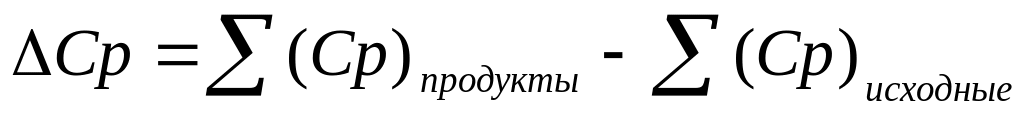
(3)
Теплоемкости веществ являются функциями температуры, и они обычно выражаются уравнениями следующего вида:
-
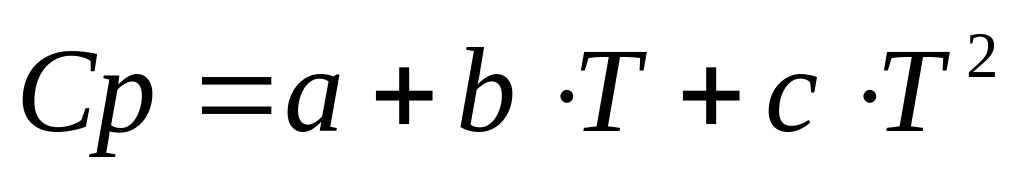
(4а)
или
-

(4в)
Принимая уравнение температурной зависимости теплоемкости в форме (4а) получаем, что изменение теплоемкости для реакции с различными веществами будет иметь вид:
-
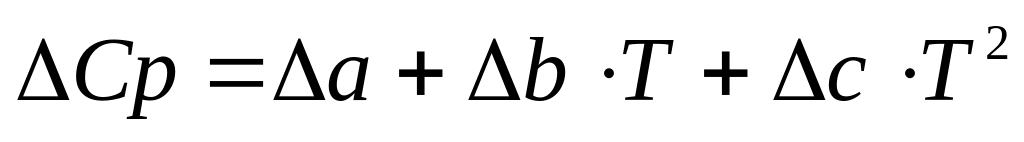
(5)
где а, b, с – алгебраические суммы соответствующих коэффициентов а, b и с для всех веществ, принимающих участие в реакции.
Вводя выражение (5) в уравнение (2), получим:
-
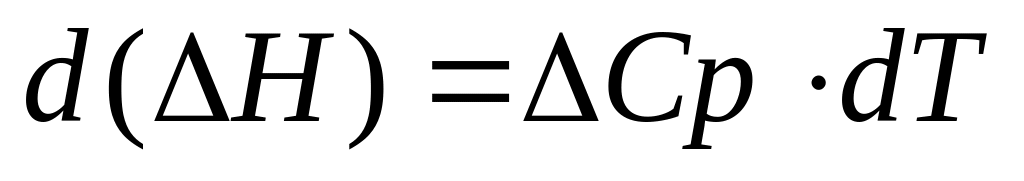
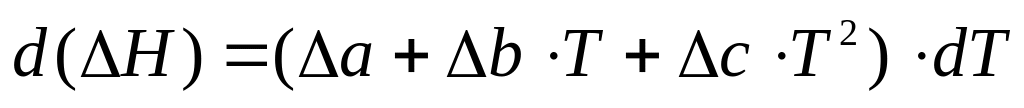
(6)
После интегрирования уравнения (6), получим:
-
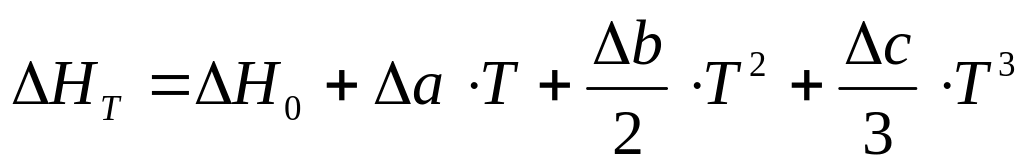
(7)
где Н0 представляет постоянную интегрирования.
Для определения величины НТ необходимо знать уравнение температурных зависимостей теплоемкости всех веществ, участвующих в реакции. Величину Н0 можно определить, зная величину НТ при какой-либо температуре. Для этой цели наиболее часто используют значение Н0298, которое находят в справочных таблицах.
Для реакции горения окиси углерода 2СО + О2 = 2СО2, уравнения температурных зависимостей теплоемкостей для всех участвующих в реакции веществ имеет следующий вид:
-
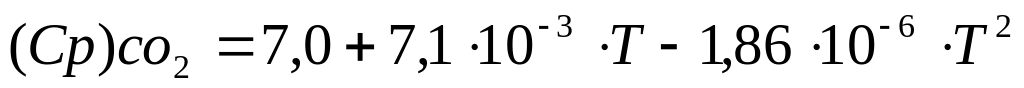
(8)
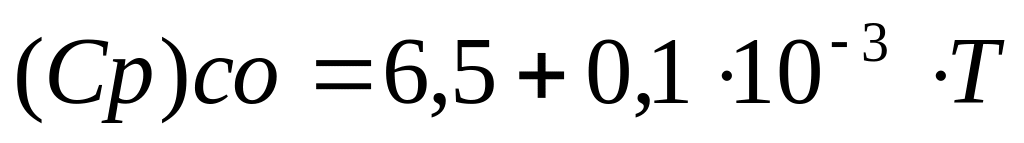
(9)
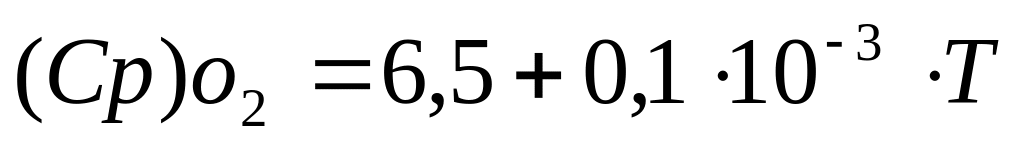
(10)
тогда:
Подставляя эти величины в нашу формулу для НТ (7), получим:
![]()
Используя величину стандартного изменения энтальпии для реакции горения окиси углерода НТ = Н0298 = -135270 кал. мы можем определить постоянную интегрирования Н0, подставляя в полученное уравнение для НТ величину Т=298 К. после расчета находим, что Н0 = -134095. таким образом, конечный вид уравнения для нахождения НТ имеет вид:
-
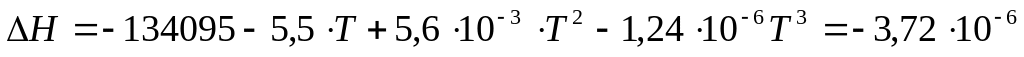
(11)
Расчет по этому уравнению дает следующие значения для НТ при высоких температурах:
Т,К |
НТ,кал |
298 |
-135270 |
1000 |
-135235 |
1500 |
-133120 |
2000 |
-132615 |
Из полученных данных видно, что разница между величинами Н0298 и НТ невелика.
Необходимо отметить, что зависимость Н от температуры определяется в основном величиной СР, т.е. изменением теплоемкости системы в результате реакции. Если это изменение невелико, то температура практически не влияет на величину теплового эффекта реакции. Как правило, для большинства металлургических реакций тепловой эффект незначительно изменяется с температурой. Поэтому для характеристики теплового эффекта многих реакций обычно используют стандартные изменения энтальпии этих реакций, т.е. Н0298.
Как видно из приведенных расчетов, реакция горения СО до СО2 сопровождается значительным выделением тепла во всем диапазоне температур, который имеет практическое значение в металлургии.
Соотношение между реагирующими веществами при равновесных условиях определяется константой равновесия соответствующей реакции. Для рассматриваемой реакции горения СО, константа равновесия, выраженная через парциальные давления реагирующих веществ, имеет вид:
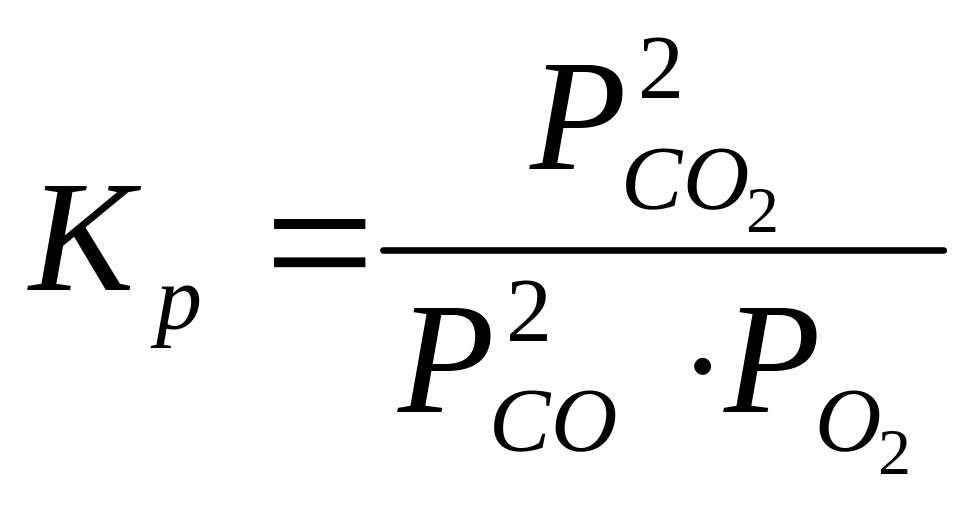
Константа равновесия для определенной реакции является функцией только температуры.
![]()
![]()
В то же время, равновесный состав газовой смеси может изменяться не только под влиянием температуры, но так же и при изменении давления. Качественная оценка влияния температуры и давления на состав равновесной системы может быть сделана с использованием принципа Ле Шателье.
Реакция горения окиси углерода сопровождается выделением тепла и уменьшением объема. Поэтому с увеличением температуры в системе, равновесие сдвигается в сторону образования большего количества исходных веществ, поскольку этот процесс сопровождается поглощением тепла. Таким образом, при повышении температуры развивается процесс разложения (или диссоциации СО2 на СО и О2:
(-Qp) 2CO + O2 = 2CO2 (+Qp)

увеличение Т
Соответственно, в новом равновесном состоянии, отвечающем более высокой температуре, парциальное давление СО2 в газовой фазе будет меньше, а парциальные давления СО и О2 увеличатся.
В соответствии с принципом Ле Шателье, увеличение давления в равновесной системе должно вызвать процесс, ведущий к понижению давления. Таким процессом является образование СО2, которое сопровождается уменьшением объема системы. Следовательно, более высокому давлению будет отвечать равновесный состав смеси с более высоким содержанием СО2 и более низким содержанием СО и О2 :
2CO + O2 = 2CO2

увеличение Р
Количественная зависимость состава равновесной смеси для реакции горения СО от температуры определяется зависимостью константы равновесия этой реакции от температуры:
-

(12)
Интегрирование уравнения изобары реакции представляет некоторые трудности, поскольку величина Н сама является функцией температуры.
Величина Н связана с изменением теплоемкости системы с температурой и может быть представлена выражением:
Подставляя это выражение в уравнение изобары реакции и проводя неопределенное интегрирование, мы получим:
-
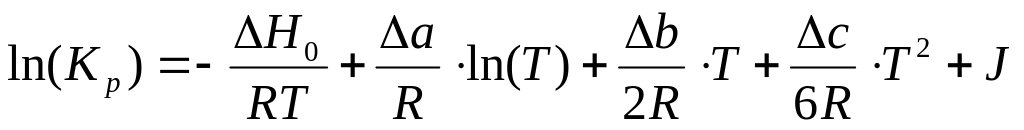
(13)
где J – постоянная интегрирования;
Н0 – некоторая постоянная величина, которая очень близка к стандартному тепловому эффекту реакции;
а,
b,
с
– алгебраические суммы соответствующих
коэффициентов “a”,
”b”
и ”с”
из уравнений теплоемкостей для всех
веществ участвующих в реакции; R
– универсальная газовая постоянная
(R=1,987
![]() ; R=8,314
; R=8,314
![]() ).
).
Подобные полиномальные формулы очень неудобны для практических расчетов. Анализ многих подобных формул показал, что сумма всех членов кроме первого слабо зависит от температуры. Таким образом, все эти члены можно объединить с постоянной интегрирования в некую обобщенную постоянную, и тогда само многочленное уравнение превращается в простое двухчленное уравнение:
-
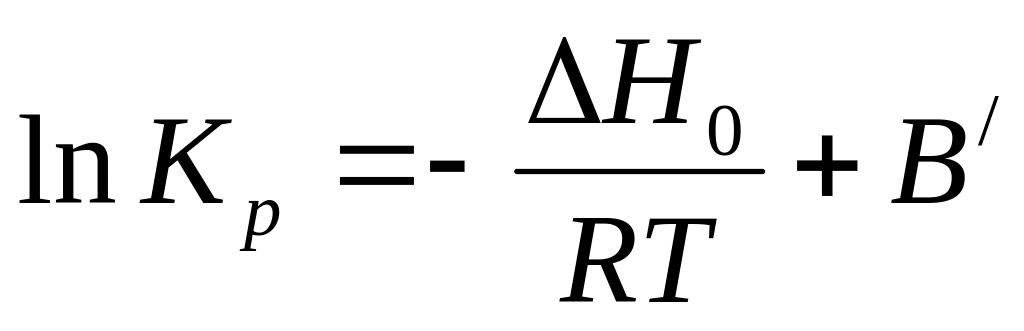
(14)
Переходя к десятичным логарифмам и принимая значение R=1,987 получаем:
-
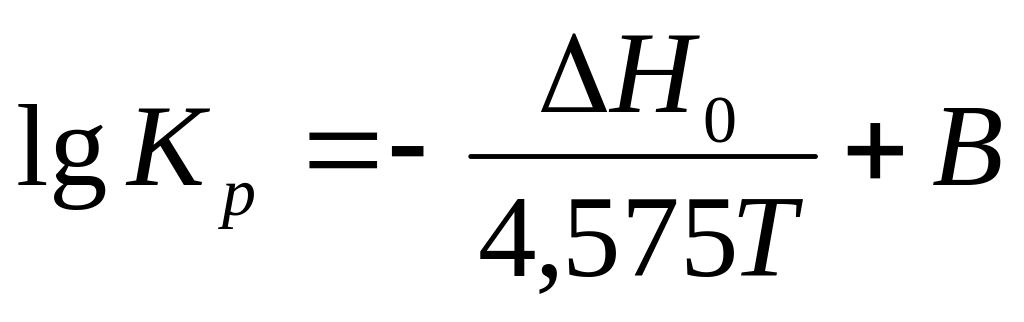
(15)
где
![]()
Обычно эта формула имеет более общую форму:
-
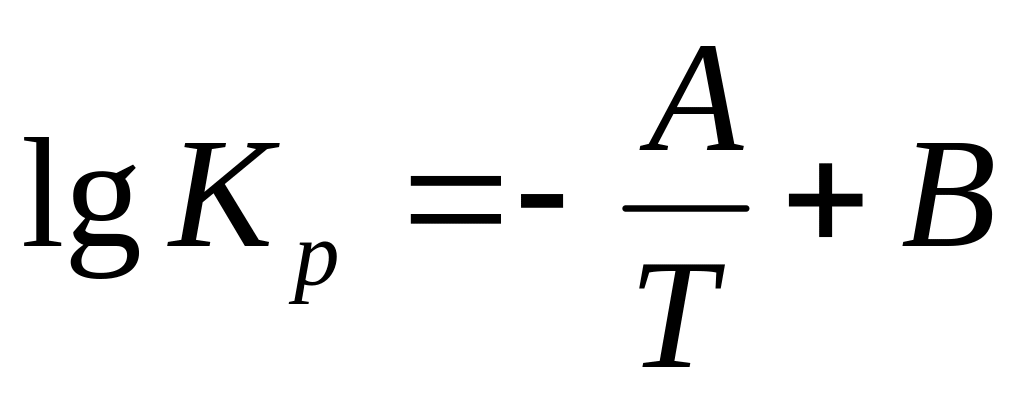
(16)
где
![]()
В настоящее время для большинства металлургических реакций величины коэффициентов А и В в таких двухчленных формулах определены на основе обобщения большого количества экспериментальных данных. Как результат этого, двухчленные формулы соответствуют практическим данным в большей степени, чем полиномальные формулы, которые получены только на основе теоретических предпосылок.
Этот парадокс объясняется тем, что основные законы физической химии, формулы и следствия этих законов справедливы только для идеальных газов, т.е. для систем, в которых взаимодействие между частицами отсутствует. На практике мы всегда имеем дело с реальными системами, поведение которых отклоняется в большей или меньшей степени от поведения идеальных систем. Мы учитываем эти отклонения от идеального поведения в величинах эмпирических коэффициентов А и В.
Двухчленные формулы широко используются в настоящее время для расчета величин констант равновесия реакции при различных температурах.
Для реакции горения окиси углерода получена следующая зависимость константы равновесия этой реакции от температуры:
-

(17)
Расчеты по этой формуле дают следующие результаты:
Т,К |
lgKp |
Kp |
1000 |
20,406 |
25,47.1019 |
1500 |
10,551 |
35,56.109 |
2000 |
5,623 |
41,98.104 |
2500 |
2,666 |
46,34.10 |
3000 |
0,695 |
4,955 |
Эти цифры показывают величину отношения парциального давления СО2 к парциальным давлениям СО и О2 в условиях равновесия. Если это отклонение слишком велико (например при температурах ниже 1000 К), то это свидетельствует об очень малых величинах Рсо и Ро2 в условиях равновесия системы СО2 – СО – О2.
Состав газовой смеси чаще всего дается в объемных процентах. Парциальные давления компонентов газовой смеси связаны с их процентным содержанием простым соотношением:
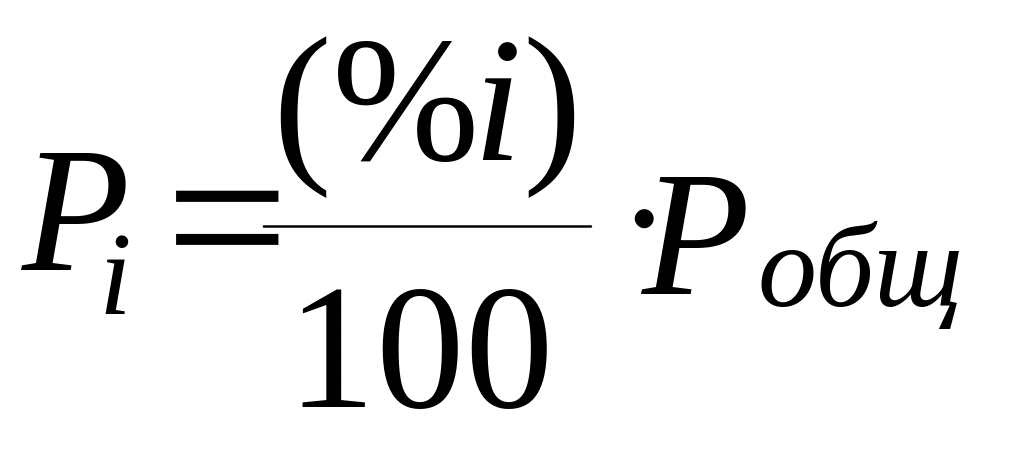
где
![]() –
парциальное давление компонента “i”
в смеси;
–
парциальное давление компонента “i”
в смеси;
(%
i)
– его концентрация в объемных процентах;
![]() –
общее давление.
–
общее давление.
Заменяя в константе равновесия парциальные давления объемными процентами, получаем:
-
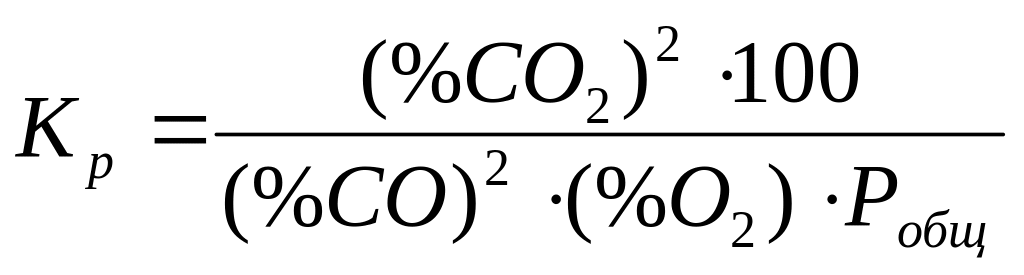
(18)
Тогда, (%О2) в равновесной смеси для этой реакции будет равен:
-
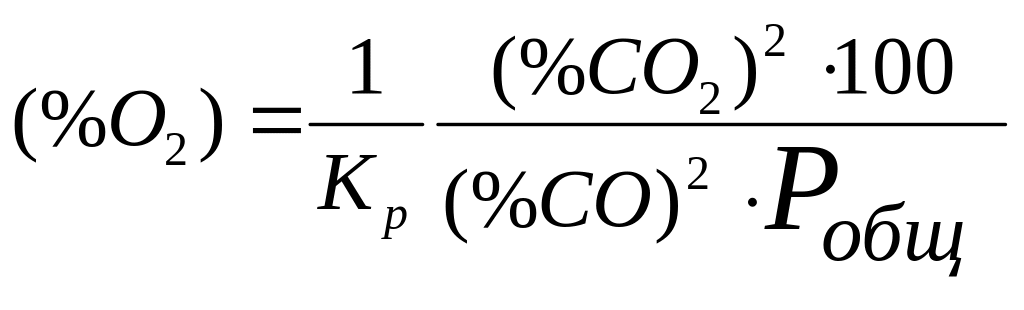
(19)
Взаимодействие между водородом и кислородом имеет много общего с реакцией горения окиси углерода. Эта реакция записывается как взаимодействие двух молей водорода с одним молем кислорода и образованием двух молей водяного пара:
-
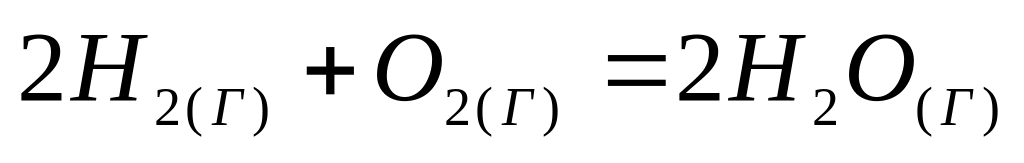
(20)
Н0298 = -115760 кал (-484340 Дж )
Как и в случае реакции горения окиси углерода, такая запись реакции не отображает реального механизма процесса, который имеет цепной характер с образованием большого числа промежуточных веществ. Но для термодинамического анализа важно знать начальное и конечное состояние системы. Поэтому запись реакции в этом виде в виде уравнения (20) достаточна для термодинамического анализа этой реакции.
Используя температурную зависимость теплоемкости для этой системы и уравнения (3) – (7), можно рассчитать величины тепловых эффектов для реакции (20) при более высоких температурах:
Т,К |
НТ,кал |
298 |
-115760 |
1000 |
-118510 |
1500 |
-120060 |
2000 |
-119930 |
2500 |
-117010 |
Из приведенных данных следует, что температура слабо влияет на величину теплового эффекта реакции горения водорода.
Константа равновесия реакции горения водорода, выраженная через парциальные давления реагирующих веществ имеет вид:
-
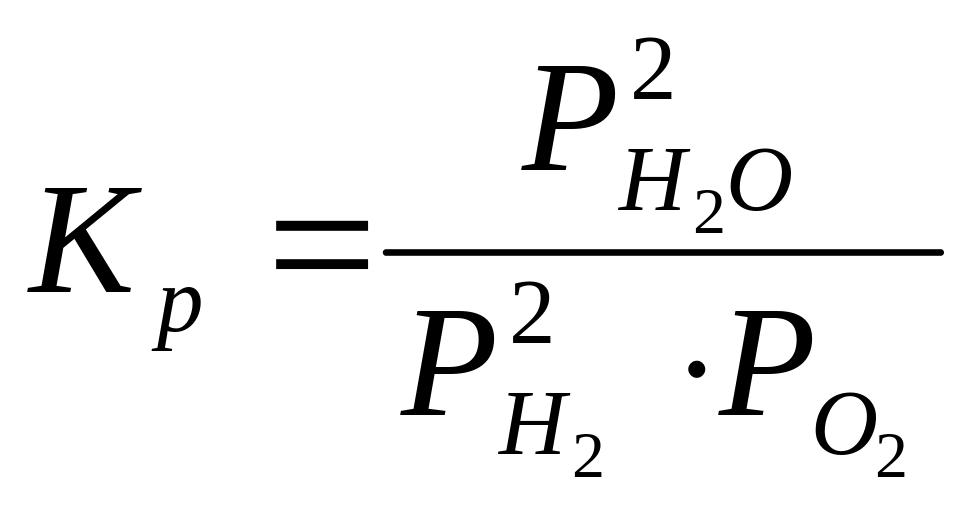
(21)
В соответствии с принципом Ле Шателье, повышение температуры сдвигает равновесие в сторону уменьшения парциального давления Н2О и увеличения парциального давления Н2 и О2. таким образом, взаимодействие между Н2 и О2 будет менее полным при повышении температуры.
Как и в предыдущем случае, величина Кр является функцией только температуры. Количественно зависимость константы равновесия реакции горения водорода от температуры выражается двухчленной формулой:
-
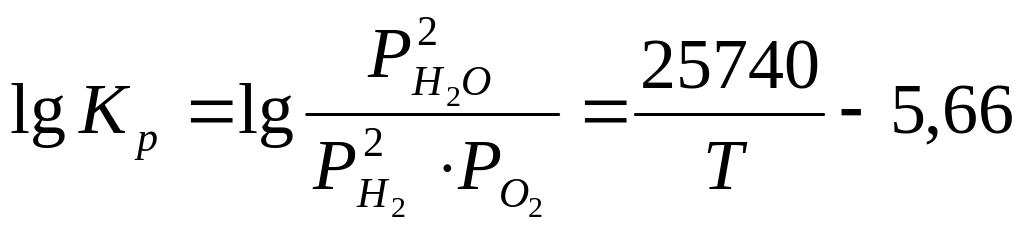
(22)
Процесс горения водорода сопровождается уменьшением объема системы. Поэтому, как и в случае горения СО, увеличение давления в системе способствует более полному переходу исходных веществ (Н2 и О2) в продукты реакции (Н2О). Иными словами, при повышении давления в системе равновесие реакции сдвигается вправо, в сторону увеличения равновесного давления Н2О:
2Н2 + O2 = 2Н2О
увеличение Р
Большинство химических соединений при повышении температуры начинают диссоциировать, т.е. разлагаться на свои составляющие компоненты.
Степень диссоциации химического соединения () представляет собой отношение числа разложившихся молекул химического соединения (nразл) к числу первоначально взятых (nисход):
![]()
Степень диссоциации выражается в долях от единицы или в процентах.
Продукты горения содержат СО2 и Н2О, которые могут диссоциировать при высоких температурах по реакциям:
2Н2О 2Н2 + O2
2CO2 2CO + O2
Реакции диссоциации сопровождаются поглощением тепла. В соответствии с принципом Ле Шателье, степень диссоциации будет увеличиваться с ростом температуры. Поскольку число молекул в системе увеличивается в процессе диссоциации, увеличение давления в системе будет снижать степень диссоциации.
Количественное определение влияния температуры и давления на степень диссоциации может быть найдена следующим образом.
Рассмотрим реакцию горения окиси углерода. Пусть в начальном состоянии в системе будет 1 моль СО2. После нагрева до высокой температуры и диссоциации молей СО2, в равновесной газовой смеси будем иметь следующее количество молей компонентов:
CO2 (1-) молей
