
- •Конспект
- •Глава 1. Состав и свойства газовой фазы при высоких температурах
- •1.1.Термодинамика реакций горения окиси углерода и водорода.
- •Co молей
- •3.2.Состав и кислородный потенциал газовой фазы.
- •1.3. Реакция водяного газа.
- •1.4 Взаимодействие углерода с кислородом, двуокисью углерода и водяным паром
- •1.5.1. Реакция взаимодействия углерода с двуокисью углерода.
- •1.5.3. Взаимодействие углерода с водяным паром
1.3. Реакция водяного газа.
На практике мы часто имеем дело с газовыми смесями, содержащими Н2,СО,О2 и продукты их взаимодействия Н2О и СО2. Общая реакция, в которой участвуют все эти вещества, называется реакцией водяного газа:
Н2О+СО=Н2+СО2 (41)
Термодинамические характеристики реакции водяного газа могут быть получены из соответствующих величин для реакции горения Н2 и СО:
(1) 2Н2+О2=2Н2О (Н0298)1= - 115760 (кал)
(2) 2СО+О2=2СО2 (Н0298)2= - 135270 (кал)
(3) =(2)-(1)/2 Н2О+СО=Н2+СО2 Н3=1/2(Н2-Н1)
(Н0298)3= - 9755 (кал)
Таким же образом определяем величины Н3 для других температур :
Т, К Н3, кал
298 -9755
1000 -8362
1500 -6530
2000 -6342
Необходимо обратить внимание на тот факт, что абсолютная величина ∆Н для этой реакции значительно меньше, чем для двух предыдущих реакций. Поэтому можно ожидать сравнительно слабое влияние температуры на равновесный состав смесей Н2-Н2О-СО-СО2 .
Выражение для константы равновесия реакции водяного газа имеет вид:
 (42)
(42)
Это выражение может быть заменено следующим:
 (43)
(43)
Из последнего выражения следует, что одна и та же величина Кр может соответствовать различным соотношениям между реагирующими веществами. Действительно, величина Кр равная, например, единице, может соответствовать бесчисленным составам газовых смесей:
Смесь № |
I |
II |
III |
IV |
/ |
1 |
3 |
7 |
8 |
РСО/ |
1 |
3 |
7 |
8 |
КР |
1 |
1 |
1 |
1 |
Таким образом, при каждой температуре эта реакция может иметь огромное число равновесных составов. Это связано с тем, что реакция водяного газа соответствует однофазной системе с тремя компонентами и, в соответствии с правилом фаз характеризуется четырьмя термодинамическими степенями свободы:
С=К+2-Ф=3+2-1=4
Однако, эти равновесные составы не являются произвольными. Если обозначить отношение / через а, а отношение РСО/ через в, то величина Кр для реакции водяного газа будет иметь вид:
 (44)
(44)
Для того, чтобы величина Кр поддерживалась постоянной при постоянной температуре, для каждой величины а имеется только одна определённая величина в. исходя из приведенного выше выражения, можно сделать следующее замечание:
равновесные составы газовых смесей для реакции водяного газа не могут быть произвольными; все они связаны постоянством отношения а/в.
 Соотношение
между а
и в измеряется
температурой. Характер этого изменения
можно объяснить следующим образом.
Схематично механизм равновесия реакции
водяного газа можно представить следующим
образом:
Соотношение
между а
и в измеряется
температурой. Характер этого изменения
можно объяснить следующим образом.
Схематично механизм равновесия реакции
водяного газа можно представить следующим
образом:
Н2 СО
О2
Н2О СО2
Когда мы рассматриваем равновесие реакции водяного газа, то реально имеют место два равновесия:
 Н2 СО
Н2 СО
 О2
и О2
О2
и О2
Н2О СО2
т.е. фактически имеют место равновесия реакции горения водорода и реакции горения окиси углерода.
Вся система будет находиться в равновесии, когда давление кислорода в ней станет одинаковым для этих двух равновесий. Однако, при одном и том же давлении кислорода в системе, величина отношения Н2/Н2О и СО/СО2 будет различной . Дело в том, что величина этих отношений зависит от химического сродства Н2 и СО к кислороду. При низкой температуре(ДО 810 0С) СО имеет большое сродство к кислороду, чем Н2 . Поэтому , при низких температурах в равновесной газовой фазе будет меньше СО, чем Н2 и соответственно, отношение СО/СО2 будет меньше, чем отношение Н2/Н2О. При высоких температурах зависимость будет обратная (рис.6).
Таким образом, мы можем определить зависимость между а и в при различных температурах:
t < 810 0C; а>в ; Кр= а/в>1
t = 810 0C; а=в ; Кр= а/в=1
t > 810 0C; а<в ; Кр= а/в<1
Температурная зависимость Кр и G0 для реакции водяного газа может быть легко получена из соответствующих выражений для реакции горения СО и Н2:
![]()
![]()
После соответствующих расчетов мы получаем :
lgKP(В.Г.)=1913/Т- 1,75 (45)
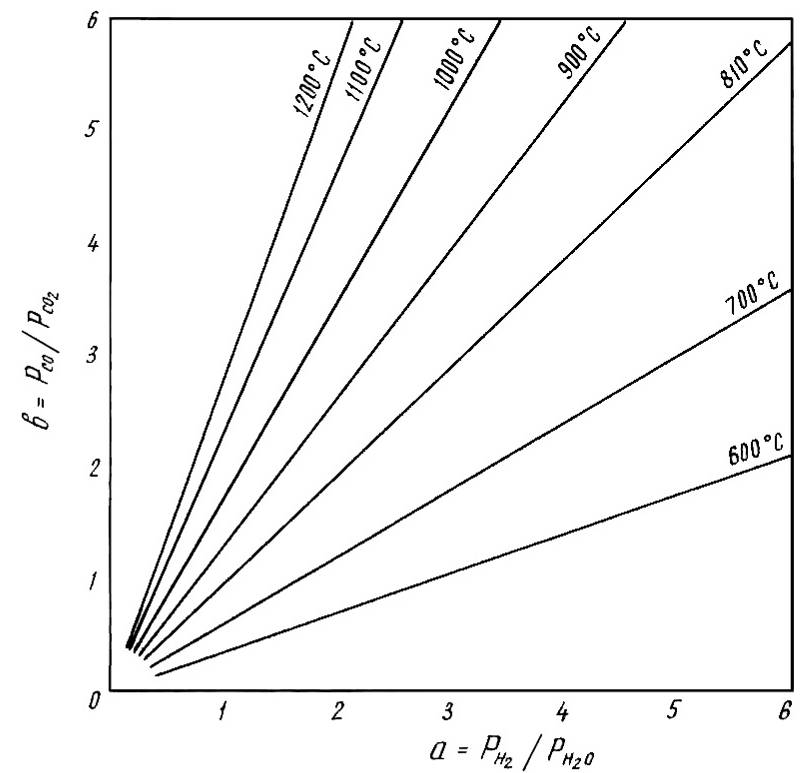
Рис.6-Зависимость
между величинами a=
/
и в=
РСО /
![]() для
реакции
для
реакции
водяного газа при различных температурах
G0(В.Г.)= -8750 + 8,01Т (в кал.) (46)
Реакция водяного газа развивается без изменения объема. Поэтому давление не влияет на равновесный состав системы. В связи с этим, мы можем заменить парциальные давления компонентов на объемные проценты соответствующих газов в выражении для константы равновесия :
KP= · / ·РСО=(%Н2)(%СО2)/(%Н2О)(%СО)
Равновесие реакции водяного газа характеризуется неопределенностью состава газовой смеси. Однако, мы можем легко рассчитать равновесный состав газовой смеси для этой реакции, если известен исходный состав смеси.
Обозначим исходный состав смеси газов СО, СО2, Н2, Н2О как :
(%СО)исх= а
(%СО2)исх=в
(%Н2)исх=d
(%Н2О)исх=e
Пусть общее количество исходной смеси будет 100 молей:
а + в + d + e=100
Пусть для достижения равновесного состояния системы необходимо уменьшить количество СО2 на m молей . В соответствии с уравнением реакции водяного газа, это приведет к уменьшению Н2 так же на m молей. Число молей Н2О и СО2, которые появляются благодаря реакции, должно быть таким же. Таким образом, равновесные концентрации реагирующих веществ будут следующими:
(%СО)равн= а+m
(%СО2)равн=в-m
(%Н2)равн=d-m
(%Н2О)равн=e+m
Подставляя эти величины в выражение для константы равновесия, получаем:
 (47)
(47)
Решая это уравнение относительно m, мы можем найти равновесие концентрации всех газов при данной температуре Т.
