
- •Общеаналитические реакции катионов группы гидроксидов, растворимых в растворе аммиака.
- •7. Сероводород h2s осаждает из нейтральных растворов все катионы шестой аналитической группы в виде соответствующих сульфидных соединений:
- •Характерные и специфические реакции катионов меди.
- •1. Взаимодействие катионов меди с раствором аммиака.
- •Характерные и специфические реакции катионов двухзарядной ртути.
- •2. Иодид калия (kj) образует с катионами ртути (II) осадок иодида ртути HgJ2 красного цвета, который в избытке реактива растворяется с образованием устойчивого комплексного соединения:
- •Характерные и специфические реакции кадмия.
- •Осаждение катионов кадмия в виде CdS.
- •2. Открытие катионов кадмия иодидом калия kj.
- •Характерные и специфические реакции катионов кобальта.
- •Взаимодействие кобальта с роданид - ионами.
- •Взаимодействие катионов кобальта с нитритом калия.
- •Характерные и специфические реакции катионов никеля.
- •Второй путь систематического хода анализа.
- •Дробный ход анализа катионов шестой аналитической группы.
- •Вопросы для самостоятельной работы.
Взаимодействие катионов кобальта с нитритом калия.
Раствор, содержащий катионы кобальта Co2+, подкисляют CH3COOH, прибавляют небольшое количество раствора нитрита калия KNO2 с массовой долей 20%, нагревают и дают раствору некоторое время стоять. При наличии в растворе катионов Co2+ из него выпадает желтый кристаллический осадок гексанитритокобальтата (III) калия:
CoCl2 + 7KNO2 + CH3COOH = K3[Co(NO2)6 ]↓+ NO↑ + 2KCl + H2O +
+ 2 CH3COOK
или в случае трехзарядного кобальта Co3+
CoCl3 + 6KNO2 = K3[Co(NO2)6]↓ + 3KCl
Вместо нитрита калия KNO2 для выполнения этой реакции можно использовать смесь солей KNO2 + NaNO2 в отношении (2:1); в этом случае также образуется желтый кристаллический осадок состава K2Na[Co(NO2)6]↓. С катионами трехзарядного кобальта Co3+ эта реакция протекает сравнительно быстро; а с двухзарядным Co2+ она протекает труднее. Поэтому перед открытием катионов кобальта данной реакцией к анализируемому раствору рекомендуется предварительно добавить несколько капель пероксида водорода H2O2 и нагреть до кипения. Катионы других аналитических групп не мешают открытию катионов кобальта. Но, если в растворе присутствуют катионы никеля Ni2+, то открытию кобальта этой реакцией будут мешать катионы Cu2+, Sr2+, Ba2+, Pb2+, так как в их присутствии катионы Ni2+ образуют также желтый осадок двойной соли H2Me[Ni(NO2)6].
3. Взаимодействие катионов кобальта с тетрароданомеркуриатом (II) аммония (NH4)2[Hg(SCN)4].
0,5 мл тетрароданомеркуриата (II) аммония подкисляют 5 каплями 2н раствора H2SO4 и прибавляют к нему равные объемы: в начале раствора ZnSO4 массовой доли 10%, затем раствора соли кобальта. При этом из раствора выпадает сине – голубой кристаллический осадок двойной комплексной соли тетрароданомеркуриат (II) цинка, кобальта:
CoSO4 + 2(NH4)2[Hg(SCN)4] + ZnSO4 = Zn[Hg(SCN)4] * Co[Hg(SCN)4] ↓
+ 2(NH4)2 SO4
Из шестой группы открытию этой реакции мешают катионы меди Cu2+, которые в присутствии данного реактива и солей цинка образуют оливково – зеленый осадок двойной соли. Из других аналитических групп мешают катионы Fe3+, дающие с реактивом темно – бурую окраску, которая маскирует окраску осадка Co2+. Катионы Cd2+, Sn2+, Zn2+, Pb2+, Ag+, Hg22+, Sb3+ образуют осадки белого цвета, Bi3+, Cr3+ - бледно – фиолетового, Fe2+- светло – серого и Ni2+ - светло – зеленой окраски.
Характерные и специфические реакции катионов никеля.
Характерных общеаналитических реакций на катионы никеля нет. Открытие катионов никеля производится специфическими реакциями, из которых наиболее распространенной является взаимодействие катионов Ni2+ с диметилглиоксимом (реакция Л.А. Чугаева). В результате данной реакции образуется внутрикомплексная соль диметилглиоксимата никеля, обладающая характерной ало – красной окраской:
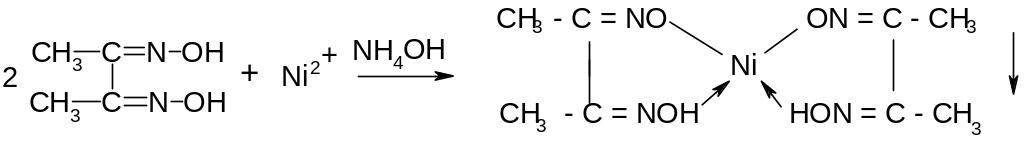
Данная реакция протекает легко в аммиачной среде, когда никель предварительно переведен в комплексный ион. Проводится реакция следующим образом: к небольшой порции раствора соли никеля приливают NH4OH до полного растворения образовавшегося в начале осадка, затем несколько капель диметилглиоксима. В результате из раствора выпадает ало – красный осадок комплексной соли. Катионы шестой аналитической группы не мешают открытию катионов никеля Ni2+данной реакцией. Если в растворе содержатся эти катионы меди в больших концентрациях, то катионы эти, образуя с избытком NH4OH интенсивную лазурно – синюю окраску раствора, маскируют осадок диметилглиоксима никеля, особенно при малых его концентрациях.
Когда возникает неуверенность в наличии катионов никеля Ni2+, то катионы меди из раствора удаляют. Для этого к раствору смеси катионов шестой аналитической группы приливают гидроксид натрия NaOH и нагреванием переводят Cu(OH)2 → CuO↓осадок черного цвета, который в NH4OH нерастворим, осадок центрифугирует, а из центрифугата открывают катионы Ni2+. Катионы меди и ртути можно из раствора удалить сероводородной водой в виде CuS и HgS, как это было сказано выше.
Из катионов других аналитических групп этой реакции мешают катионы железа Fe2+, которые с диметилглиоксимом дают красное окрашивание. Железо Fe2+ легко перевести в Fe3+ окислением двухзарядного железа в трехзарядное пероксидом водорода.
Указанную реакцию на Ni2+можно проводить одним из следующих капельных методов (в присутствии катионов всех аналитических групп):
К небольшой порции раствора прибавим 3-4 капли пероксида водорода H2O2 для окисления Fe2+ → Fe3+, затем избыток NH4OH, если осадок не полностью растворился, его центрифугируют. После этого каплю центрифугата помещают на фарфоровую пластинку и прибавляют к ней каплю диметилглиоксима.
При наличии в растворе ионов никеля сначала образуется ярко – розовое окрашивание, затем выпадает ало – красный осадок.
На фильтруемую бумагу наносят каплю раствора Na2HPO4, в центр образовавшегося пятна – каплю исследуемого раствора и каплю пероксида водорода H2O2, снова еще каплю Na2HPO4 и каплю диметилглиоксима. Затем полученное на бумаге пятно обрабатывают парами NH4OH. При наличии в растворе катионов никеля Ni2+ все пятно или его периферия окрашивается в розовый цвет.
Систематический ход анализа смеси катионов шестой аналитической группы.
При систематическом ходе анализа катионов шестой аналитической группы используется отношение их к раствору аммиака NH4OH и отношение их сульфидных соединений к кислотам. Выделение каждого из катионов данной группы:
1) начальной обработкой его разбавленным раствором NH4OH или
2) начальной обработкой анализируемого раствора тиосульфатом натрия Na2S2O3 ∙ 5H2O в кислой среде. При этом в первом случае из раствора осаждаются катионы и основная часть катионов кобальта, во втором случае – катионы меди Cu2+ и ртути Hg2+.
Первый путь систематического хода анализа.
Выделения ртути и кобальта.
К анализируемому раствору, если раствор кислый, его в начале нейтрализуют раствором аммиака, добавляют 1,5 – 2 - кратный объем 2н раствора NH4OH и полученный при этом осадок [NH2Hg]Cl и CoOHCl отделяют центрифугированием, а в центифугате остаются катионы меди, никеля, кадмия в виде соответствующих аммиачных комплексов [Cu(NH3)4]SO4, [Cd(NH3)4]Cl2, Ni(NH3)6]Cl2.
а) Открытие кобальта.
Осадок солей ртути и кобальта обрабатывают разбавленной серной кислотой. Под действием серной кислоты основная соль кобальта переходит в раствор, а меркуриат аммония остается в осадке, который отделяют центрифугированием. Из центрифугата открывают катионы кобальта роданидом калия или аммония (микрометодами или лучше капельной реакцией).
б) Открытие ртути.
Осадок [NH2Hg]Cl растворяют в небольшом количестве концентрированной азотной кислоты HNO3 и полученном растворе открывают катионы ртути любой характерной для них реакцией.
2. Выделение и открытие катионов меди Cu2+.
К центрифугату, содержащему в своем составе аммиакаты меди, никеля, кадмия, приливают избыток серной кислоты H2SO4 (до явно кислой реакции), помещают в этот раствор 2-3 кристалла Na2S2O3 ∙ 5H2O и в течение 2-3 минут кипятят. При этом катионы меди выпадают в осадок CuS, а катионы кадмия и никеля остаются в растворе. Осадок CuS центрифугируют, растворяют при нагревании в разбавленной HNO3 и полученный при этом раствор проверяют на катионы меди любой характерной реакцией.
Центрифугат от CuS делят на две части и в одной из них открывают Cd2+, а в другой никель.
3. Открытие кадмия и никеля.
3-5 капель от первой части центрифугата от CuS приливают к 2-3мл слабого раствора сероводородной воды. Выпадение ярко – желтого осадка CdS указывает на наличие в растворе катионов кадмия.
Вторую часть центрифугата от CuS несколько минут кипятят (для удаления из него H2S и серы). Если при этом образуется осадок, его отделяют центрифугированием и к охлажденному центрифугату приливают NH4OH до полного растворения образовавшегося в начале осадка. Затем из полученного аммиачного раствора открывают никель диметилглиоксином. Из этого раствора можно открыть катионы Cd2+ действием на него концентрированным раствором KJ.
Первая схема систематического хода анализа катионов шестой аналитической группы.
Осадок:
[NH2Hg]Cl
и CoOHCl
обрабатывают разбавленной серной
кислотой H2SO4
и центрифугируют
Анализируемый
раствор: приливают разбавленный раствор
NH4OH
и центрифугируют

Осадок:
[NH2Hg]Cl
соль меркураммония растворяют в
концентрирован-ной HNO3
и проверяют на ртуть Hg2+
раствором иодида калия, сероводородной
водой или восстановлением до металлической
Центрифугат:
Co2+открывают
роданидом аммония капельным методом
Центрифугат:
[Cu(NH3)4]SO4,
[Cd(NH3)4]Cl2,
Ni(NH3)6]Cl2
обрабатывают тиосульфатом
Na2S2O3
∙ 5H2O
или H2S
в кислой среде и центрифугируют


Центрифугат:
Ni2+,
Cd2+
Открывают
Cd2+ 1мл
центрифугата разбавлением
небольшой кипятят, обрабатывают порции
центрифугата раствором NH4OH
и сероводородной
водой открывают Ni2+диметил- желтый
осадок CdS.
глиоксимом ало-
красный осадок.

Осадок:
CuS
растворяют
в разбавленной HNO3
и проверяют
на Cu2+избытком
NH4OH
лазурно-синее окрашивание комплекса
меди.
