
- •Биохимия лабораторный практикум
- •Часть 1
- •Протокол №___
- •Биохимия лабораторный практикум
- •Пояснительная записка
- •Оформление лабораторного журнала
- •Лабораторная посуда и оборудование для биохимических исследований
- •Мытье лабораторной посуды
- •Лабораторное Оборудование
- •Подготовка воды для клинико-биохимических исследований
- •Общие правила работы с наборами для клинико-биохимических исследований
- •Калибровка мерной посуды
- •Применение международной системы единиц (си) в биохимической лабораторной практике
- •Методы расчета экспериментальных данных
- •Приготовление и исследование образцов
- •Экстр акция бав из растительных тканей
- •Приготовление гомогената из растительных тканей
- •Получение плазмы и сыворотки крови
- •Приготовление гомогената из тканей животных
- •Методики подготовки фав исследуемых образцов
- •Раздел 1 работа № 1. Цветные реакции на белки и аминокислоты
- •1.1. Биуретовая реакция (реакция Пиотровского)
- •Оборудование и посуда: штатив с пробирками, капельницы или пипетки. Порядок выполнения работы
- •1.2. Реакция Миллона
- •Порядок выполнения работы
- •1.3. Ксантопротеиновая реакция (Мульдера)
- •Порядок выполнения работы
- •1.4. Реакция Адамкевича
- •Порядок выполнения работы
- •1.5. Реакция Шульце-Распайля
- •Порядок выполнения работы
- •1.6. Реакция Фоля
- •Порядок выполнения работы
- •1.7. Нингидриновая реакция (реакция Руэманна)
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •1.8. Реакция с формальдегидом
- •Порядок выполнения работы
- •Работа №2. Реакции осаждения белков
- •2.1. Реакции осаждения белков при нагревании
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •2.2. Осаждение белков солями тяжёлых металлов
- •Реактивы и материалы: раствор яичного белка или разбавленная сыворотка крови, сернокислая медь, 5% раствор, уксуснокислый свинец, 5% раствор, азотнокислое серебро, 3% раствор.
- •Порядок выполнения работы
- •2.3. Осаждение белков алкалоидными реактивами
- •Порядок выполнения работы
- •2.4. Осаждение белков концентрированными минеральными кислотами
- •Порядок выполнения работы
- •2.5. Осаждение белков органическими кислотами
- •Порядок выполнения работы
- •2.6. Осаждение белков органическими растворителями
- •Порядок выполнения работы
- •2.7. Осаждение белков фенолом
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •2.8. Отделение альбуминов от глобулинов в сыворотке крови методом высаливания сернокислым аммонием и хлористым натрием
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •Работа №3. Макромолекулярная природа белка
- •Сопоставление молекулярного веса гемоглобина и рибофлавина
- •Порядок выполнения работы
- •3.2. Диализ белка
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •3.3. Хроматография аминокислот на бумаге
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •Работа № 4. Сложные белки
- •4.1. Нуклеопротеины
- •4.1.1. Кислотный гидролиз нуклеопротеинов дрожжей и определение их состава
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •4.1.2. Изучение химического состава рибонуклеопротеинов дрожжей
- •Порядок выполнения работы
- •4.2. Хромопротеины
- •4.2.1. Открытие железа в гемоглобине
- •Порядок выполнения работы
- •4.2.2. Получение кристаллов гемина (Тейхмана)
- •Порядок выполнения работы
- •4.3. Фосфопротеины
- •4.3.1. Гидролиз казеина и открытие в гидролизате белкового компонента и фосфорной кислоты
- •Порядок выполнения работы
- •4.4. Гликопротеины
- •4.4.1. Выделение муцина и реакции на его белковую часть и углеводную группировку
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •4.4.2. Реакция с азотной кислотой
- •Порядок выполнения работы
- •Работа № 5. Свойства ферментов
- •5.1. Гидролиз крахмала α-амилазой слюны
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •5.2. Термолабильность α-амилазы слюны
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •5.3. Специфичность α-амилазы слюны и сахарозы дрожжей
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •5.4. Влияние рН на активность α-амилазы слюны (определение оптимума рН для действия амилазы)
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •5.5. Влияние активаторов и ингибиторов на активность α-амилазы слюны
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •Порядок выполнения работы
- •5.6.3. Установление термолабильности уреазы
- •Порядок выполнения работы
- •5.7. Исследование ферментативной активности липазы
- •5.7.1. Исследование действия липазы на липиды животного происхождения
- •Порядок выполнения работы
- •5.7.2. Исследование действия липазы на липиды растительного происхождения
- •Порядок выполнения работы
- •Работа № 6. Определение ферментативной активности
- •6.1. Определение активности -амилазы по Вольгемуту
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •6.2. Определение активности каталазы крови по Баху и Зубковой
- •Порядок выполнения работы
- •Рекомендации к составлению протокола.
- •Работа № 7. Витамины. Качественный анализ витаминов
- •7.1. Витамин в1 (тиамин, анейрин)
- •Реакция окисления витамина в1 в тиохром (2,7-диметилтиохромин-8-этанол)
- •Порядок выполнения работы
- •7.2. Витамин в2 (рибофлавин)
- •Реакция восстановления витамина в2
- •Порядок выполнения работы
- •7.3. Витамин Вб (пиридоксин, адермин)
- •Реакция витамина Вб с хлорным железом
- •Порядок выполнения работы
- •7.4.Витамин в12 (цианкобаламин, антианемический)
- •Открытие кобальта, содержащегося в витамине в12, реакцией с тиомочевиной
- •Порядок выполнения работы
- •7.5. Витамин рр (никотинамид, антипеллагрический)
- •7.5.1. Качественная реакция на никотиновую кислоту с уксуснокислой медью
- •7.6.1. Реакция на витамин с железосинеродистым калием
- •Порядок выполнения работы
- •7.6.2. Качественная реакция на витамин с с метиленовой синью
- •Порядок выполнения работы
- •7.6.3. Качественная реакция на витамин с с 2,6-дихлорфенолиндофенолом
- •Порядок выполнения работы
- •7.7. Витамин а (ретинол)
- •7.7.1. Открытие витамина а в рыбьем жире с концентрированной серной кислотой
- •Порядок выполнения работы
- •7.7.2. Открытие каротина в шиповнике и обнаружение в нем ненасыщенных связей
- •Порядок выполнения работы
- •7.8. Витамин d (кальциферол, антирахитический)
- •Обнаружение витамина d в рыбьем жире с анилиновым реактивом
- •Порядок выполнения работы
- •7.9. Витамин е (токоферолы, витамин размножения)
- •Качественная реакция на витамин е с концентрированной азотной кислотой
- •Порядок выполнения работы
- •7.10. Витамин к (филлохинон, антигеморрагический)
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •Работа № 8. Количественный анализ витаминов
- •8.1. Определение витамина с йодометрическим методом
- •Порядок выполнения работы
- •8.2. Количественное определение витамина р (рутина) в чае
- •Порядок выполнения работы
- •Работа № 9. Углеводы
- •9.1. Хроматографический анализ углеводов
- •Порядок выполнения работы
- •9.2. Реакции на открытие углеводов. Свойства углеводов
- •9.2.1. Реакция «серебряного зеркала»
- •Порядок выполнения работы
- •9.2.2. Реакция Селиванова (открытие фруктозы)
- •Порядок выполнения работы
- •9.2.3. Проба Бенедикта на глюкозу
- •Порядок выполнения работы
- •9.2.4. Реакция Молиша
- •Порядок выполнения работы
- •9.2.5. Цветная реакция с ванилином на фруктозу
- •9.2.8. Проба Гайнеса
- •Порядок выполнения работы
- •9.2.11. Реакция с тимолом
- •Порядок выполнения работы
- •9.2.12. Восстанавливающая способность лактозы
- •Порядок выполнения работы
- •9.2.13. Отсутствия восстанавливающей способности сахарозы
- •Порядок выполнения работы
- •9.2.14. Растворение целлюлозы в медноаммиачном растворе
- •Порядок выполнения работы
- •9.2.15. Взаимодействие полисахаридов с йодом
- •Порядок выполнения работы
- •9.2.16. Действие на углеводы реактива Фелинга
- •Порядок выполнения работы
- •9.3. Йодометрический метод определения лактозы
- •Порядок выполнения работы
- •Расчёт результатов
- •Работа № 10. Выделение и анализ гликогена
- •10.1. Выделение гликогена из дрожжей
- •Порядок выполнения работы
- •Расчёт результатов
- •11.1. Липиды и их обмен
- •11.1.1. Открытие непредельных жирных кислот
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •11.1.2. Эмульгирование жиров
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •11.1.3. Влияние желчных кислот на активность панкреатической липазы
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •11.1.4. Роль сывороточного альбумина в транспорте высших ук ирных кислот в крови
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •11.2. Фосфолипиды
- •11.2.1. Определение общих фосфолипидов в сыворотке крови по фосфору
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •11.2.2. Обнаружение фосфатидилхолина в желтке куриного яйца
- •Порядок выполнения работы
- •11.3. Стерины (стеролы) и стериды
- •11.3.1. Открытие холестерина в тканях головного мозга
- •Порядок выполнения работы
- •11.3.2. Количественное определение общего холестерина в сыворотке крови прямым методом по реакции Златкис– Зака
- •Порядок выполнения работы
- •Рекомендации к составлению протокола
- •Работа № 12. Показатели липидов. Химические свойства липидов
- •12.1. Показатели липидов
- •12.1.1. Количественная оценка степени ненасыщенности липидов по йодному числу
- •Порядок выполнения работы
- •12.1.2. Обнаружение перекисных соединений
- •Порядок выполнения работы
- •12.1.3. Количественное определение перекисного числа
- •Порядок выполнения работы
- •12.1.4. Определение кислотного числа
- •Порядок выполнения работы
- •12.2.2. Получение калиевого жидкого мыла
- •Порядок выполнения работы
- •12.2.3. Определение содержания жирных кислот в твердом мыле
- •Порядок выполнения работы
- •Порядок выполнения работы
- •12.2.7. Обнаружение стеролов в растительном масле
- •Порядок выполнения работы
- •Раздел 2 работа № 13. Исследование ферментов дыхательной цепи
- •13.1. Исследование действия каталазы крови
- •Порядок выполнения работы
- •13.2. Качественное определение активности сукцинатдегидрогеназы мышц
- •Порядок выполнения работы
- •Работа № 14. Окислительное фосфорилирование
- •Порядок выполнения работы
- •Работа № 15. Моделирование биологических окислительно-восстановительных систем
- •15.1. Сопоставление редокс-потенциалов рибофлавина и метиленового синего
- •Порядок выполнения работы
- •15.2. Обнаружение дегидрогеназ лимоннокислого цикла
- •Порядок выполнения работы
- •Работа № 16. Переваривание углеводов в желудочно-кишечном тракте
- •Порядок выполнения работы
- •Работа № 17. Метаболизм липидов
- •17.1. Открытие непредельных жирных кислот в жире
- •Порядок выполнения работы
- •17.2. Эмульгирование липидов
- •Порядок выполнения работы
- •17.3. Качественные реакции на желчные кислоты
- •Порядок выполнения работы
- •17.4. Роль сывороточного альбумина в транспорте высших жирных кислот в крови
- •Порядок выполнения работы
- •17.5. Определение общих фосфолипидов в сыворотке крови по фосфору
- •Порядок выполнения работы
- •17.6. Открытие холестерина в тканях головного мозга
- •Порядок выполнения работы
- •Работа № 18. Переваривание жиров липазой поджелудочного сока
- •Порядок выполнения работы
- •Работа № 19. Обмен белков
- •19.1. Переваривание белков пепсином
- •Порядок выполнения работы
- •19.2. Переваривание белков ферментами поджелудочной железы
- •Порядок выполнения работы
- •Работа №20. Анализ желудочного сока
- •20.1. Титрование кислот желудочного содержимого
- •Порядок выполнения работы
- •Пример расчета
- •20.2. Колориметрический метод определения протеолитической активности поджелудочного сока
- •Порядок выполнения работы
- •Работа № 21. Исследование гормонов различных классов
- •21.1. Гормон поджелудочной железы — инсулин
- •Порядок выполнения работы
- •21.2. Гормоны щитовидной железы
- •Порядок выполнения работы
- •21.3. Гормон мозгового слоя надпочечников – адреналин
- •Порядок выполнения работы
- •21.4. Гормоны коркового слоя надпочечников (кортикостероиды)
- •Порядок выполнения работы
- •21.5. Гормоны половых желез
- •Образование фенолята фолликулина
- •Реакция на фенольную группу
- •Работа № 22. Минеральный обмен
- •22.1. Определение фосфатов
- •22.1.1. Определение неорганического фосфора в сыворотке крови по восстановлению фосфорно-молибденовой кислоты
- •Порядок выполнения работы
- •22.1.2. Определение фосфатов в слюне
- •Порядок выполнения работы
- •22.2. Определение кальций
- •Порядок выполнения работы
- •22.3. Обнаружение роданидов в слюне
- •Порядок выполнения работы
- •22.4. Определение кальция и фосфора в ткани зуба
- •Порядок выполнения работы
- •22.5. Исследование минерального состава кости
- •22.5.1. Реакция на кальций
- •Порядок выполнения работы
- •22.5.2. Реакция на магний
- •Порядок выполнения работы
- •Работа № 23. Биохимия мышечного сокращения
- •23.1. Разделение белков мышечной ткани
- •Порядок выполнения работы
- •23.2. Ферменты мышечной ткани
- •Порядок выполнения работы
- •23.3. Экстрактивные вещества мышечной ткани
- •Порядок выполнения работы
- •23.4. Минеральные вещества мышечной ткани
- •Порядок выполнения работы
- •23.5. Получение и исследование свойств желатины из сухожилий
- •Порядок выполнения работы
- •23.6. Обнаружение молочной кислоты
- •Порядок выполнения работы
- •Работа № 24. Биохимия печеночной ткани
- •Тимоловая проба (нтк «Анализ-х») (уирс)
- •Порядок выполнения работы
- •Раздел 3 работа № 25. Рн и буферные системы
- •25.1. Лимонно-фосфатная буферная смесь. Приготовление растворов
- •Порядок выполнения работы
- •25.2. Определение рН исследуемого раствора универсальным индикатором
- •Порядок выполнения работы
- •25.3. Свойства буферных растворов
- •Порядок выполнения работы
- •25.4. Приготовление буферного раствора и определение его буферной емкости
- •25.4.1. Приготовление ацетатного буфера
- •Порядок выполнения работы
- •25.4.2. Определение буферной емкости раствора по щелочи
- •Порядок выполнения работы
- •Работа №26. Определение общего азота методом кьельдаля
- •Порядок выполнения работы
- •Работа № 27. Рефрактометрическое определение концентрации белков в сыворотке крови
- •Порядок выполнения работы
- •Работа №28. Определение общего фосфора в тканях
- •Порядок выполнения работы
- •Работа №29. Определение содержания гликогена
- •29.1. Определение содержания гликогена в мышечной ткани Порядок выполнения работы
- •29.2. Определение содержания гликогена в печени
- •Работа № 30. Количественное определение нуклеиновых кислот
- •30.1. Определение суммарного количества нуклеиновых кислот
- •Порядок выполнения работы
- •30.2. Определение нуклеиновых кислот в крови (по п. В. Симакову)
- •Порядок выполнения работы
- •Работа № 31. Газохроматографическое определение спирта в крови
- •Порядок выполнения работы
- •Работа № 32. Газохроматографическое определение лекарственных препаратов
- •Порядок выполнения работы
- •Работа № 33. Прямое атомно-абсорбционное определение 3d-элemehtob (Fe, Сu, Mn, Co, Ni) и Zn в биологическом материале
- •Порядок выполнения работы
- •Работа № 34. Определение веществ методом тсх
- •34.1. Определение углеводов в крови методом тсх
- •34.1.1. Открытие сахароз по Барону и Экономидису в моче
- •Порядок выполнения работы
- •34.1.2. Количественное определение сахароз по Банхеру
- •Порядок выполнения работы
- •34.2. Определение холестерина в крови методом тсх
- •Порядок выполнения работы
- •Рекомендуемая литература основная
- •Дополнительная литература
- •Содержание
- •Раздел 1 18
- •Раздел 2 100
- •Раздел 3 135
1.8. Реакция с формальдегидом
При взаимодействии a-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
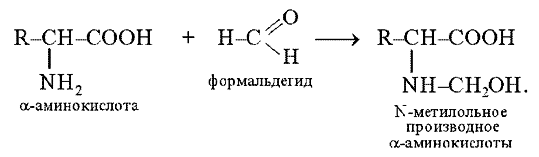
Эта реакция лежит в основе количественного определения a-аминокислот методом формального титрования (метод Сёренсена).
Реактивы и материалы: 1%-ный раствор глицина, индикатор метиловый красный, 40%-ный раствор формальдегида.
Оборудование и посуда: штатив с пробирками, капельницы, пипетки.
Порядок выполнения работы
В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
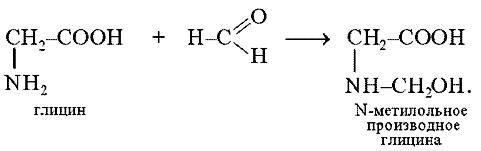
Работа №2. Реакции осаждения белков
Физико-химические свойства белков в значительной степени определяются их высоким молекулярным весом (белки - гидрофильные коллоиды), амфотерностью (белки - амфотерные электролиты) и лабильностью вторичной и третичной структур белка.
Белки под влиянием нагревания или воздействия органических растворителей, концентрированных минеральных кислот, органических кислот, солей тяжелых металлов, алкалоидных реактивов и других факторов претерпевают глубокие изменения, называемые денатурацией. Под денатурацией понимают негидролитическое разрушение белковой молекулы с деградацией ее вторичной и третичной структур.
Существуют различные способы изменения окружающей среды, влияющие на баланс слабых сил в водных растворах белков. Некоторые из них используются для осаждения белков.
Повышение температуры оказывает дезорганизующее влияние на растворитель и на макромолекулу путем увеличения энергии ее пептидных цепей. В результате возникают развернутые формы ранее глобулярных белков.
Изменение концентрации водородных ионов приводит к связыванию протонов ионизирующимися группами и модификации заряда белка. В результате видоизменяются не только ионные связи, стабилизирующие нативную структуру протеинов, но и межмолекулярные взаимодействия.
Добавление значительных количеств неводных растворителей (спирты, органические кислоты) и просто углеводородов может влиять на конформацию белков либо при непосредственном связывании, либо косвенно, уменьшая диэлектрическую константу среды и, следовательно, увеличивая внутри- и межмолекулярное электростатическое взаимодействие. Кроме того, при прибавлении менее полярных, чем вода, и просто гидрофобных веществ происходит разрушение гидрофобного ядра, т. к. термодинамически более выгодным становится развернутое (денатурированное) состояние ввиду изменения структуры растворителя.
Добавление нейтральных солей изменяет электростатическое взаимодействие путем экранирования зарядов в белках. При постепенном увеличении концентрации электролита сначала растворимость белка возрастает, а затем уменьшается. Важное значение в последнем процессе, кроме экранирования зарядов, имеет отнятие гидратной оболочки с поверхности протеинов.
5. Ионы тяжелых металлов, таких как серебро, медь, ртуть и свинец, соединяются с тиоловыми и карбоксильными группами и в высоких концентрациях служат осадителями белков.
В некоторых случаях при удалении денатурирующего агента может наблюдаться более или менее полное восстановление свойств белка. Осаждение белков высаливанием с помощью сернокислого аммония (в различных концентрациях) или других средних солей щелочных и щелочно-земельных металлов с последующим их удалением путем диализа практикуется для получения очищенных ферментных и гормональных препаратов из органов и тканей, а также лечебных сывороток и вакцин. С той же целью применяют осаждение белков непродолжительным действием спирта или ацетона при низкой температуре.
