
- •1. Определение температуры воды
- •2. Определение запаха я вкуса воды
- •3. Определение плотности воды
- •4. Определение цветности воды
- •Настройки прибора
- •Определение рН исследуемой воды
- •Задачи я вопросы
- •Работа 4. Определение содержания ионов Сl- и s в воде
- •Реактивы
- •Продолжительность нагрева воды о перманганатом калия сильно сказывается на его окислявшем действии.
- •Вопросы
- •Работа 9. Определение содержания гидрокарбонатов и карбонатов в воде
- •Вопросы и задачи
- •Фотоколориметрический метод
- •Вопросы и задачи
- •Реактивы
- •Работа 13. Определение содержания фенолов в воде
- •Контрольные вопросы
Настройки прибора
В стакан наливают стандартный буферный раствор № 1 с известным значением рН (стакан предварительно ополаскивают этим раствором) .
Электроды тщательно промывают дистиллированной водой (остатки воды с электродов удаляют Фильтровальной бумагой) и погружают их в раствор. Электроды при погружении в раствор не должны доходить до дна стакана на 4-6 ми,
Нажимают кнопку "-1-14", а затем кнопку рН. При нажатии кнопки "-1-14" определяют величину рН по нижней шкале показывающего прибора.
Нажимают кнопку соответствующего узкого диапазона ("-1- 4": "4-9" "9-14"), определяют величину рН по верхней шкале показывающего прибора.
Стакан хорошо промывают дистиллированное водой, ополаскивают стандартным буферным раствором № 2 (также с известным значением рН), промывают электроды как и в предыдущем случае и наливают буферный раствор № 2. Определяют рН буферного раствора № 2.
При замене раствора и по окончании измерений кнопка " О,t " должна быть нажата.
Если измеренные величины рН буферных растворов соответствуют заданным значениям, то приступают к измерению рН исследуемого раствора.
Определение рН исследуемой воды
Определяют рН исследуемой воды с помощью универвальной индикаторной бумаги.
Определяет рН исследуемой воды с помощью рН-метра-милливольтметра рН-121.
После настройки прибора стакан хорошо промывают дистиллированной водой, ополаскивают исследуемой водой в наливают в него исследуемую воду. Электроды предварительно промывают дистиллированной водой (остатки воды удаляют фильтровальной бумагой) и погружают в стакан на расстоянии 4-6 мм от дна.
Измерение рН исследуемой воды вначале проводят по шкале ("-1-14"), а затем го шкале соответствующего узкого диапазона значений рН.
По окончании работы с прибором электроды для измерения рН ополаскивают дистиллированной водой и оставляют их погруженными
в неё или в О,1 М раствор соляной кислоты.
Задачи я вопросы
I. Что такое ионное произведение воды? 3, Что такое рН? Как определяется рН?
3. Концентрация ионов водорода в растворе 2-10-4 г-ион/л. Чему
равен рН?
Концентрация ионов гидроксила в растворе 10-6г-ион/л. Чему равен рН?
5, Концентрация ионов водорода равна 10-8г-ион/л, Определить рН и концентрацию гидроксильных ионов. Что нужно прибавить к данному раствору (кислоту или щелочь), чтобы рН стал
Работа 3, Определение содержания растворенных газов в воде
Содержание растворенных газов в воде является одним из химических показателей качества воды.
В воде природных источников чаше всегоприсутствуют кислород и углекислый! газ.
Определение растворенного кислорода
Кислород попадает в воду из воздуха, а также может образоваться в результате жизнедеятельности зеленых растений, населявших близкие к поверхности слои воды. В открытых незагрязненных водоемах количество растворенного кислорода близко к насыщению и составляет 8- 9 мг/л. Количество кислорода в поверхностных источниках в верхних слоях выше, чем в глубинных за счет усиленной поверхностной аэрация и интенсивно проводящих процессов фотосинтеза.
Наличие в воде восстановителей ( аммиака, железа (2), нитритов, легко окисляющихся органических веществ и др.) снижает его концентрации, Резкое снижение концентрации растворенного кислорода в воде свидетельствует о загрязнения водоема.
В загрязненных сточных водах растворенного кислорода не бывает совсем, либо его концентрация не превышает 0,5-1 мг/л. Минимальное содержанке кислорода в воде для нормальной жизнедеятельности микророорганизмов составляет 2 мг/л.
Концентрацию растворенного кислорода в воде определяют йод-метрическим методом Винклера. По этому методу о концентрации растворенного кислорода в воде судят по количеству выделяющегося йода.
Сущность метода эаключается в следующем. В склянку с исследуемой воде вводят раствор соли марганца (2) и щелочную смесь ( KI + КОН). Соль марганца (2) реагирует с КОН , в результате реакции образуется гидроксид марганца (2) - Мr(0Н)2 телесного цвета.
МnCl22KOH-Мn(OH)2 + 2KCl
Растворенный в воде кислород окисляет. Mn(0Н)2 в гидрокcид
марганца (4) бурого цвета, также нерастворимый в воде.
2Мn(0Н)2 +02+2Н20 =2 Мn(0Н)4
Количество образовавшегося гидрокcида марганца (4) определяется содержанием растворенного в воде кислорода. Таким образом, в результате проведенных реакций улавливается весь растворенный в
воде кислород. Затем переводят гидроксид марганца (4)в эквивалентное ему количество иода, легко и точно определяемое титрованием. Для этого по окончании реакции окисления в склянку приливают соляную кислоту. При этом четырехвалентный марганец восстановливается до двухвалентного:
Mn(0H)4+4HCl= MnCl2+Cl2+4H2O
Количество образовавшегося хлора эквивалентно содержанию растворенного в воде кислорода. Выделившийся хлор взаимодействует с иодидом калия, образуя свободный иод, который оттитровывают раствором тиосульфата натрия в присутствии крахмала:
Содержание растворенного кислорода в воде определяют после предварительного отстаивания пробы. (Присутствующие в воде взвешенные вещества могут помешать определению, адсорбируя иод на своей поверхности или химически с ним взаимодействуя). Предварительное фильтрование в данной случае недопустимо.
Практическая часть
Реактивы
1. Na2S203 (0,00 N раствор) .
МnСl2 -4Н20 (4% раствор) .
Щелочная смесь КI + KОН .
HCl (пи,19)
Крахмал (1% раствор)
Ход определения
Определение содержания растворенного кислорода в воде проводят в предварительно прокалиброванной склянке с притертой пробкой емкостью 200-250 мл. Её. ёмкость находят взвеиванием: на техно~химических весах с точностью до 0,01 г взвешивают пустую склянку, с пробкой, а затем заполненную дистиллированной водой и закрывают пробкой так, чтобы в ней не осталось пузырьков воздуха. Разность результатов взвешивания даст массу воды в склянке, а, значит и ее объем.
В прокалиброванную склянку осторожно наливают до пробки предварительно отстоявшуюся исследуемую воду, затем пипеткой вводят на дно склянки 1 мл раствора хлористого марганца MnCl2*4H2O
(45% раствор). Другой пипеткой вводят 1 мл раствора щелочной смеси
KI +KOH (щелочную смесь готовят растворением 70 г KОН и 15 г КI в 1 л дистиллированной воды) . В этом скучае конец пипетки подводят только к уровне пробы воды в горлышке склянки. Склянку осторожно
закрывают пробкой так, чтобы под пробкой не оставалось пузырьков воздуха. При этом из склянки выливается 2 мл исследуемой воды, т.е.
столько, сколько внесли в склянку реактивов. На эту потерю вносят при расчете соответствующую поправку (см. ниже).
Закрытую пробкой склянку несколько раз переворачивают вверх дном и обратно для перемешивания ее содержимого. Дают осадку (бурого цвета) собраться на дне склянки, а затем его растворяют. Для этого склянку открывают я наливают в нее пипеткой 4-5 мл концентрированной соляной кислоты (пл.1 ,19). Склянку снова закрывают пробкой (на выделяющуюся при этом жидкость не обращают внимания) и, переворачивая перемешивают ее содержимое. Затем переливают содержимое в чистую коническую колбу для титрования емкостью 750 мл,ополаскивают склянку дистиллированной водой, сливая ее в колбу для титрования, Через 5 минут титруют выделившийся код 0,01 N раствором тиосульфата натрия до светло-желтой окраски. Прибавляют 2-3 капли крахмала (1% раствор) к продолжают тировать до первого исчезновения синей окраски.
Расчет
Количество растворенного а воде кислорода (X) в мг/л рассчитывают по формуле:
![]() =
= 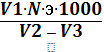
где V1 ~ объем раствора тиосульфата натрия, ушедший на титрование, мл;
N - нормальность раствора тиосульфата натрия;
Э - миллиграмм-эквивалент кислорода, мг;
V2 - объем исследуемой воды, мл;
V3 - объем прибавленных реактивов (растворов соли марганца и щелочной смеси), мл.
Определение свободной углекислоты
Углекислота в йоде может присутствовать в форме недйссоциированных молекул Н2СОз ( в малых количествах), молекулярно растворенного углекислого газа СО2, гидрокарбонатов, карбонатов.
Присутствие в природных водах растворенного углекислого газа связано с процессами распада органических веществ при их окислении, брожении или гниении. Источником СО2 является также дыхание водных организмов и выделение (СО2 в геохимических процессах.
Процессами, направленными на уменьшение содержания С02 в природных водах, являются его удаление в атмосферу, расходование на растворение карбонатов, потребление зеленой растительностью при фотосинтезе. В поверхностных водах его содержание не > 20 мг/л, а в подземных неминерализованных - до 40 мг/л.
Количественное соотношение между различными формами углекислоты определяется уравнениями ее диссоциации первой и второй ступени
![]() +H
+H![]()
![]() ↔
↔![]() +
+![]()
K1=![]() K2=
K2= Константы
диссоциации первой и второй ступени К1
и К2
зависят от концентрации водородных
ионов, поэтому существование различных
форм углекислоты в растворе определяется
величиной рН.
Константы
диссоциации первой и второй ступени К1
и К2
зависят от концентрации водородных
ионов, поэтому существование различных
форм углекислоты в растворе определяется
величиной рН.
При рН =3,7-4,0 вся находящаяся в воде углекислота представлена только углекислым газом СО2. Так как в форме не диссоциированных молекул Н2СОз находится лишь незначительная часть растворенного С02 (около 1%), то содержание свободной углекислоты характеризуется суммой: Н2СО3 + С02 . При этом расчет ведут не на кислоту, а на СО2.
По мере повышения значения рН доля С02 уменьшается и, значит, возрастает доля гидрокарбонатов. При рН = 6,3-6,4 практически вся углекислота находится в виде гидрокарбонатов (98%). При дальнейшем повышении значения рН ( > .8.3-8.4) свободного углекислого газа в воде нет, а находятся только гидрокарбонаты и карбонаты, При рН > 12 в растворе находятся только карбонаты.
Объёмное определение свободной углекислоты СО2 проводят методом нейтрализации.
К исследуемой воде добавляют NaОН , при этом СО2 переходитв гидрокарбонат.
Точка эквивалентности соответствует такому рН, при котором в воде находятся только гидрокарбонаты (8,4). Титрирование ведут в присутствии индикатора - фенолфталеина до получения розовой окраски раствора соответсвующий окраске стандартного раствора (раствора "свидетеля"), рН которого равен 8,4.
Практическая часть
РЕактивы
1. NaOH (0/1N раствор)
2. NaOH (10% раствор)
3. фенолфталеин (0.1% раствор)
Ход определения
Перед началом титрования готовят стандартный раствор- "свидетель" В коническую колбу (также как та, в которой ведут титрование), вводят 100 дистилированной воды, прибавляют 0,5мл 10%-ного раствора едкого натра, взбалтывают и прибавляют 2-3 капли 0,1-ного раствора фенолфталеина. Такой раствор имеет рН =8.4
В коническую колбу для титрования ёмкостью 250 мл осторожно пипеткой вводят 100 мл исследуемой воды, прибавляют 2-3 капли 1,1%~ного раствора фенолфталеина и перемешивают. Титруют пробу 0,1N раствором NaОН до появления розовой окраски равной ад интенсивности окраске стандартного раствора (раствора- "свидетеля")
Расчет
Количество растворенной углекислоты Х мг/л рассчитывают по формуле:
![]() =
=![]() мг/л
мг/л
где V1 - объем раствора NaОН пошедший на титрование, мл;
N - нормальность раствора NaOH
Э - миллиграмм-зквивалент С02 ( в данной реакции 44 мг);
V2 - объем исследуемой воды, взятый для титрования, мл.
Вопросы я задачи
Что такое растворимость? От чего зависит растворимость газов в воде?
Каковы причины нахождения в природных водах растворенного кислорода?
Какие формы углекислоты присутствуют в природных водах? Чем определяется соотношение между различными формами углекислоты в воде?
Каковы причины нахождения в природных водах свободной углекислоты?
Каким методом определяют количество растворенного кислорода в воде? В чем его сущность?
Каким методом определяет количество свободной углекислоты в воде? В чем его сущность?
Как рассчитать количество растворенного кислорода в воде?
Как рассчитать количество свободной углекислоты в воде?
Для связывания кислорода в воде применяет сульфит натрия Na2CОз и тиосульфат натрия Na2S2O3 . Написать уравнения окислительно-восстановительных реакций взаимодействия этих веществ с кислородом и рассчитать количества, необходимые для удаления его из 4 м3 воды с исходным содержанием кислорода 8 мг/л.
