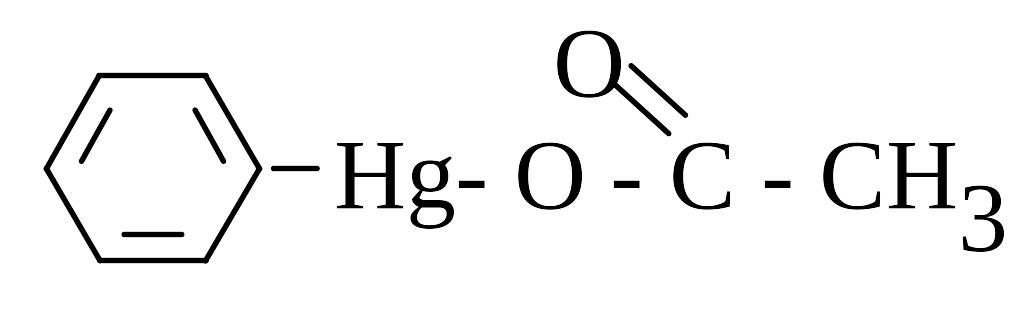- •1. Проблеми екології в сучасному світі
- •Вплив забруднень довкілля на живі організми
- •Крім того є багато неурядових програм поза оон.
- •2. Поняття хімічного складу об’єктів довкілля та основні підходи до аналізу
- •Контрольні запитання
- •3. Характеристика речовинного складу окремих об’єктів довкілля
- •3.1. Природне повітря та його забруднювачі
- •3.2. Природні води
- •3.3. Антропогенний вплив на води, забруднювачі вод
- •3.3.1. Контроль за складом вод залежно від їх використання
- •3.3.2. Контроль стічних вод різних виробництв
- •3.4. Ґрунти
- •3.4.1.Ґрунтоутворення, загальні характеристики ґрунту
- •3.4.2. Склад ґрунтів
- •3.4.3. Антропогенне забруднення ґрунтів та літосфери
- •3.5. Рослинність, як об’єкт довкілля
- •Контрольні запитання
- •4. Вплив хімічних речовин на живі організми
- •4.1. Роль макро- і мікроелементів для живих організмів
- •4.2. Вплив забруднень довкілля на живі організми
- •4.3. Перетворення токсичних речовин у довкіллі
- •Контрольні запитання
4.2. Вплив забруднень довкілля на живі організми
При антропогенному та техногенному забрудненні у довкілля потрапляють непритаманні йому речовини або притаманні, але у значно більших концентраціях. Багато органічних речовин лабільні, здатні легко окиснюватись, відновлюватись, полімеризуватись. Довкілля з очищенням таких забруднень впоратись не може. Речовини з повітря потрапляють в органи дихання, ушкоджують рослинність, забруднюють ґрунти та води, далеко переносяться вітрами (у льодовиках Татр за 25 років вміст токсичних речовин зріс у 50-150 разів). У повітрі газоподібні речовини та пил взаємодіють між собою і утворюють дуже токсичні фотооксиданти. Стоки промислових підприємств забруднюють води і роблять їх непридатними для побутового використання, шкідливо впливають на водні живі організмами. Вживання риби, у тканинах якої накопичені токсичні речовини, веде до отруєння людини. Нерідко у стічних водах накопичуються канцерогенні речовини, серед яких найпоширеніші поліциклічні ароматичні вуглеводні. Підсилюють дію канцерогенних речовин синтетичні поверхнево-активні речовини. Забруднення ґрунтів призводить до потрапляння шкідливих речовин у харчові продукти, а з ґрунтовими стоками забруднюються водойми, відчужуються родючі землі. Стічні води містять розчинні та малорозчинні органічні і неорганічні речовини, серед яких сульфати, фосфати натрію, калію, кальцію, алюмінію, магнію, полімерні речовини, волокна, барвники, сполуки меркурію, арсену, селену, кадмію, феноли, спирти, кислоти, луги. Широке застосування добрив та пестицидів у сільському господарстві обумовлює інтенсивний стік з полів у водойми як токсичних, так і необхідних для життєдіяльності речовин, що призводить до відмирання живих організмів і інтенсивного росту водоростей.
Ураження рослин забруднювачами довкілля
Засвоєння токсичних речовин рослинами відбувається переважно через листя, а ступінь ураження обумовлений співвідношенням розмірів частинок та розмірів пор листя. Тому дерева в місті вмирають у 6-8 разів швидше, ніж на незабрудненій території. Пил екранує листя від сонячного випромінювання і порушує фотосинтез. Тварини споживають забруднені рослини, отруюються газами.
СО2. Збільшення концентрації його на 1% викликає порушення обміну речовин у рослин, пригнічується робота ферментних систем, відмирають окремі групи клітин, рослина уповільнює ріст.
SO2 ускладнює процес фотосинтезу, пошкоджує асиміляційний апарат рослин, викликає некроз тканин, особливо дерев хвойних порід. Якщо у ґрунт потрапляють оксиди сульфуру, то утворюється сульфітна та сульфатна кислоти, сульфати у ґрунті зв’язують кальцій у важкорозчинний CaSO4 і ущільнюють ґрунт. Це веде до зменшення проникності ґрунту для кисню, вологи, пригнічення мікроорганізмів. Подібно діє пароподібна Н2SO42-.
Cl2, HCl, NO, NO2 пошкоджують органи асиміляції, змінюється колір листя і хвої. У присутності NH3 хвоя стає червоно-бурою і опадає. HF, SiF4 особливо шкідливі для фруктових дерев, квітів.
NO3- засвоюється рослинами, а потім відновлюється під впливом нітроредуктази до нітритів та амонію, який іде на синтез білкових речовин. Однак надмір нітрогену гальмує активність нітроредуктази і веде до накопичення нітрату. Нітроредуктаза активна при доброму доступі світла, тому умовами накопичення нітрату у рослині є погана освітленість (вирощування у теплицях). Збільшується вміст нітратів і при тривалому зберіганні рослинної продукції.
Пил соди, калійних солей, синтетичні поверхнево-активні речовини теж ушкоджує рослини.
KCl, H3BO3, потрапляючи у ґрунт, проявляють гербіцидну дію і пригнічують ріст рослин.
Al. Багато алюмінію є у глинистих ґрунтах. Його надлишок спричинює підкислення ґрунту, порушується фосфатний обмін у рослині, зменшується холодостійкість рослин. Разом з манганом надлишок алюмінію шкідливо впливає на синтез хлорофілу.
Важкі метали. На засвоєння рослинами іонів важких металів впливає тип ґрунту. У чорноземі з великим вмістом гумусу важкі метали міцно зв’язані, тому рослини їх не можуть засвоювати. На піщаних ґрунтах токсичні речовини слабо зв’язані і добре засвоюються рослинами. У випадку глинистих ґрунтів важкі метали сконцентровані на поверхні ґрунту. Лише внесення гною та вапна може зв’язати такі токсичні іони. Вплив на рослинність сполук важких металів у ґрунті залежить не тільки від типу ґрунту, вмісту в ньому гумусових речовин, а також від типу рослин, оскільки різні рослини по-різному їх засвоюють. Максимальний вміст металів у ґрунтах спостерігається на віддалі 1-5 км від джерел забруднення. Він може перевищувати фонові рівні на 1-2 порядки. Глибина проникнення важких металів у ґрунт переважно не перевищує 20 см, і лише при сильному забрудненні може досягати 160 см. Найбільшу міграційну здатністю мають Hg та Zn.
Pb, Zn, Ni глибоко проникають у клітини рослин за рахунок іонного обміну і блокують процес фотосинтезу, причому сполуки Ni токсичніші. Однак деякі водорості адаптуються до підвищеного вмісту сполук нікелю.
Шкідливими для рослин є сполуки Mo, Cd. Сполуки Mo інтенсивно накопичуються у бобових рослинах.
Cu. У водоймі водорості досить сильно акумулюють сполуки купруму, в них збільшується проникність клітин до інших важких металів. Купрум є інгібітором росту (0,1 мг/л), особливо синьо-зелених водоростей, проявляючи токсичність більшу за сполуки Hg.
Hg. Сполуки меркурію акумулюються клітинами рослин, затримуючи їх ріст; у випадку водоростей шкідлива дія проявляється при концентрації сполук у воді в межах 0,002-0,25 мг/л.
Cd. Рослинність водойми добре засвоює кадмій, однак присутність Mn i Fe має інгібіторну дію. Сполуками кадмію пригнічується ріст і фотосинтез рослин (0,02-1,0 мг/л), а хронічні ефекти проявляються при вмісті 1 мкг/л.
Pb. Сполуки плюмбуму сильно накопичуються у тканинах рослин, однак досить легко виводяться. Для водної рослинності сполуки Pb менш токсичні за сполуки Cu i Hg (шкідливий вплив при вмісті >0,1-5 мг/л). Деякі види рослин адаптуються до підвищеного вмісту сполук плюмбуму у воді.
Zn. Інтенсивність засвоєння рослинністю і водоростями сполук цинку невелика, залежить від температури. Багато рослин адаптуються до підвищеного вмісту сполук цинку.
Cr в основному не засвоюється рослинами водойми (при вмісті у воді 0,50 мг/л гальмується ріст водоростей). Солі хрому акумулюються у тканинах рослин, викликають їх хлороз, затримують ріст.
As не забруднює суттєво рослинних тканин. ЛД50 для водоростей становить 0,5 мг/кг.
Ураження мікроорганізмів, нижчих організмів, тварин забруднювачами довкілля
При спуску промислових стоків у водойми пригнічується життєдіяльність мікроорганізмів, гине риба, у тканинах водних організмів накопичуються важкі метали. Мертвими стали Великі озера в Америці. Ріка Рейн до недавнього часу була однією із найзабрудненіших річок у Європі. На сьогоднішній день якість води Рейну суттєво покращилася.
Виділені в атмосферу оксиди сульфуру та нітрогену перетворюються в аерозолі нітратної, сульфітної та сульфатної кислот – випадають кислотні дощі, які підкислюють ґрунти та водойми. У присутності кислот у воді гине планктон та велика риба, а на дні водойми розвивається непритаманний їй сухопутний мох, який щільно встеляє дно, а під ним гніздяться анаеробні бактерії, накопичується сірководень, метан. У результаті водойма стає мертвою.
As. Сильної акумуляції безхребетними сполук арсену нема. Деякі види риб накопичують арсен до вмісту 21 мг/кг, отже, риба може бути отруйною для споживання.
Hg. Безхребетні та риби інтенсивно поглинають органічні сполуки меркурію, акумуляція їх підвищується з підвищенням температури, а виводяться ці речовини дуже повільно. Вміст сполук меркурію вищий у внутрішніх органах риби, ніж у м’язах, а період напіввиведення становить 12-20 років. Для риби при дії протягом 24 год ЛД50 становить: для CH3-Hg-Cl 0,084-0,125 мг/л; для HgCl2 0,90 мг/л. При хронічній дії риба слабо розмножується і навіть гине.
Мо накопичується в бобових рослинах у кількостях, більших за допустимі, а худоба, споживаючи ці рослини, хворіє і може загинути.
Cd заміщує Zn у зв’язках з протеїнами. Цю дію підсилюють сполуки Se i Pb. Безхребетні акумулюють сполуки кадмію слабо. Найбільш чутливі рачки та молюски, для них ЛК50 – 0,03-0,2 мг/л. Кадмій накопичується у внутрішніх органах риби, а не у м’язах. ЛК50 (при дії 96 год.) – 0,09-1,05 мг/л.
Pb. Безхребетні мало засвоюють сполуки плюмбуму, у рачків він накопичуються в скелеті. Токсичність проявляється при вмісті у воді 0,1-10 мг/л Pb. Риби засвоюють сполуки плюмбуму слабо, однак плюмбум у рівній мірі накопичується як у внутрішніх органах, так і в м’язах; досить швидко виводиться з організму, ЛК50 – 0,5-10 мг/л (хронічна дія проявляється при вмісті 8 мкг/л).
Cu. Безхребетні не сильно накопичують сполуки купруму. Риба накопичує цей метал у внутрішніх органах, ЛК50 – 0,017-1,0 мг/л. Надлишок купруму у організмі людини викликає надмірне накопичення його у печінці та мозку, викликаючи нервові розлади – хвороба Вільсона.
Ni безхребетні накопичують у органах травлення, у скелеті рачків, ЛК50 – 0,5-20 мг/л. Для риби сполуки нікелю мало токсичні, але понижується їх плодючість. ЛК50 – 5-100 мг/л.
Zn. Безхребетні накопичують сполуки цинку у внутрішніх органах, причому лише деякі види є дуже чутливими до них. Риби накопичують цинк у внутрішніх органах, ці сполуки сильно впливає на стан зябер, причому більш токсичні за сполуки Ni i Pb, ЛК50 – 0,5-50 мг/л, а для деяких видів навіть до 100 мг/л. Надлишок цинку в організмі тварин та людини викликає інтенсивний ріст і поділ клітин і, таким чином, спричинює виникнення онкологічних захворювань.
Cr переважно не засвоюється безхребетними, мало накопичується рибою (до 0,5 мг/кг), його ЛК50 – 3,5-118 мг/л. Сполуки хрому у водоймі можуть привести до загибелі риб і мікроорганізмів.
Al. Якщо у водоймі є надмір сполук алюмінію, то гине риба, затримується ріст мікрофлори.
Cl2 у хлорованій воді пригнічує функції мікроорганізмів. Подібну дію мають сполуки F, Sb.
Синтетичні миючі засоби припиняють процес самоочищення водойми і підсилюють дію інших токсичних речовин. На поверхні води накопичується піна. Це все веде до загибелі мальків риби і водоростей.
Підвищення температури. Теплове забруднення викликане стоком води, яка використовувалась для охолодження ТЕС та АЕС, на інших підприємствах. Так виробництво сульфатної кислоти приводить до втрати зі стоком 40% теплової енергії. Тепла вода змінює термічний і біологічний режим водойм і шкідливо впливає на живі організми, про що вказувалось вище. У теплій воді значно менша розчинність кисню і риба задихається. Другою причиною зменшення вмісту кисню є й те, що при вищій температурі бурхливо розвиваються одноклітинні водорості, вода зацвітає з наступним гниттям відмерлої рослинної маси. Крім того теплове забруднення суттєво підвищує отруйність багатьох хімічних забруднювачів, оскільки зі зростанням температури зростає і швидкість хімічних реакцій.
Вплив забруднювачів довкілля на організм людини
Для підтримання життя людини необхідно, щоб концентрація речовин у воді та їжі була в певних межах. В організм людини хімічні речовини потрапляють через органи дихання і травлення з повітря, з водою та з їжею.
Здоров’я – природний стан організму, що характеризується його повною рівновагою з біосферою і відсутністю будь-яких хворобливих змін.
Забруднення всіх складових довкілля, продуктів харчування, шум, вібрація, електромагнітні поля ведуть до патологічних змін живих організмів, іноді до глибоких генетичних змін, передчасного старіння, народження неповноцінних дітей. Біологічний ефект забруднення може бути місцевим і загальним. Місцевий спричинює гострі захворювання певного органу; загальний – речовини впливають на обмін речовин в організмі. Часто місцева дія передує загальній. Так діти у забрудненій місцевості мають малу масу тіла, функціональні відхилення певних систем органів, низький рівень фізичного розвитку.
Якщо проаналізувати вплив довкілля на здоров’я жителів Львівської області, то виявилось, що 42% дорослого і 43% дитячого населення проживає в умовах забрудненого та дуже забрудненого навколишнього середовища. Ці умови викликають низку захворювань: інфекційних, новоутворень, хвороб крові та кровотворної тканини, нервової системи, захворювань зору та органів дихання – фактично це дуже сильний вплив на населення
Вплив неорганічних речовин
SO2 потрапляє у організм через органи дихання. При цьому сильно подразнюється слизова оболонка. Місцева дія проявляється кашлем, нудотою, охриплістю, ураженням слизової оболонки очей. Великі кількості викликають гострий бронхіт, ціаноз, набряк легенів, втрату свідомості і навіть смерть від асфіксії. SO2 пригнічує захисні системи організму, тому легко виникають інфекційні захворювання – хронічні катари, кон’юнктивіт, карієс зубів, малокрів’я, хвороби печінки. В Англії внаслідок смогу, який містить оксиди сульфуру, щороку від бронхіту помирає 30 000 людей. Особливо страждають діти, старші люди, вагітні жінки.
H2SO4 у парах проявляє подібну на оксиди сульфуру дію, але значно гострішу. На шкірі пари H2SO4 викликають сильні опіки. Якщо у повітрі є SO2 i SO3, виникають тумани, у яких їхня дія сумується.
NO, NO2 при вдиханні викликають подразнення слизових оболонок, набряк легенів і смерть. При хронічному отруєнні з’являються постійні катари, карієс, серцева слабкість, нервові розлади, зниження тиску. Можливе також порушення обміну речовин, м’язова слабкість. Постійне вдихання оксидів призводить до емфіземи та порушення засвоєння вітамінів. Особливо небезпечна дія оксидів нітрогену для дітей.
NO3- потрапляє у організм людини переважно через воду та продукти харчування. Допустимим вмістом нітратного нітрогену в рослинах є 0,3-0,45% від сухої маси. При більшому вмісті нітрату у продукті він має токсичну дію на людину та тварин. Передача кисню в організмі відбувається таким чином, що іони Fe2+ окиснюються дією О2 до Fe3+. Якщо ж в організмі є надмір нітрату, то він окиснює іони Fe2+ (гемоглобін перетворюється у продукт окиснення метгемоглобін), блокуючи перенесення кисню. Нормально в крові є 1-2% метгемоглобіну, а якщо його вміст підвищується до 10%, то з’являються симптоми задухи і навіть смерть. В організмі є фермент нітроредуктаза, який сприяє відновленню нітратів у нітрити. Однак у дітей грудного віку цього ферменту нема, тому потрапляння нітрату в організм може призвести до смерті. Інший механізм шкідливої дії нітратів полягає у взаємодії нітратів з аміногрупами з утворенням нітрозоамінів, які мають канцерогенну, мутагенну та ембріотоксичну дію. Є зв’язок між концентрацією нітратів та раком шлунка, сечового міхура, нирок, кишківника, стравоходу, печінки.
NO2- в організмі теж викликає метгемоглобінемію, знижується відпорність до онкологічних факторів. Нітрити шкідливі для хворих на дисбактеріоз кишківника, дихальної та серцево-судинної систем.
H2S – високотоксичний газ. Він уражає нервову систему; тканини не можуть засвоювати кисень, змінюється кількість еритроцитів у крові. При дії гідрогенсульфіду на шкіру виникають дерматити, екземи, захворювання очей (загострена реакція на світло).
СО – безбарвний газ без запаху і смаку. Цей газ (чадний газ) – один з найпоширеніших забруднювачів, який є дуже небезпечний та отруйний. Гемоглобін крові має високу спорідненість до СО, яка у 210 разів вища за спорідненість до кисню. У відсутності СО гемоглобін (Нb) в еритроцитах зворотно зв’язує весь кисень, що надходить у кров, з утворенням оксигемоглобіну
Hb
+ O2
![]() HbO2,
HbO2,
який кров’ю розноситься по всіх тканинах організму.
Якщо в повітрі є СО, то потрапивши у кров, він утворює карбонілгемоглобін – у тканини замість кисню потрапляє СО:
Hb
+ СO
![]() HbСO.
HbСO.
На щастя цей процес є оборотним. тому якщо людину вчасно забезпечити киснем, то вміст гемоглобіну відновлюється. До речі, С.А.Подолинський ще у 1872 р. опублікував німецькою мовою наукову працю, яка була присвячена процесу переносу CO i NO кров’ю, ролі гемоглобіну в цьому.
Для ссавців і людини токсичність СО залежить від дози. Смерть людини може наступити як при концентрації 1,8 г/м3, якщо тривалість вдихання 120 хв, так і при концентрації 7 г/м3 і часі дії всього 1-2 хв. При вмісті його у повітрі 0,01% з’являється в’ялість, головний біль та запаморочення, а 0,1% веде до швидкої смерті. Концентрація СО у димі цигарок становить 0,04-0,045%.
У природному повітрі вміст СО не перевищує 0,0210-3%, а в містах коливається у межах 0,110-3% - 1410-3%. На сьогодні в результаті діяльності людини у атмосферу надходить більше 350 млн. т СО на рік, причому найбільше від спалювання бензину в двигунах (70%), і значно менше від спалювання вугілля та побутових відходів, а лише 5% – від лісових пожеж. Чадний газ достатньо стабільний, тривалість його перебування в атмосфері становить від 2 до 4 місяців.
COCl2 застосовується у виробництві пластмас, барвників, хлоридів металів. Раніше його застосовували у військових цілях. Це безбарвний газ з запахом перепрілого сіна або гнилих яблук. Він викликає сповільнення кровообігу, падіння кров’яного тиску і перевантаження серцевого м’яза, а токсичний набряк легенів спричинює смерть. Отруєння наступає повільно, спочатку проявляється подразненням слизової носа і горла, кашлем. Смертельна концентрація в повітрі – 5 г/м3 .
Не лише фосген, а й продукти взаємодії його з іншими речовинами є токсичними. Так при взаємодії з первинними та вторинними спиртами утворюються ефіри карбонатної кислоти, причому перший атом хлору заміщається значно швидше. Ефіри, які містять метильний чи етильний радикал, мають сильну сльозогінну дію:
|
Фосген під дією багатьох речовин досить швидко руйнується. Так на нього діє гаряча вода:
|
Взаємодію з аміаком використовують для дегазації закритих приміщень:
|
Здатність фенолятів швидко утворювати ефіри з фосгеном дає можливість використовувати ці речовини як поглиначі у засобах захисту органів дихання:
|
Подібно взаємодіють первинні та вторинні аміни. Реакція з аніліном використовується для виявлення фосгену:
|
а взаємодія з третинними амінами і уротропіном використовувалась для захисту у „вологих” протигазах часів Першої світової війни:
|
Для індикації фосгену використовують його окиснення гідрогенпероксидом та взаємодію з йодидом у безводному ацетоні:
|
NH3 подразнює слизову оболонку органів дихання, особливо очей; уражає нервову систему; ослаблює імунітет організму. Велика концентрація призводить до гострого отруєння та смерті внаслідок спазму органів дихання. Аміак та карбамід потрапляє у воду через повітря при виробництві азотних добрив.
As. Отруєння сполуками арсену залежить від форми та ступеня окиснення. Неорганічні сполуки арсену в організмі перетворюються в органічні, а останні швидко виводяться. Розчинні арсеніти та арсенати поглинаються кишковим трактом, накопичуються у м’язах. AsO43- виводиться швидше за AsO33- з сечею. В людському організмі AsO43- є інгібітором синтезу АТФ, ДНК; арсенати порушують цикл трикарбонових кислот, бо подібні за властивостями на фосфати. AsO33- інтенсивно взаємодіє з сульфгідрильними групами білків і накопичується у покривних тканинах – кератині шкіри (викликає нарости), нігтів, волосся. Симптоми інтоксикації сполуками As: порушення координації, нервові розлади. Постійна дія сполук As викликає рак шкіри. Неорганічні сполуки арсену мають ембріотоксичну дію: народжуються діти з недорозвиненими нирками, органами зору, розщілинами піднебіння, деформацією вушних раковин. Під впливом сполук арсену може виникнути також рак легенів.
AsH3 найбільш токсичний з усіх сполук арсену – безбарвний газ з запахом часнику, який викликає загальне отруєння організму, вражає кров та центральну нервову систему. Він блокує фермент, що відповідає за розклад в організмі пероксидів, накопичення яких спричинює розпад еритроцитів і зменшення гемоглобіну в крові. Через це уражається також печінка та нирки. При невеликій дозі з’являється слабкість, нудота, при більшій – задуха та судоми; шкіра дістає жовтуватий відтінок, а в сечі з’являється кров. Безпечна концентрація арсину в повітрі становить 0,01 г/м3, а смертельна 0,6 г/м3. Подібну дію мають арсеніди металів, розпилені в повітрі, а при потраплянні на шкіру викликають розпад тканин.
РН3 – безбарвний газ, що має запах тухлої риби. На повітрі він дуже легко окиснюється до оксиду фосфору і при цьому виділяється велика кількість тепла. Фосфін вражає центральну нервову систему, спричинює порушення обміну речовин в організмі. Признаки отруєння подібні на отруєння арсином, однак не відбувається гемоліз крові. В невеликих дозах він викликає головний біль, задуху, слабкість, нудоту, а при більшій дозі спочатку розширюються зіниці, а потім настає втрата свідомості. Смертельна концентрація фосфіну в повітрі 1,5 г/м3, смерть настає внаслідок набряку легенів і паралічу серцевого м’яза.
F-. Сполуки фтору подразнюють слизові оболонки аж до утворення язв і виникнення кровотеч. У воді підвищений вміст фториду веде до флюорозу – порушення фосфорно-кальцієвого обміну, зуби та кості м’якнуть, деформуються, ламаються. Фториди потрапляють у водойми переважно як відходи виробництва фосфатних добрив, причому переходять із нерозчинної (CaF2) у розчинну форму.
Однак недостача фториду теж шкідлива. Так оптимальний вміст фториду у питній воді повинен бути у межах 0,7-1,5 мг/л. Необхідно зазначити , що у більшості регіонів Львівщини є низький вміст фториду у водах, тому концентрація фториду у водопровідній воді м. Львова не перевищує 0,5 мг/л. Особливо мала кількість фториду у водах Яворівщини і практично відсутній він у воді м. Новояворівська, Яворова, с.м.т. Шкла. Тривале вживання такої води небезпечне виникненням карієсу зубів.
CN-. У довкілля можуть потрапляти як неорганічні ціаніди, так і органічні нітрили зі стічними водами виробництва полімерів, гальванічних цехів, виробництва коксу. Однак ціаніди є і проміжним продуктом метаболізму рослин і тварин.
Ціанідна кислота – безбарвна рухлива рідина з запахом гіркого мигдалю, специфічно діє на один із ферментів, що містить ферум, і відповідає за тканинне дихання (біологічне окиснення продуктів ферментативного перетворення глюкози киснем, що супроводжується виділенням енергії). Зв’язуючись з утвореним після передачі кисню Fe3+, ціанід його блокує і не дає можливості до відновлення у Fe2+, таким чином гальмуючи наступну передачу кисню в тканини.
За відсутності ціаніду окиснений Fe3+ дає такий продукт: |
|
|
|
В одержаному продукті ціанід міцно зв’язує Fe3+: |
|
||
Таким чином, блокуючи один із ферумовмісних ферментів, ціаніди викликають парадоксальне явище: у тканинах є достатня кількість кисню, а засвоїти його вони не можуть. В організмі внаслідок цього формується патологічний стан гіпоксії.
Середньодобова допустима концентрація HCN в атмосферному повітрі населених пунктів становить 0,01 мг/м3, а максимальна разова – 0,2 мг/м3. Якщо у повітрі концентрація HCN становить 20 мг/м3, то шкідливої дії на організм не спостерігається. Можуть з’явитись признаки хронічного отруєння, які проявляються нудотою, пітливістю рук, болем голови, порушенням роботи кишково-шлункового тракту. При підвищенні концентрації до 0,25-0,4 г/м3, вдихання забрудненого повітря протягом 5-10 хв призводить до судом, втрати свідомості і паралічу дихання. Більша концентрація викликає миттєву смерть. Смертельна доза для людини становить 1 мг/кг, а допустима добова доза – 8,4 мг/добу.
Хлорціан (Cl-CN), безбарвний газ, який є продуктом органічного синтезу. Його тример хлористий ціанур – вихідна речовина для одержання гербіцидів та барвників триазинового ряду:
|
Хлорціан викликає подразнення слизової оболонки очей і органів дихання, а в організмі розкладається з виділенням ціаніду. Концентрація хлорціану в повітрі 0,4 г/м3 викликає смерть. Однак, при кип’ятінні у воді і особливо в лужному середовищі хлорціан повністю гідролізує до нетоксичних продуктів:
Cl-CN + 2NaOH = NaCNO + NaCl + H2O,
а при діє аміаку утворює нетоксичний NH2-CN.
На даний час відома низка антидотів ціанідів та гідрогенціаніду, які поділяють на метгемоглобіноутворюючі речовини та речовини, які зв’язують ціаніди.
Метгемоглобіноутворюючі антидоти (амілнітрит, нітрити, 4-диметиламінофенол, антиціан) є окисниками і потрапивши у кров, перетворюють оксигемоглобін у метгемоглобін. Метгемоглобін (MtHb) містить у своєму складі Fe3+, а останній зв’язує ціанід, через що ціаніди з тканин переходять у кров – відновлюється тканинне дихання.
MtHb(Fe3+) + nCN- MtHb[Fe(CN)n]3-n.
Однак утворений ціанметгемоглобін є нестійкий і через певний час ціаніди знову потрапляють у тканини. Недоліком нітриту як окисника є різка судинорозширювальна дія, яка при передозуванні може викликати нітритний колапс.
Речовинами, які зв’язують ціаніди, є тіосульфат, глюкоза, вітамін В12, дикобальтетилендіамінтетраацетат. Ці речовини вводять в організм довенно.
Тіосульфат швидко перетворює ціанід за участю ферменту роданези:
Na2S2O3+
HCN
![]() NaSCN + NaHSO3.
NaSCN + NaHSO3.
Глюкоза альдегідною групою зв’язує ціанід в оксинітрил:
Кобальт у етилендіамінтетраацетаті утворює з ціанідом комплекс.
Ураження ціанідами лікують за схемою: спочатку вдихання амілнітриту як найпростіший спосіб; вводять антиціан дом’язово або довенно; довенно вводять натрій тіосульфату і глюкозу.
Для дегазації HCN використовують у лужному середовищі солі феруму (ІІ, ІІІ) та купруму, які утворюють стійкі нетоксичні ціанідні комплекси.
Руйнують ціанід окисненням гіпохлоритом у лужному середовищі:
2HCN + Ca(OCl)2 + Ca(OH)2 Ca(OCN)2 + CaCl2 + 2H2O,
або дією формальдегіду з утворенням нітрилу гліколевої кислоти:
HCN + H2C+O HO-CH2-CN.
Галогенангідриди фосфатної кислоти, особливо фторпохідні, |
|
дуже токсичні. Їх використовували раніше як інсектициди. Як більшість фосфорорганічних речовин, вони здатні зв’язуватися з білками і ферментами як білковими речовинами, особливо нервової системи, тому ці речовини мають нервово-паралітичну дію.
Хлортрифторид ClF3 – безбарвний газ з солодкуватим запахом, який використовується в синтезах неорганічних та органічних фторовмісних сполук, а також як добавка-окисних для одержання високотемпературного полум’я. Це дуже сильний окисник, особливо органічних речовин. Він викликає опіки шкіри та слизових оболонок, некроз тканин та набряк легенів. Отруєння ним смертельне.
В. Сполуки бору добре всмоктуються органами травлення, але досить легко виводиться з організму. У високих концентраціях бор викликає розлади функцій статевої системи, є токсичним, має ембріотоксичну дію.
Тетраборати, як відбілюючі реагенти, входять у склад багатьох синтетичних миючих засобів. Очисні споруди малоефективні стосовно цих сполук, тому в природу потрапляє велика кількість бору.
Al є одним з найпоширеніших і вживаних металів, які використовуються. Це і посуд, і харчова фольга, і викиди у повітря цементних заводів та алюмінієвих комбінатів. У цигарковому димі поряд з арсеном, кадмієм, полонієм міститься алюміній. Багато алюмінію потрапляє в організм з ліками (смекта, альгель для лікування шлунка). Сполуки алюмінію впливають на енергетичний обмін в організмі. Так аргентум і магній утворюють міцні структури АТФ, що забезпечує нормальний перебіг енергетичних процесів. Якщо їх замінює алюміній, то структура АТФ стає менш міцною і легко руйнується, особливо при нагріванні (перегрів на сонці, висока температура, дія радіоактивного випромінювання). При цьому різко порушується енергетичний обмін. Клітини організму через енергетичне голодування починають хаотично ділитися і це може призвести до злоякісного утворення. Доведено, що чим більше магнію в ґрунті, тим менше у цій місцевості онкологічних захворювань. Сполуки алюмінію накопичуються в печінці та мозку, викликаючи розлади центральної нервової системи.
Вміст алюмінію у питній воді не повинен перевищувати 0,2 мг/л.
Ве утворює токсичні для клітин живих організмів сполуки, проникаючи таким чином у всі органи.
Sr. Надмір стронцію призводить до порушення розвитку кісткових тканин та зубів у дітей.
Ba є високотоксичний. Сполуки барію навіть у невеликих концентраціях є ембріотоксичними, викликають мутагенні зміни; накопичуються переважно у кістках, замінюючи кальцій. Смертельна доза BaCl2 для людини – 0,55 г.
Se. Надмір сполук селену в організмі порушує роботу печінки. Порушується кальцієвий обмін, руйнується емаль зубів. У деяких випадках уражається міокард, нирки, підшлункова залоза.
Важкі метали. Загалом токсичність важких металів зумовлена їхньою здатністю до комплексоутворення. Надлишковий вміст їх приводить до заміщення інших катіонів в активних центрах ферментів. Іони Cu2+, Co2+, Ni2+, Pb2+, i Zn2+ утворюють міцні зв’язки з сульфогрупами ферментів, витісняючи слабше зв’язані катіони – ферменти інгібуються. Деякі катіони мають здатність зв’язуватися з нітрогеновмісними основами ДНК і фосфатними групами біоактивних молекул. Вони змінюють проникність мембран, сильно утруднюють окисне фосфорилювання і синтез білків.
За дією на людських організм 20 токсичних важких металів можна поділити на такі основні класи небезпеки:
Cd, Hg, Ni, Pb, Co, As, (Pb Cd, Ni потенційно канцерогенні);
Cu, Zn, Mn;
інші важкі метали.
Hg. Сполуки меркурію, особливо з органічними радикалами, легко засвоюються живими організмами і тривалий час не виводяться з організму. За токсичністю поділять сполуки ртуті на елементарний Hg, неорганічні сполуки, органічні сполуки.
В організмі людини сполуки меркурію утворюють зв’язки з алкільними та арильними радикалами, з тіоловими групами. Це викликає інтенсивне біоперенесення, тому такі сполуки особливо токсичні. Hg акумулюється в печінці, нирках, мозку. Час напіввиведення меркурію з людського організму становить 70-189 днів. Уражається нервова система, органи травлення, печінка. Важким захворюванням є ртутна енцефалопатія. Проявами її є порушення мови, погіршення зору, починають труситися руки і навіть виникає параліч кінцівок, а у 15% випадків закінчується смертю. Ці розлади отримали назву хвороби мінамато (за назвою затоки Мінамата в Японії).У 1953 р. люди, які жили в районі цієї затоки, почали хворіти і основними симптомами захворювання було погіршення зору, розлад координації рухів. Із 120 людей, які захворіли, 46 померло раніше, ніж було виявлено причину. Виявилось, що люди та тварини отруїлись рибою та молюсками, виловленими у затоці. У воду затоки потрапило багато сполук меркурію з річки, на березі якої розташовувалась фабрика пластмас. Частина меркурію була у формі неорганічних сполук, а частина у формі більш токсичного метилмеркурію.
Меркурій потрапляє у природні води з багатьох джерел. Річка Інгліш-Рівер в провінції Онтаріо (Канада) була забруднена меркурієм, який потрапляв зі стоками заводу з виробництва хлору і каустичної соди, а вміст у виловленій рибі був таким же високим, як і в рибі з затоки Мінамата.
Сполуки меркурію переважно не є канцерогенами, але мають ембріотоксичну дію, викликають у дітей церебральний параліч, розщілини, дефекти серця. Важким є отруєння плоду у вагітних жінок, бо органічні сполуки меркурію потрапляють через плаценту і викликають важкі церебральні паралічі, причому за відсутності проявів отруєння у самих жінок. Виводяться сполуки меркурію з виділеннями та волоссям.
Cd. Пил кадмію викликає в легенях пневмоконіоз. Сполуки кадмію подразнюють слизові оболонки, органи травлення, вражають нервову систему, викликають дистрофічні зміни внутрішніх органів, печінки, нирок. Отруєння має тривалий скритий період. Кадмій накопичується у внутрішніх органах, час напіввиведення сполук кадмію з людського організму 10-30 років. В Японії на початку 20 ст. було виявлено захворювання, яке проявлялось у болях суглобів, ламкості костей, деформації скелету, анемії, гіпертонії. Це захворювання виявлено у 1946 р. в Японії і отримало назву хвороби ітай-ітай. Сполуки кадмію потрапляли із цинкового комбінату в ріку, а потім з повенями на рисові поля. Серед споживачів цього рису було зареєстровано 50% смертних випадків. Зараз встановлено, що у крові людини в 70 разів більше кадмію, ніж було у первісних людей. Сполуки кадмію спричинюють захворювання серця. Хронічне отруєння сполуками кадмію проявляються у нефротоксичності в поєднанні з високою кумулятивністю. В Америці зареєстровано багато випадків захворювання від вживання води, збагаченої на кадмій. У Бразилії в штаті Байя була виявлена "диявольська хвороба", спричинена стоками сполук кадмію та плюмбуму, а також інших важких металів у ріку. Смертельна доза кадмію для людини – 30-90 мг/кг маси тіла. Крім того кадмій має ембріотоксичну дію – народжуються діти з розщілинами, водянкою мозку, відсутніми пальцями, а іноді наступає смерть плоду. Канцерогенну дію сполуки кадмію, особливо CdO, мають на залози внутрішньої секреції, носоглотки.
Pb. Сполуки плюмбуму можуть потрапляти у водойми зі стічними водами, з викидами автотранспорту. Поступає плюмбум в організм переважно через органи дихання. Фонове надходження в організм людини становить 0,15 мг на добу (в Україні 0,06-0,17 мг на добу). У процесах обміну Pb2+ заміняє Ca2+ і накопичується найбільше в кістковій тканині, у покривних тканинах (волоссі, нігтях). Крім того він вражає нервову систему, особливо Pb(NO3)2, (блокує перенос через мембрану клітин кальцію і надходження його в нервові закінчення), травну систему, нирки, органи кровотворення. В організмі плюмбум блокує групи SH- білків. Час напіввиведення з крові і м’яких тканин людини становить 20 років. Відносно малотоксичними є малорозчинні PbГ2, PbSO4, Pb3(PO4)2, Pb(OH)2. Токсична дія сполук плюмбуму обумовлена його високою кумуляцією, він має ембріотоксичну та мутагенну дію, канцерогенний ефект. Отруєння плюмбумом (сатурнізм) відоме з античних часі, коли вживали свинцевий посуд та водогони зі свинцю. В малих дозах плюмбум призводить до відхилень у розумовому розвитку дітей 2-5 річного віку, а особливо перших 6 місяців. Однак повноцінне харчування послаблює цей ефект. Висока доза сполук плюмбуму спричинює гостре отруєння, яке виявляється у втомлюваності, дратівливості, анемії. Одноразова смертельна доза неорганічних сполук Pb становить 150-500 мг/кг, a (C2H5)4Pb – 10 мг/кг маси тіла. Сполуки Pb2+ є канцерогенними. Високі дози Pb(C2H5)4 мають ембріотоксичну дію.
Відрадним є те, що в Україні на даний час не використовують плюмбумтетраетил як антидетонаторну присадку. Набув чинності стандарт ДСТУ 4063 – 2001 „Бензини автомобільні. Технічні умови”, згідно з яким сполуки плюмбуму повинні бути відсутні у бензині (раніше дозволялось до 1 мг Pb на 1 л бензину). Цей стандарт чинний з 1.07. 2002 р. Для підвищення октанового числа в бензин додають сполуки мангану, феруму, ефіри метил- та етил-третбутиловий, спирти метиловий та етиловий, високооктанові ізомери, алкілати.
Cr присутній у малій кількості в ДНК. Найбільш токсичний дихромат. Хромати та дихромати окиснюють слизову, припікаючи її – з’являється нежить, кровотечі, омертвіння та утворення язв, причому більш токсичними є біхромати. У шлунку біхромат відновлюється до Cr3+, який мало засвоюється (не більше 1%). Для людини сполуки хрому не є гостро-токсичними (більш токсичний Cr2O72-, однак він легко відновлюється). Сполуки хрому є алергенами, викликаючи астму. Хронічне отруєння призводить до болю голови, втрати маси тіла, схильності до запальних процесів органів травлення і дихання. Найтоксичніший CaCrO4, він є одним із найсильніших канцерогенів (викликає рак легенів), має мутагенну дію.
Мо. Надлишок молібдену викликає порушення обміну речовин, спричинює артози (молібденова подагра)
Fe, Mn, Zn, Cu – це життєво необхідні елементи. Надлишок купруму, феруму, цинку надає неприємного присмаку воді.
Mn. Солі мангану у великій концентрації отруйні. Отруєння манганом було описано ще 170 років тому, отруїлися працівники марганцевого рудника.
Ni. Необхідна доза для людини становить 200-300 мкг/добу і повністю забезпечується їжею. У невеликій кількості сполуки нікелю не є гостро-токсичними. Надмір сполук нікелю в організмі людини веде до порушень біохімічних процесів на клітинному рівні. Токсичність для людини проявляється залежно від вмісту сполук Ca, Cu, Zn, Fe. Однак, пил Ni є одним із найсильніших канцерогенів легень.
У людей з захворюваннями серця встановлено підвищений вміст сполук Mn, Ni в крові і понижений вміст сполук Cu, Fe, Ba, а у тих, хто переніс інфаркт міокарда – понижений вміст Са у волоссі.
Cu – біогенний елемент, входить до складу протеїнів: гемоціаніну, цитохромної оксидази, тироксинази, лаккози, цирулоплазміну (сироватки крові). Для людини він не є гостро-токсичним елементом. Навпаки, дефіцит купруму імітує хронічну інтоксикацію. Проте надмірні кількості купруму вражають печінку, нирки, центральну нервову систему.
Zn – життєво необхідний елемент для ссавців. Однак у великих дозах цинк є токсичним. Токсичність може проявлятися у присутності інших елементів. У цинковому посуді не рекомендується зберігати харчові продукти. Отруйним є також ZnO. Вдихання його парів на виробництві викликає так звану ливарну (цинкову) лихоманку, проявами якої є озноб, головний біль, нудота, кашель.
Вплив органічних речовин
Олефіни і парафіни мають наркотичну дію, навіть у малій концентрації викликають зміни нервової системи, відставання у рості і розвитку, дратівливість, слабкість, пониження артеріального тиску. Крім того спостерігається кровіння ясен, носові кровотечі, підшкірні крововиливи. Отруєння бензолом веде до розвитку лейкемії та малокрів’я. Особливо небезпечні бензол і гомологи, хлорпохідні.
Хлорпохідні насичених вуглеводнів – наркотики. Вони викликають захворювання всіх внутрішніх органів і серця.
Бензол та ароматичні вуглеводні. Ці речовини сильно вражають центральну нервову систему. Проявами отруєння є біль голови, дратівливість, втомлюваність, сонливість або безсоння, біль серця, пониження тиску. З’являється ламкість судин – носова кровотеча, кровіння ясен, підшкірні крововиливи. Бензол спричинює захворювання крові: лейкоз, малокрів’я.
Спирти – сильні наркотики. Метанол СН3ОН веде до атрофії зорового нерва та сліпоти. Етанол С2Н5ОН викликає хронічний катар шлунка, цироз печінки, розширення серця, хвороби нирок, зорового нерва, психічні захворювання. Етандіол (етиленгліколь) СН2(ОН)-СН2(ОН) – сильна отрута.
Ефіри ацетатної кислоти крім наркотичної дії викликають сильне подразнення.
Ацетон викликає сильне хронічне отруєння, малокрів’я, ураження органів дихання.
Нітро- і амінопохідні бензолу і гомологів застосовують для одержання фарб. Вони вражають кров, нервову систему, печінку, серце. Деякі похідні аніліну і нафталіну мають канцерогенну дію. При легкому отруєнні з’являється запаморочення, слабкість, нудота, ціаноз губів.
Трихлорнітрометан Cl3C-NO2 – безбарвна рідина з характерним запахом, яка на світлі жовтіє. Його використовують для фумігації зерносховищ та ґрунту. Ним добре витруюють жуків, хрущів, клопів. При накопичені в повітрі трихлорнітрометан викликає подразнення слизових оболонок верхніх дихальних шляхів, біль очей, кашель, а при більших концентраціях нудоту. Токсичність настає при інгаляційному потраплянні в організм.
Феноли мають ембріотоксичу дію – потомство або помирає, або народжується з патологіями.
Капролактам і похідні викликають судоми, пригнічують дію ферментів у організмі. При великих концентраціях вони спричинюють параліч органів дихання, жирову атрофію внутрішніх органів.
Фотооксиданти утворюються у повітрі. До них відносяться NO2, O3, альдегіди і пероксиацетилнітрати, які утворюються в ініційованих сонячним світлом реакціях між оксидами нітрогену та вуглеводнями. Ці речовини подразнюють очі та горло, викликають респіраторні захворювання, мають канцерогенну дію. В Америці за кожні 5 років захворюваність, спричинена фотооксидантами, збільшується в 2 рази. Вдихання фотооксидантів зменшує засвоювання кисню організмом, викликає патологію центральної нервової системи та внутрішніх органів. Фотооксиданти ушкоджують також рослинність.
Полімери не є індиферентними для організму, особливо, коли містять низькомолекулярні сполуки, які є відходами при синтезі. У більшості робітників цеху поліолефінів через 5 років роботи з’являються ураження слизової оболонки носа, рота, зміна тиску, порушення функції центральної нервової системи, залоз внутрішньої секреції, а також дихальних шляхів та органів травлення. Виробництво полімерів супроводжується викидом у повітря ціанідів, фосгену, гідрогенхлориду.
Виробництво синтетичних та штучних тканин призводить до викидів цілої низки токсичних неорганічних та органічних речовин.
Лавсан (діетиловий ефір терефталевої кислоти) при виробництві спричинює викиди етандіолу, метанолу. Капрон – у випари потрапляють циклопарафіни, циклічні спирти, капролактам, (NH4)2SO4, СО, SO2. Під час виробництва штучних волокон повітря забруднюють значні кількості H2S і CS2.
Синтетичні поверхнево-активні речовини (детергенти) є складовою синтетичних миючих засобів. Останні є алергенами, викликають дерматити шкіри, порушення обмінних процесів в організмі, вони підсилюють дію канцерогенів.
Миючі засоби містять натрій поліфосфати та детергенти, а також токсичні для водних організмів речовини – ароматизатори, відбілювачі (пероксосульфати, пероксоборати), кальциновану соду, карбоксиметил-целюлозу, натрій силікат. Їхні молекули складаються з гідрофільної частини (функціональні групи: –COO–, –OSO2O–, –SO2О–, –OPO(O–)2, –CH2–CH2–O–) та гідрофобної частини (радикали аліфатичних вуглеводнів, що містять С10-18, ароматичні радикали). Гідрофільна частина буває аніоно-, катіоноактивна або амфотерна, неіоногенна. Останні розчиняються у воді внаслідок водневих зв’язків. Найпоширенішими є аніоноактивні речовини.
Аніоноактивні детергенти. Арилалкілсульфонати як полярну групу містять залишок сульфатної кислоти (R-OSO2-).
n=5–18 |
|
Алкілбензолсульфонат |
Алкілнафтілсульфонат |
Алкілсульфати одержують з насичених спиртів, вони містять сульфоефірну групу (R-О-OSO2-), первинну або вторинну
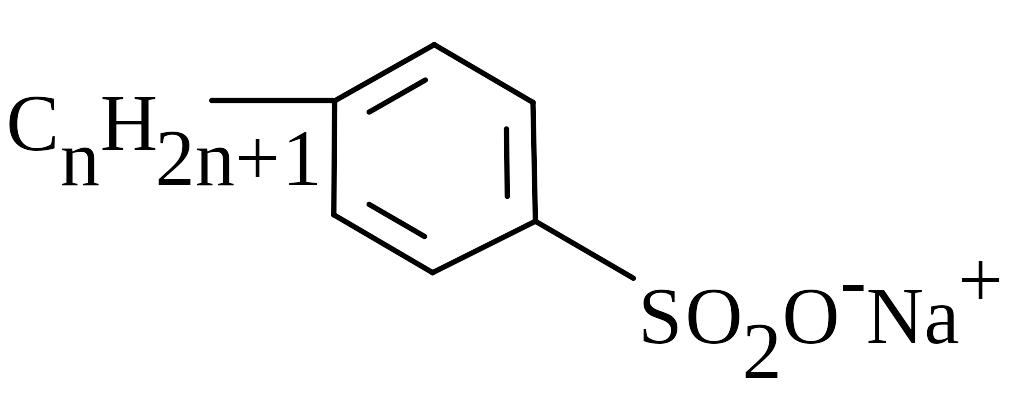
CnH2n+1–O–SO2O-Na+, n=10–20. |
Неіоногенні детергенти – продукти конденсації етилен або пропілен оксиду зі спиртами, карбоновими кислотами, фенолами, спиртами і містять групи (–CH2–CH2–O)mH, (–CH2–CH2–CH2–O–)mН (синтаноли, синтаміди). Їх загальні формули:
R–CH2–O-(-CH2–CH2–O)mH |
||
|
||
C6H5–O-(-CH2–CH2–O)mH, |
||
та одна із речовин – синтанол: |
|
де n16, m10. |
Катіоноактивні детергенти – четвертинні амонієві солі з алкільним радикалом на С12-18, а також алкільні радикали, бензильні групи: [R4N]+X-, де R: CnH2n+1, n=12-18; C6H5.
Амфотерні детергенти не набули широкого вжитку.
Детергенти потрапляють у водойми не лише з комунальними стоками, а й з виробництв, наприклад, флотаційного збагачення руд, розділення продуктів хімічної промисловості, у боротьбі з корозією обладнання. В сільському господарстві їх застосовують для кращого емульгування пестицидів у воді, а самі вони мають певну інсектицидну та гербіцидну дію.
Канцерогенні речовини – це хімічно однорідні речовини, які проявляють трансформуючу активність і здатні викликати канцерогенні, тератогенні (порушення ембріонального розвитку), або мутагенні зміни в організмі. Канцерогенну дію мають циклічні нітрозоаміни. До цієї групи належать хлоровані аліфатичні низькомолекулярні вуглеводні, пестициди, поліциклічні ароматичні вуглеводні (ПАВ), переважно високомолекулярні.
Поліциклічні ароматичні вуглеводні (ПАВ) містять 3-7 бензольних кілець, можуть мати функціональні групи: галоген-, аміно-, сульфо-, нітро-, спиртові, альдегідні, кетонні, ефірні, кислотні, хінони. Розчинність ПАВ у воді невелика, від 16,1 мг/л (аценафтилен) до 0,11 мкг/л (3,4-бензпірен), причому присутність солей не впливає на розчинність. Зростає розчинність за наявності у воді бензолу, нафтопродуктів, детергентів – органічних неполярних речовин. Серед ПАВ найпоширеніший і небезпечний 3,4-бензапірен (БП):
|
ПАВ поступають у довкілля природнім та антропогенним шляхом. Природнім шляхом ПАВ утворюються при обзоленні деревини, виверженні вулкану (вулканічний попіл містить 0,3-0,9 мкг/кг). Деякі морські водорості синтезують ПАВ: у водоростях біля Центральної Америки міститься до 0,44 мг/кг; в рачках Антарктиди до 0,23 мг/кг. Анаеробні бактерії продукують до 8 мкг бенз()пірену з 1 г ліпідних екстрактів планктону. Однак є морські та ґрунтові бактерії, здатні розкладати вуглеводні та бенз()пірен. Навіть рис та пшениця і кукурудза містять незначні кількості бенз()пірену.
Антропогенне забруднення ПАВ виникає при піролізі органічних речовин, спалюванні деревини, іншого палива. Утворення ПАВ відбувається при 650-900С і недостачі кисню. Під час піролізу деревини максимальних вихід бенз()пірену спостерігається при температурах 300-350С.
Обчислено, що фонова концентрація БП (синтез природнім шляхом і вулканічні викиди) становить: у ґрунті 5-10 мкг/кг, у рослинах 1-5 мкг/кг, у прісних водоймах 0,1 нг/л (табл. 4.3)
За оцінками М.Зюсса (1976 р.) глобальна емісія БП у 70-і роки становила 5000 т/рік, з якої 72% припадало на промисловість, 27% на всі види відкритого спалювання органічних речовин.
Таблиця 4.3 Забруднення довкілля бенз()піреном (мкг/кг)
Об’єкт |
Ступінь забруднення |
||
помірний |
помітний |
сильний |
|
Ґрунт Рослинність Вода (мкг/л) Донні відкладення Вищі водні рослини |
20-30 10 0,005 20-30 15-20 |
31-100 11-20 0,01 100 50 |
100 20 0,01 100 50 |
Пестициди. За попередні 25 років зареєстровано 50 000 випадків отруєння людей, причому 70% гострих захворювань – фосфорорганічними. Вони викликають порушення діяльності центральної нервової, серцево-судинної системи, народження дітей з аномаліями та ослабленою імунною системою; понижується тривалість життя людей та виникають онкологічні захворювання. Отруєння викликають і токсичні домішки пестицидів.
Пестициди, залежно від біологічної дії поділяють на: інсектициди – для знищування комах, афіциди – проти попелиці. Вони бувають контактні, які уражають комахи при контакті з будь-якою частиною їх тіла, кишкові, отруюючи комах з кормом, системні, які потрапляють в рослину і таким чином уражають комах, фуміганти, які потрапляють в організм комах через органи дихання. Крім того є препарати побічної дії, такі як репеленти – для відлякування комах, атраканти – для приваблення, препарати статевої стерилізації; гербіциди – для знищування бур’янів, та подібної дії арборициди – для знищування чагарників; альгациди – для знищування морської рослинності; акарициди – проти кліщів; фунгіциди – проти грибків; бактерициди – проти збудників бактеріальних захворювань рослин і тварин; антисептики – для знешкодження мікроорганізмів; родентоциди або зооциди – для боротьби з гризунами; молюскоциди або лімациди – для боротьби з молюсками; нематоциди – для боротьби з черв’яками; ретарданти – препарати для регулювання росту рослин; дефоліанти – для видалення листя; десиканти – для підсушування рослин, що сприяє кращому збору урожаю.
Виготовляють пестициди у вигляді порошків, емульсій, розчинів з поверхнево-активними речовинами, у мікрокапсульованій формі, мікрогранульовані. Переважно пестициди розпилюють на рослини.
Хлорорганічні інсектициди одержують хлоруванням ароматичних чи гетероциклічних рідких вуглеводнів. Найпершими були галогенпохідні аліфатичних вуглеводнів, які є високолеткими і використовувались як фуміганти. Найширше застосування знайшли гексахлорбутадієн та метилбромід.
Велика група хлорорганічних пестицидів це хлоровані похідні циклодієну (елдрин, дилдрин, гептахлор); ізомери гексахлорциклогексану (ліндан) і раніше застосовуваний ДДТ (дихлордифенілтетрахлоретан) та його похідні. Період піврозпаду таких речовин –десятки років. Вони дуже стійкі до біодеградації.
У воді часто зустрічаються поліхлорбіфеніли (ПХБ) – похідні ДДТ, всього 210 гомологів та ізомерів. ПХБ використовують і у виробництві пластмас, барвників, вони утворюються при спалюванні твердих відходів на промислових і побутових звалищах. Звідси вони потрапляють в атмосферу, а потім з опадами – у ріки, на ґрунти. Навіть у снігу в Антарктиді виявлено 0,03-1,2 нг/л ПХБ.
Хлорування камфену дає препарат гептахлор. Ці речовини нерозчинні у воді, добре розчиняються у органічних розчинниках, а тому в живому організмі накопичуються у жировій тканині.
Нижче наведені деякі представники хлорорганічних пестицидів.
|
|
|
|
Ліндан |
дихлордифеніл-трихлоретан (ДДТ) |
дихлордифеніл-дихлоретан (ДДД) |
дихлордифеніл-дихлоретен (ДДЕ) |
|
|
|
|
Метилбромід |
Гексахлорбутадієн |
Гептахлор |
|
Фосфорорганічні пестициди – це складні ефіри різних спиртів і ортофосфатної, тіо- та дитіортофосфатної кислоти, фосфонової кислоти. Вони мають більш вибіркову дію. Всі фосфорорганічні пестициди протягом місяця розкладаються біохімічно. Всього синтезовано 50 тисяч таких речовин, серед яких найпоширеніші паратіон, малатіон, фозалон, дурсбад.Більшість із фосфорорганічних пестицидів мають інсектицидні та акарицидні властивості.
|
|
Дихлофос |
Метилпаратіон |
|
|
Іпробенфос (рицид П) |
Трихлорфон (хлорофос) |
|
|
Диметоат (фосфамід) |
Малатіон (карбофос) |
Відомі також фосфорорганічні гербіциди:
|
Глуфосинат амоній Раундап |
Найбільш відомий випадок отруєння домішкою стався у 1976 р. в Пакистані. З 7500 сільськогосподарських працівників, які обробляли малатіоном плантації бавовни, отруїлось 2800. Причиною став ізомалатіон, який утворився у змочуваному порошку препарату внаслідок його неправильного одержання. Інші пестициди цієї групи можуть містити токсичні домішки, такі як тіолові ізомери тіофосфатів.
Речовина, яка має застосування як інсектицид під назвою амітон, і використовувалась раніше у воєнних цілях, належить до групи ефірів фосфатної кислоти:
|
Сполуки, які мають інші алкільні замісники, належать до групи фосфорилхолінів, є особливо токсичними для теплокровних тварин. Вони вражають фермент ацетилхолінестеразу, добре всмоктуються через шкіру. Смертельна доза при потраплянні у шлунок людини становить 70 мкг/кг. У нейтральному та слаболужному середовищі сполука гідролізує з розривом зв’язку P-S і утворюються нетоксичні продукти. Гідроліз у кислому середовищі призводить до утворення твердих амонієвих солей, не менше токсичних за вихідну речовину. Амітон є інсектицидом та акарицидом з обмеженим застосування через високу токсичність. Найчастіше його випускають у вигляді гідрогеноксалату і застосовують як отруту проти щурів (ЛД50 2 мг/кг).
Карбамати – складні ефіри п-метакарбамінової кислоти |
|
або уретани. Сама карбамінова кислота не існує у вільному стані. Солі її, які й мають назву карбамати, є стійкі. Як пестициди використовують уретани, однак склалося, що їх помилково називають „карбаматами”. Ці пестициди мають вибіркову дію, за біологічною активністю серед „карбаматів” є інсектициди, гербіциди, фунгіциди, молюскоциди. Деякі карбамати мають канцерогенну та тератогенну дію, тому їх виробництво останньо зменшилося. Приклади деяких карбаматів:
|
|
|
Карбарил |
Оксаміл |
Беноміл (бенлат) |
Тіокарбамати мають широкий спектр дії як гербіциди, інсектициди та фунгіциди. Це ефіри та солі тіокарбамінової кислоти. Деякі з них наведені нижче:
|
|
|
Молінат |
Карбатіон |
Цинеб (аспор) |
При нагріванні дитіокарбамати розкладаються до СS2 і H2S.
Сполуки з меркурієм та станумом. Органічні сполуки стануму використовують як фунгіциди, а деякі як гербіциди (пліктран, фенбутатиноксид).
|
|
Пліктран |
Торк |
Раніше як фунгіциди застосовували солі купруму, сполуки сульфуру, меркурійвмісні сполуки – дуже токсичний хлорований метилмеркурій, менш токсичні ацетат фенілмеркурію та метоксиетилмеркурій. Нижче наведені деякі з них:
CH3-Hg-Cl |
C2H5-Hg-Cl |
(C2H5-Hg)3-РО4 |
|
Метилмеркурій хлорид |
Етилмеркурій хлорид або гранозан |
Етилмеркурій фосфат |
Фенілмеркурій ацетат |
У ґрунті під впливом мікроорганізмів сполуки меркурію розкладаються з виділенням вільної ртуті:
2CH3-Hg-Cl +2H+ = (CH3)2Hg + Hg+ 2HCl.
Похідні феноксиацетатної кислоти з сильною фізіологічною дією; триазини (симазин) і заміщені сечовини (монурон, діурон, піхлорам) – стійкі в грунті, розчинні у воді. Усі вони переважно використовуються як гербіциди.
Гербіциди на основі карбонових кислот – це аліфатичні, аліциклічні та ароматичні кислоти , які можуть мати вуглеводневий радикал заміщений атомами хлору.
Загальна формула арилоксикарбонових кислот |
|
Найбільш відомий гербіцид 2,4-дихлорфеноксиацетатна кислота (2,4-Д).
У природному середовищі похідні арилоксикарбонових кислот легко гідролізують до вільних карбонових кислот.
Похідні сечовини є одними з найбільш вживаних гербіцидів, однак деякі з них мають канцерогенну дію.
Серед гербіцидів найсильніше діє піхлорам. Для повного знищення деяких видів рослин достатньо 60 г/га цієї речовини.
|
Заміщені сечовини |
Інші гербіциди |
|
|---|---|---|---|
Фенурон |
Трихлопір |
Дикамбра |
|
Метабромурон |
Піхлорам |
Іоксиніл |
|
Хлороксинурон |
|
Бромоксиніл |
|
Серед гетероциклічних сполук широке застосування як гербіциди мають триазинові похідні. Крім того застосовують також і інші гетероциклічні сполуки, а саме похідні фурану, піролу, імідазолупіридину, піримідину піперазину, тіадіазинів (бентазон).
Триазини |
|
|
||
Симазин |
Прометрин |
Хлоридазон |
||
Атразин |
Гексазінон |
|
||
Синтетичні аналоги природних пестицидів. Природні пестициди або піретроїди зустрічаються в природі часто у вигляді пилку певних видів рослин і проявляють інсектицидну дію. Зараз синтезують низку аналогів природних піретренів:
|
|
Перметрин |
Циперметрин |
Токсини – речовини білкової природи рослинного, тваринного, мікробного походження, які мають високу токсичну дію. При потраплянні в організм вони здатні виробляти в ньому імунітет, тобто проявляють антигенну дію. Природні отрути – це речовини природного походження, які в організмі не викликають імунної відповіді. Токсини, на відміну від організмів – продуцентів, не є живими речовинами, не мають інкубаційного періоду. Історично першим відкритим токсином був рабітоксин – токсин сказу (лат. rabiat – скажений), другим – токсин дифтерійної палички. До токсинів відносяться правцевий, гангренозний, ботуліновий. При дії на токсини формаліну утворюється неотруйний анатоксин. Анатоксини використовують як складові вакцин. За походженням токсини класифікують на: фітотоксини, які продукуються окремими видами рослин; зоотоксини тваринного походження; мікробні токсини.
Мікотоксини – це токсичні продукти обміну речовин нижчих грибів. Зараження мікотоксинами продуктів харчування виникає під час збирання урожаю, обробки, зберігання чи транспортування продукції. Запобігти цьому можна, застосовуючи натуральні консерванти або відповідне упакування на основі водорозчинних полімерів з антисептичними властивостями, тощо.
Залежно від ролі токсину в житті організму-продуцента їх поділяють на ендотоксини та екзотоксини. Ендотоксини – продукти обміну речовин, які знаходяться всередині клітин У зовнішнє середовище вони виділяються лише після смерті організму. Це переважно комплекси поліпептидів з полісахаридами, ліпідами або ліпополісахаридами. Екзотоксини хоч і виробляються клітинами, але виділяються в зовнішнє середовище. Екзотоксини є речовинами білкової природи.
Токсини (переважно екзотоксини) за дією на організм поділяють на нейротоксини (порушують проникність мембран нервових клітин), цитотоксини (порушують структуру біологічних мембран і навіть їх руйнують), токсини-ферменти (сприяють гідролізу білків, полісахаридів, ліпідів, нуклеїнових кислот) та токсини, які є інгібіторами ферментів (порушують каталітичну дію).
Токсини мають глобулярну будову, на вигляд це тверді аморфні порошки, які частково розчиняються у воді і утворюють гелі. Як природні полімерні речовини, вони втрачають четвертинну та третину структуру при незначному нагріванні, в кислому і лужному середовищі піддаються реакції гідролізу, окиснюються гіпохлоритом, перманганатом, хлораміном, руйнуються альдегідами і кетонами, зшиваючи поліпептидні ланцюги -R-(CH2)n-NH2
Дуже небезпечним є афлатоксин В1, який провокує рак печінки.
Екзотоксини ботулінових бактерій є сумішшю двох біополімерів, які мають нейротропну і гемаглютинуючу дію. Вони культивуються лише в безкисневому середовищі на білковій основі. Загалом це сім типів токсинів (A, B, C, D, E, F, G), які дещо відрізняються набором та кількістю амінокислот. Найтоксичніший A, потім B, E, F. Токсин А витримує потрапляння сонячного світла, охолодження до -253С, солену воду, а після висушування може відтворитися навіть через 100 років. Спори токсину зустрічаються в овочах, фруктах, личинках мух, тканинах тварин і риби, кишківнику людини і тварини. Знищити їх можна лише кип’ятінням при 100С протягом 6 год, а також дуже довготривалою обробкою 20% формаліном або 10% хлоридною кислотою.
Отруєння ботуліновим токсином А переважно має летальний наслідок, уражається нервова система і передача імпульсів на м’язи. Прояви отруєння можуть наступити після декількох годин і навіть після 2-3 діб. Спочатку з’являється слабкість, нудота, тоді розширення зіниць і ураження зору, двоїння, а потім параліч ковтальної мускулатури і судоми.
Ботуліновий токсин А, порошок сірого кольору, флуоресціює в ультрафіолетовому випромінюванні, що використовується для його ідентифікації.
Стафілококові екзотоксини, які також є сумішшю біополімерів, є цитотоксинами і викликають шлунково-кишкові розлади в організмі. В природі найбільше токсинів, які продукуються золотистими стафілококами. Стафілококи є стійкими анаеробами, накопичуються часто в жировій тканині, підшкірній тканині. Це речовини, які у воді утворюють стійкі гелі, витримують кип’ятіння протягом 30 хв, однак руйнуються сильними окисниками та формальдегідом. Найчастіше стафілококами уражаються молоко, солодкі сиркові маси, креми.
Радіоактивне випромінювання. Хронічна дія радіоактивного випромінювання (десятки і сотні бер щорічно) призводить до ураження шкіри, кришталика ока, кісткового мозку. Згодом виникають онкологічні захворювання, народжується потомство із спадковими аномаліями. Віддалені наслідки мають малі дози (100 бер за життя). Кожна 4-6 людина хворіє на рак, 6-10% дітей мають генетичні порушення. При хронічній променевій хворобі зменшується вміст лейкоцитів і тромбоцитів у крові, понижується тиск, змінена кардіограма. Потім порушується ферментна система, формується астенічний синдром. Наростає почуття втомлюваності, порушення сну, афективна нестриманість, у дітей збільшуються лімфовузли, виникають захворювання крові, нирок, катаракта, вегето-судинна дистонія. Гостра променева хвороба призводить до смерті.
Радіоактивні ізотопи: йод накопичується у щитоподібній залозі, а потім надходять у печінку і виводиться через нирки; цезій відкладається у м’язах; плутоній поступово переходить в америцій.