
- •Федеральное агентство по образованию ГосударСтвенное образовательное учреждение высшего профессионального образования «вологодсий государственный педагогический университет»
- •Алюминий и его соединения. Вариант 1
- •Алюминий и его соединения. Вариант 2
- •Алюминий и его соединения. Вариант 3
- •Алюминий и его соединения. Вариант 4
- •Литература
- •Николай Александрович Шириков Ольга Ивановна Ширикова Редподготовка – ю. С. Кудрявцева
Федеральное агентство по образованию ГосударСтвенное образовательное учреждение высшего профессионального образования «вологодсий государственный педагогический университет»
УЧИСЬ РЕШАТЬ ЗАДАЧИ ПО ХИМИИ
(выпуск 1)
Вологда
«Русь»
2012
Составители:
Н.А. Шириков, О.И. Ширикова, С.Г.Марсов, А.В. Мкртчан, Д.В. Барам,
Н.А. Калиновский
Методическое пособие окажет помощь учителям, студентам и школьникам в совершенствовании теоретических знаний и умении решать задачи разной степени сложности.
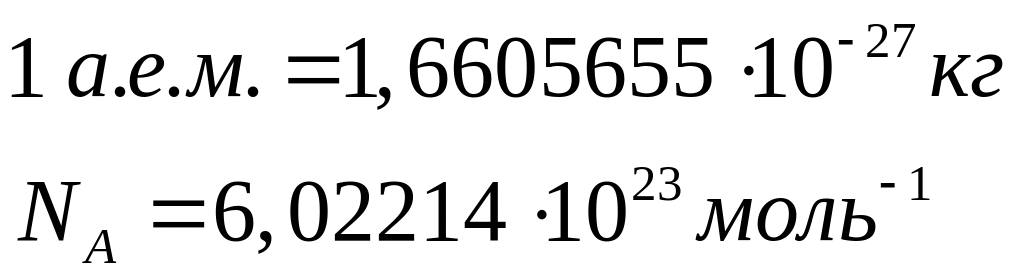
Вычислить массу атома алюминия (в граммах).
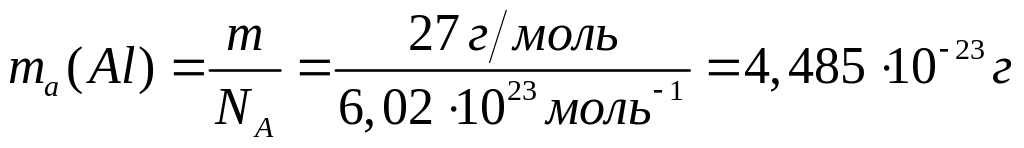
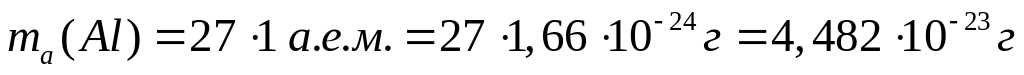 Решите:
Вычислить
массу атома бора (в граммах).
Решите:
Вычислить
массу атома бора (в граммах).Имеется 18,75 г сульфида алюминия. Вычислите количество вещества, число молекул, массу молекулы сульфида алюминия.
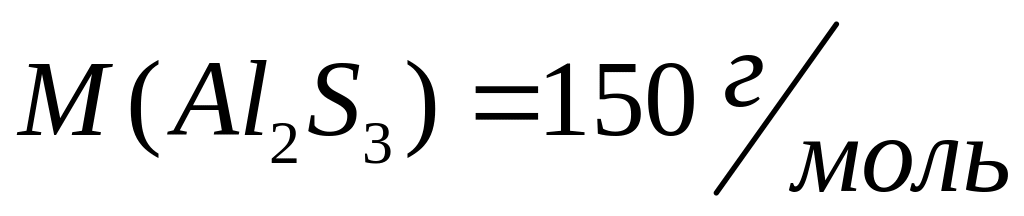
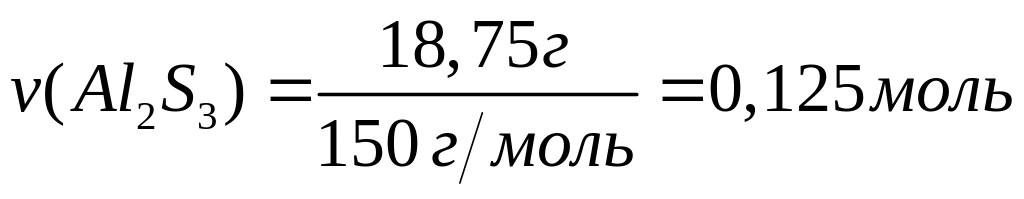
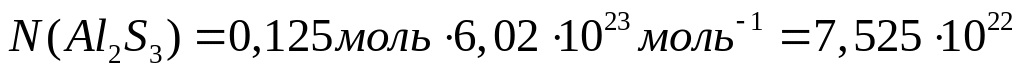
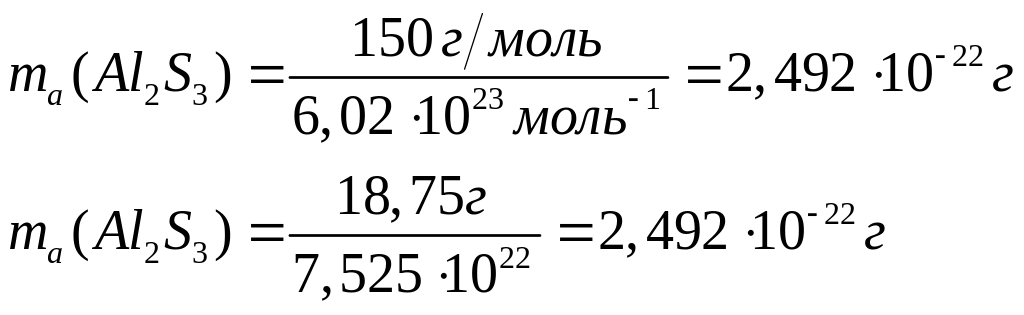
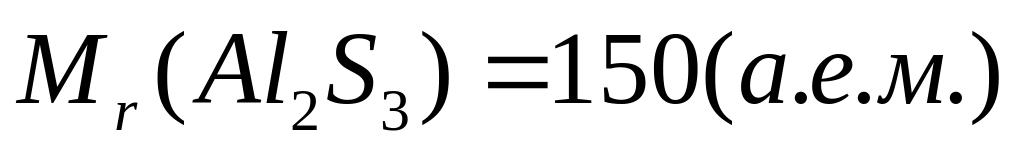
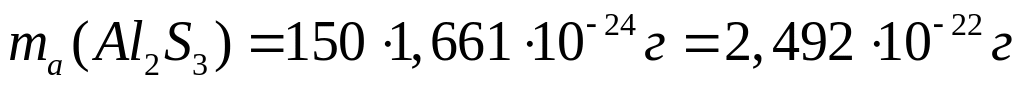 Решите:
Имеется
12,3 г нитрида алюминия. Вычислите
количество вещества, число молекул,
массу молекулы нитрида алюминия.
Решите:
Имеется
12,3 г нитрида алюминия. Вычислите
количество вещества, число молекул,
массу молекулы нитрида алюминия.В какой массе сульфата алюминия содержится
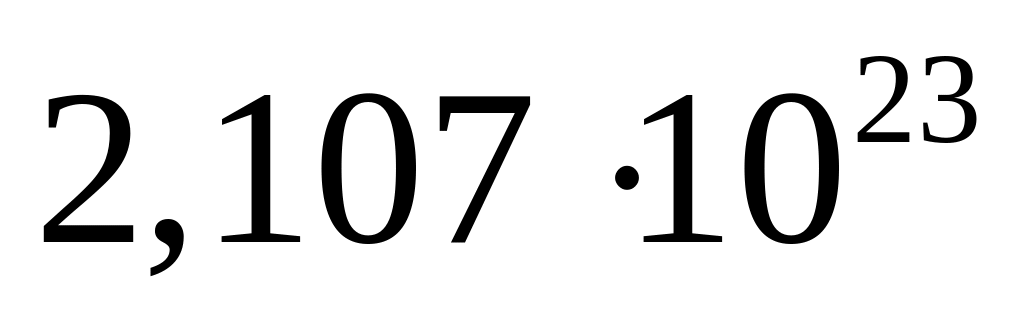 атомов алюминия?
атомов алюминия?
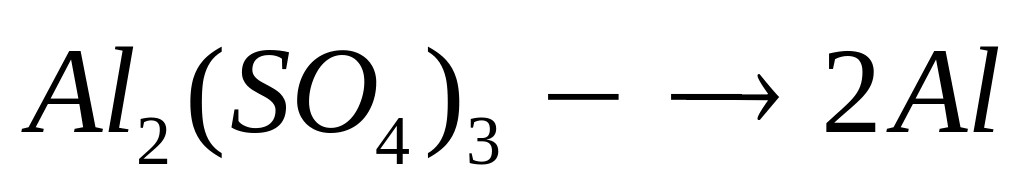 1
моль 2 моль
342 г/моль
1
моль 2 моль
342 г/моль
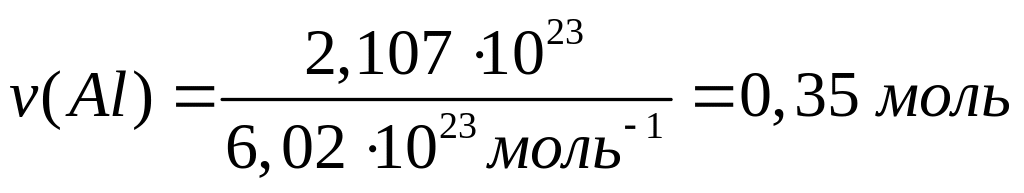
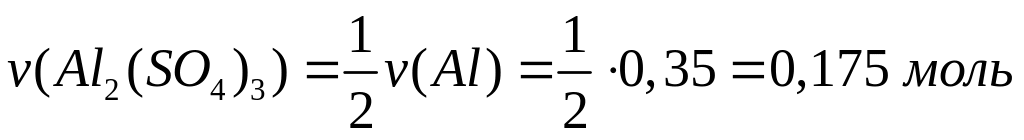
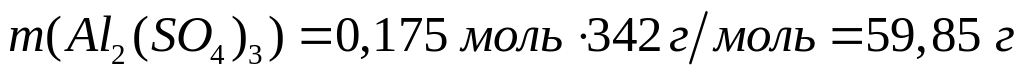 Решите:
В
какой массе ортофосфата алюминия
содержится
Решите:
В
какой массе ортофосфата алюминия
содержится
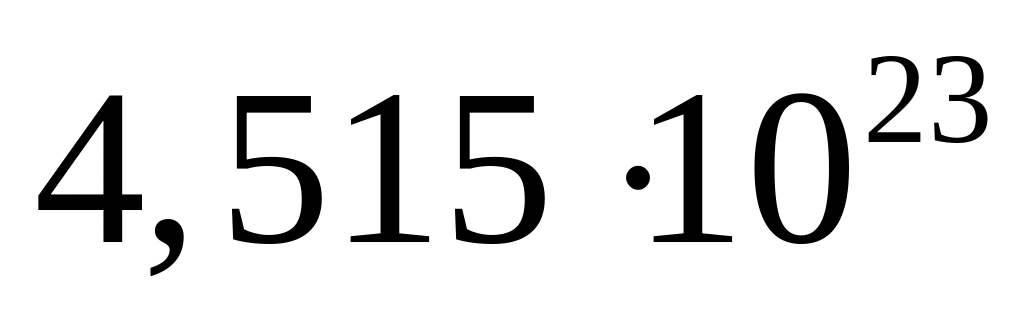 атомов алюминия?
атомов алюминия?Сколько атомов алюминия содержится в 9 г метанида (карбида) алюминия?
 1
моль 4 моль
144 г/моль
1
моль 4 моль
144 г/моль
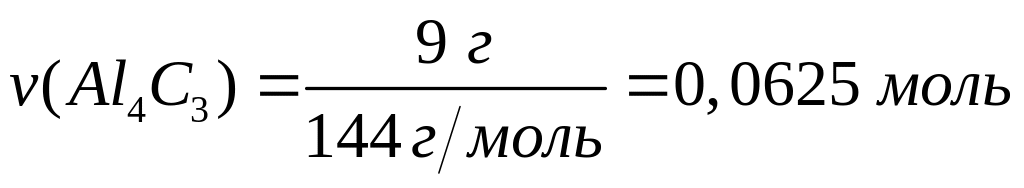

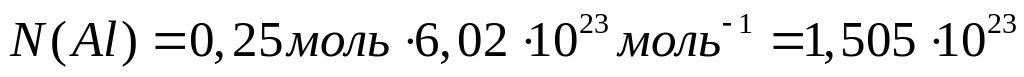 Решите:
Сколько
атомов магния содержится в 10 г карбида
магния (Mg2C3)?
Решите:
Сколько
атомов магния содержится в 10 г карбида
магния (Mg2C3)?Вычислите массовую долю алюминия в смеси, содержащей 0,16 моль хлорида алюминия и 0,07 моль сульфата алюминия. 0,16 моль 0,16 моль 0,07 моль 0,14 моль
 1
моль 1 моль 1 моль 2 моль
133,5
г/моль 27 г/моль 342 г/моль
1
моль 1 моль 1 моль 2 моль
133,5
г/моль 27 г/моль 342 г/моль
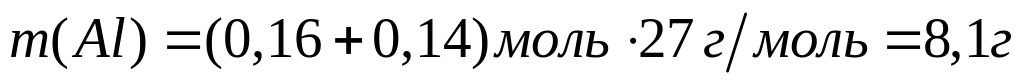
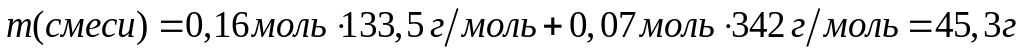
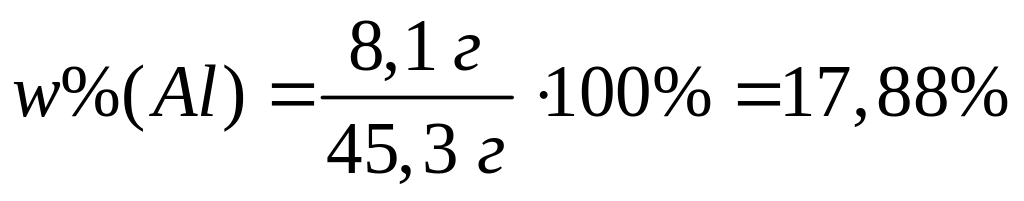 Решите:
Вычислите
массовую долю магния в смеси, содержащей
0,25 моль сульфата магния и 0,075 моль
ортофосфата магния.
Решите:
Вычислите
массовую долю магния в смеси, содержащей
0,25 моль сульфата магния и 0,075 моль
ортофосфата магния.При взаимодействии 3 г сульфида алюминия и 4,32 г карбида алюминия с разбавленной соляной кислотой выделяется смесь газов (н.у.). Вычислите молярную массу смеси газов, плотность смеси газов, относительную плотность смеси газов по водороду, объемные и массовые доли газов в смеси.
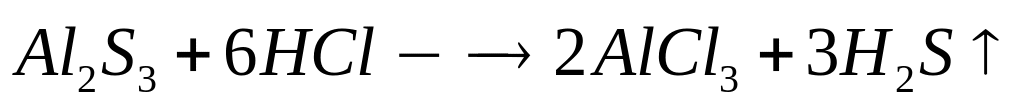 1
моль 3 моль
150 г/моль 34
г/моль
1
моль 3 моль
150 г/моль 34
г/моль
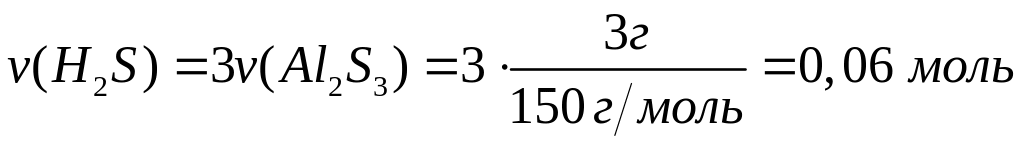
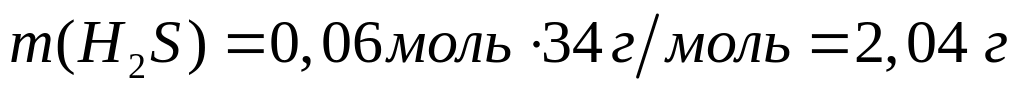
 1
моль 3 моль
144 г/моль 16
г/моль
1
моль 3 моль
144 г/моль 16
г/моль

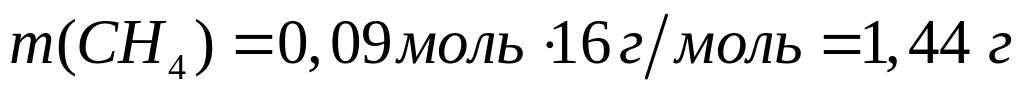
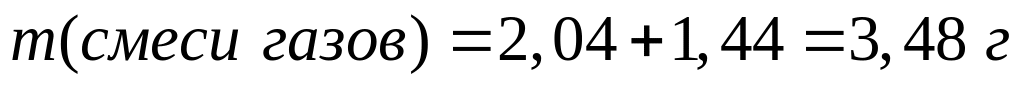
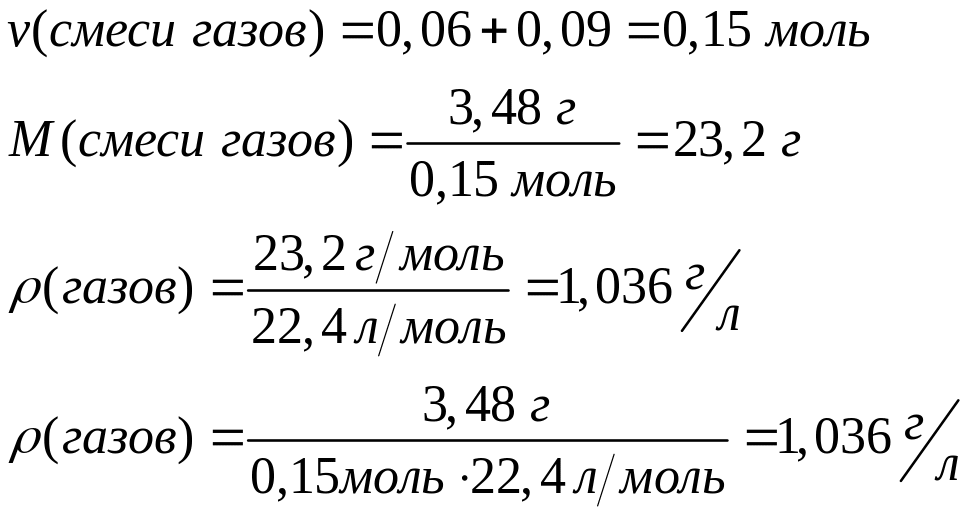
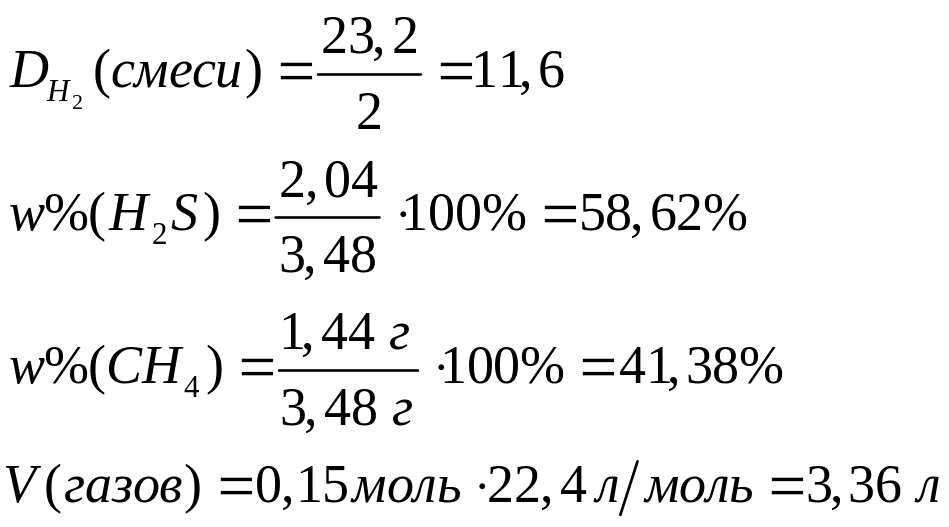
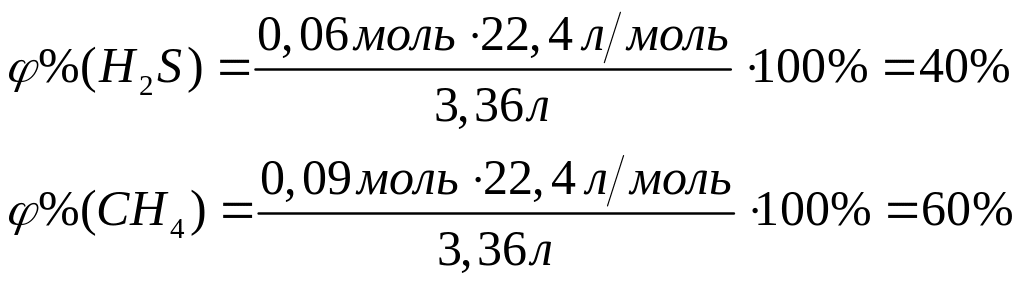
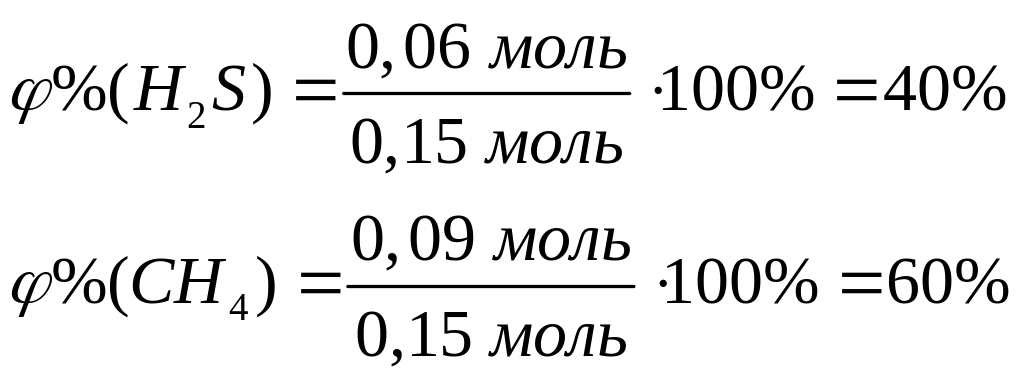
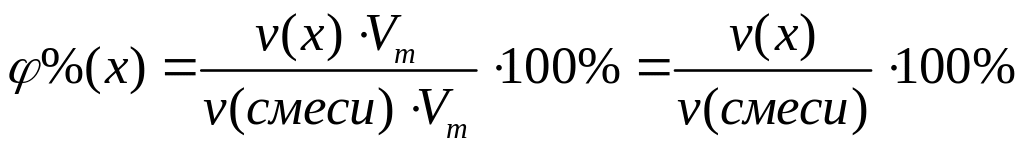 Решите:
При
взаимодействии 4,2 г карбоната магния
и 5,6 г сульфида магния с разбавленной
соляной кислотой выделяется смесь
газов (н.у.). Вычислите молярную массу
смеси газов, плотность смеси газов,
относительную плотность смеси газов
по водороду, объемные и массовые доли
газов в смеси.
Решите:
При
взаимодействии 4,2 г карбоната магния
и 5,6 г сульфида магния с разбавленной
соляной кислотой выделяется смесь
газов (н.у.). Вычислите молярную массу
смеси газов, плотность смеси газов,
относительную плотность смеси газов
по водороду, объемные и массовые доли
газов в смеси.Какое количество вещества алюминия вступило в реакцию с аммиаком при нагревании, если суммарная масса продуктов реакции равна 5,5 г? х моль х моль 1,5х моль
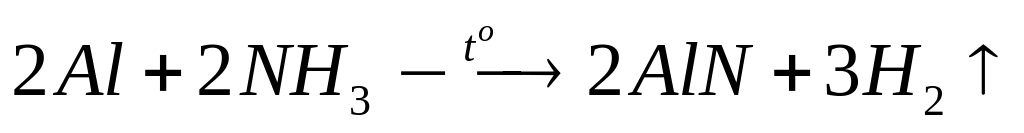 2
моль 2 моль 3 моль
27 г/моль
41 г/моль 2 г/моль
2
моль 2 моль 3 моль
27 г/моль
41 г/моль 2 г/моль

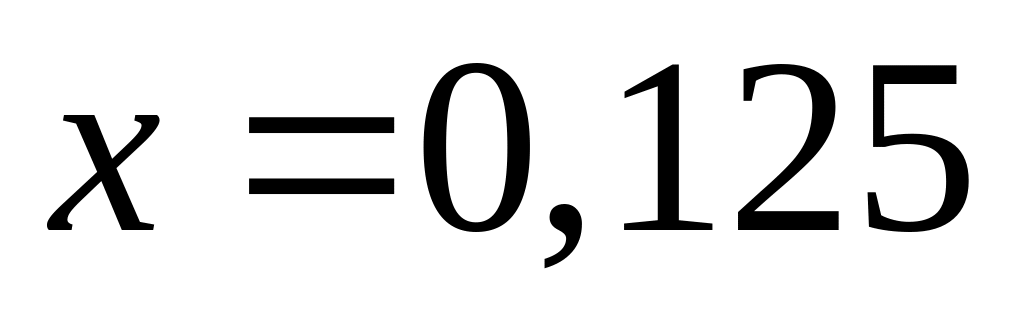
 Решите:
Какое
количество вещества магния вступило
в реакцию с аммиаком при нагревании,
если суммарная масса продуктов реакции
равна 15,9 г?
Решите:
Какое
количество вещества магния вступило
в реакцию с аммиаком при нагревании,
если суммарная масса продуктов реакции
равна 15,9 г?Молярное соотношение хлорида алюминия и гидросульфата натрия в смеси равно 1:3, а общее число атомов равно
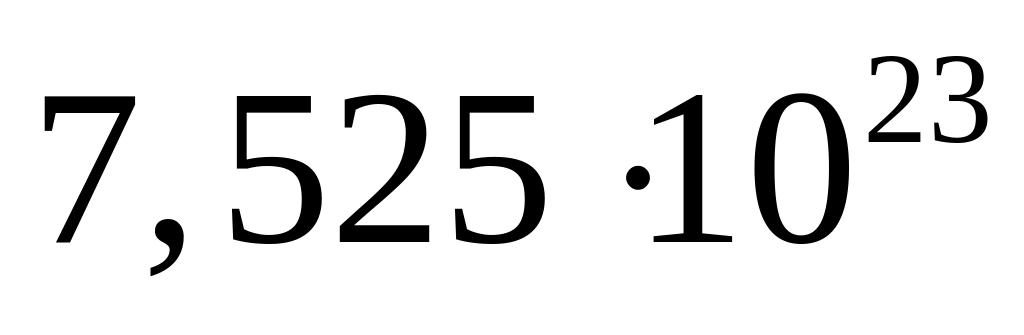 .
Вычислите количества веществ в
смеси.
.
Вычислите количества веществ в
смеси.
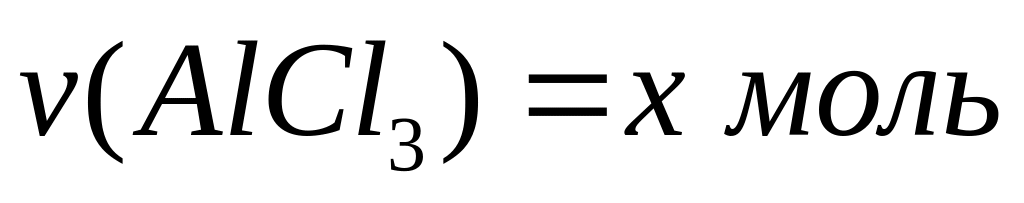 ,
, 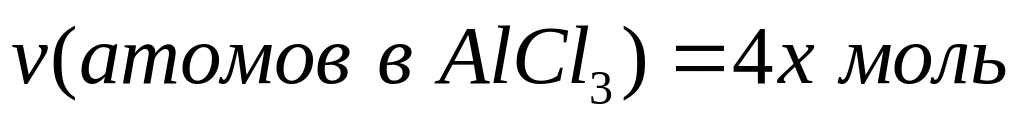
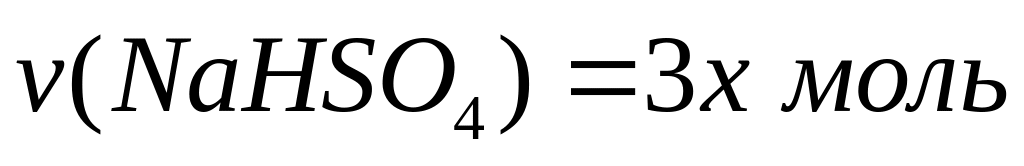 ,
, 
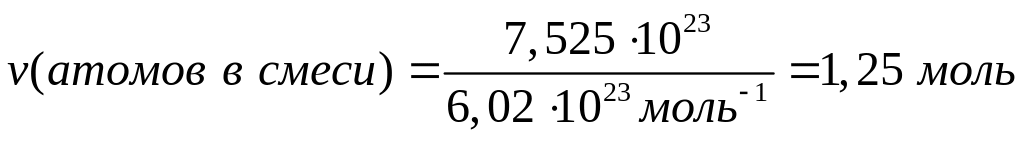
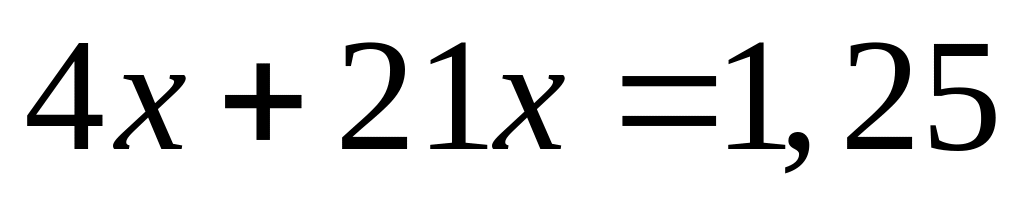
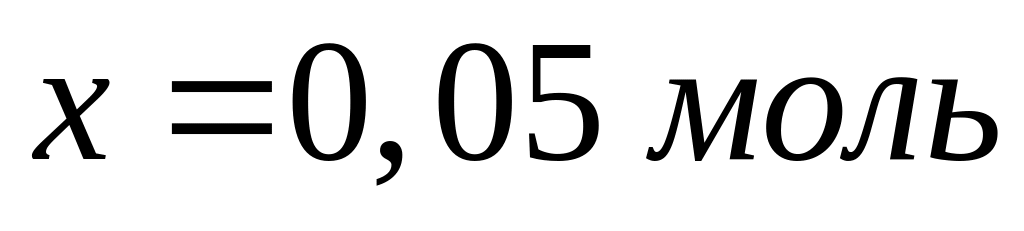

 Решите:
Молярное
соотношение сульфата магния и
дигидроортофосфата натрия в смеси
равно 1:2, а общее число атомов равно
Решите:
Молярное
соотношение сульфата магния и
дигидроортофосфата натрия в смеси
равно 1:2, а общее число атомов равно
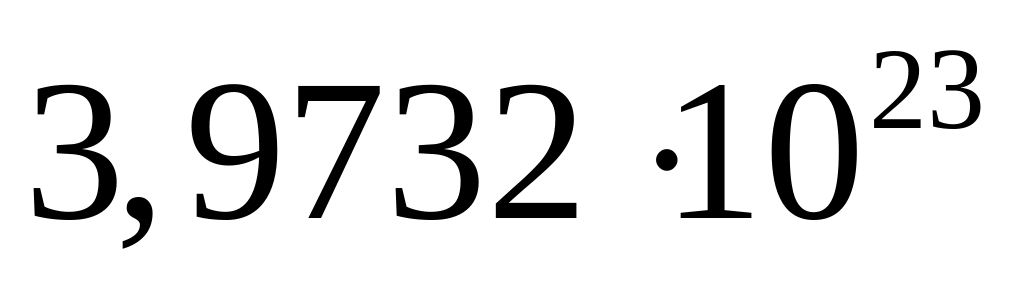 .
Вычислите количества веществ в смеси.
.
Вычислите количества веществ в смеси.Смесь сульфата магния и сульфата алюминия, в которой число атомов кислорода равно числу Авогадро, а число атомов магния составляет 25% от числа атомов серы, растворили в воде. К полученному раствору добавили избыток раствора гидроксида калия. Вычислите массу образовавшегося осадка. х моль х моль 4х моль у моль 3у моль 12у моль
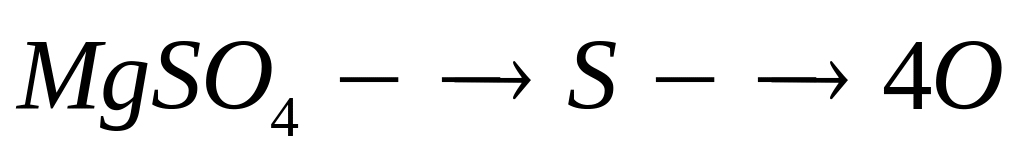
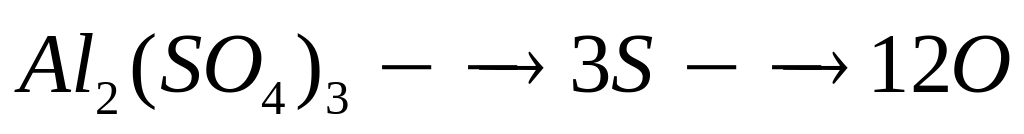 1
моль 1 моль 4 моль 1 моль 3 моль
12 моль
1
моль 1 моль 4 моль 1 моль 3 моль
12 моль
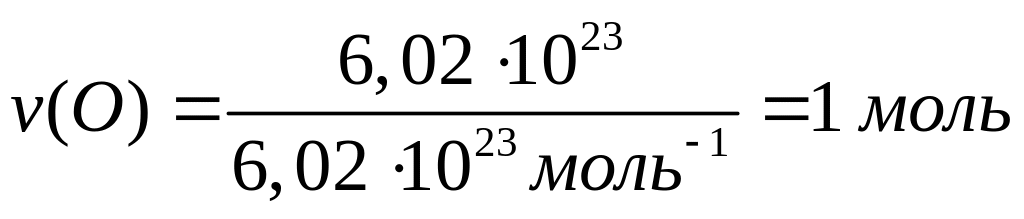
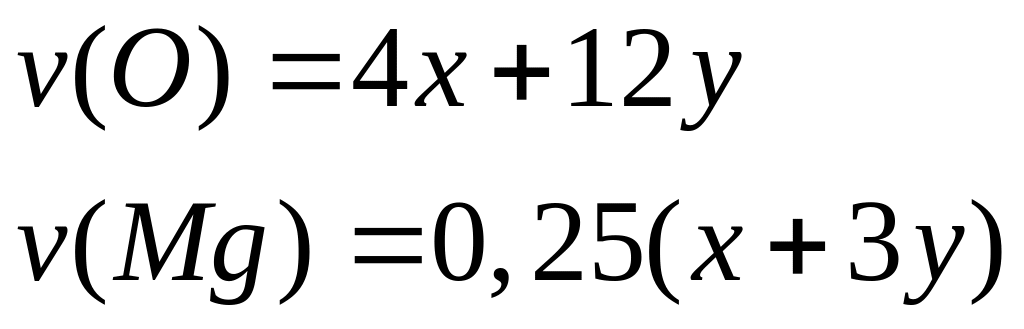
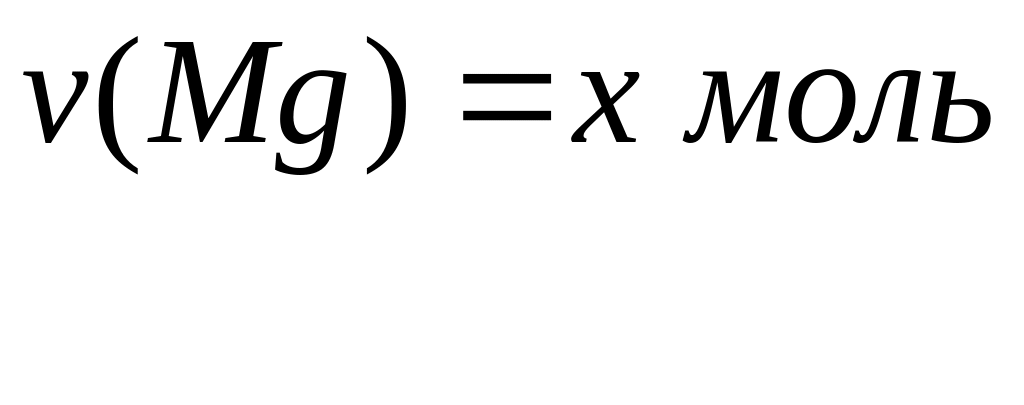

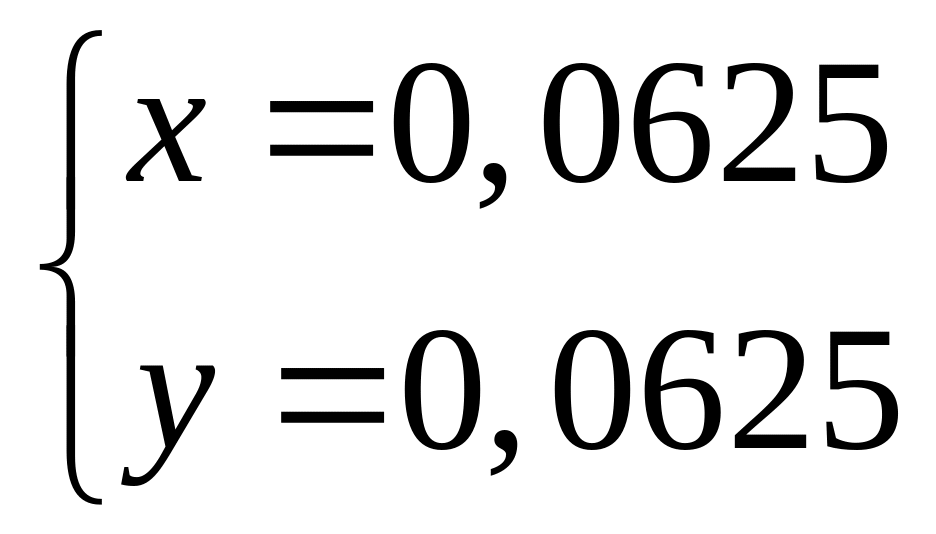
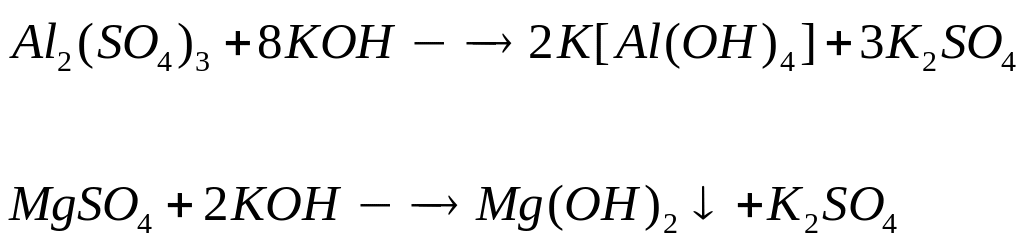 1
моль 1 моль
58
г/моль
1
моль 1 моль
58
г/моль
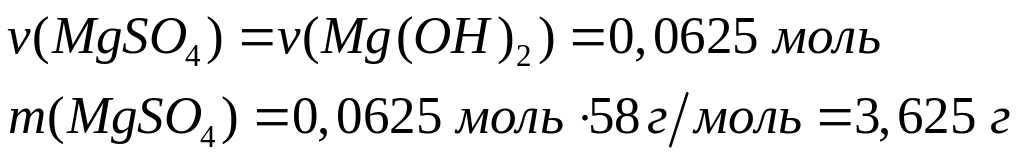 Решите:
Смесь
нитрата магния и нитрата алюминия, в
которой число атомов кислорода равно
Решите:
Смесь
нитрата магния и нитрата алюминия, в
которой число атомов кислорода равно
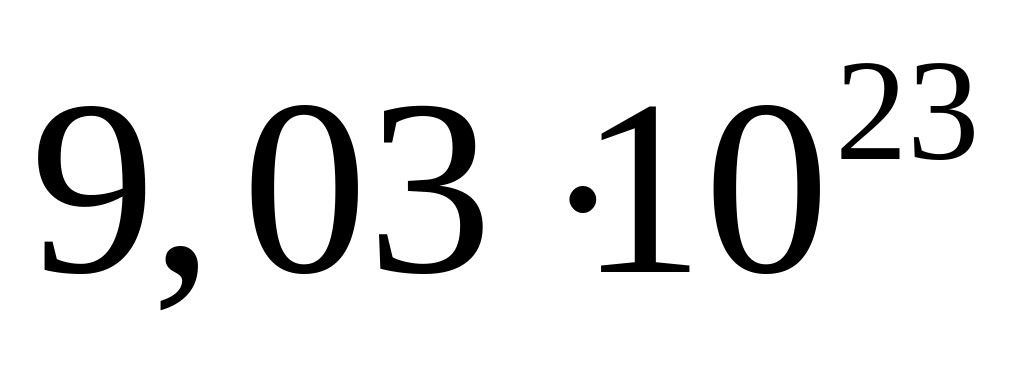 ,
а число атомов магния составляет 12,5%
от числа атомов азота, растворили в
воде. К полученному раствору добавили
избыток раствора гидроксида калия.
Вычислите массу образовавшегося осадка.
,
а число атомов магния составляет 12,5%
от числа атомов азота, растворили в
воде. К полученному раствору добавили
избыток раствора гидроксида калия.
Вычислите массу образовавшегося осадка.Два кубика одинакового размера, один из которых изготовлен из алюминия, а другой – из магния, растворили в соляной кислоте. Объем водорода, выделившегося в первом случае, оказался в 2 раза большим, чем во втором случае. Какова плотность магния, если плотность алюминия равна
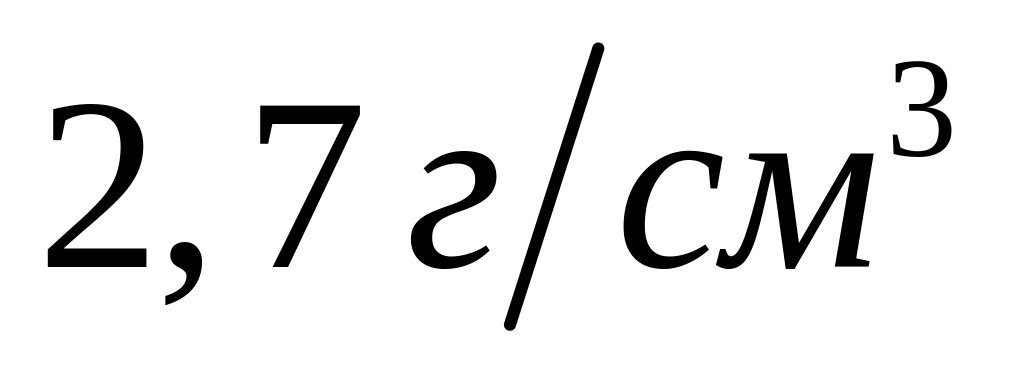 ?
?
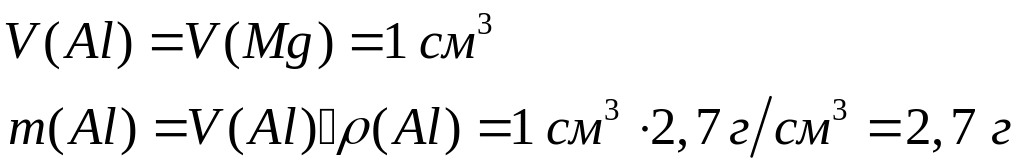
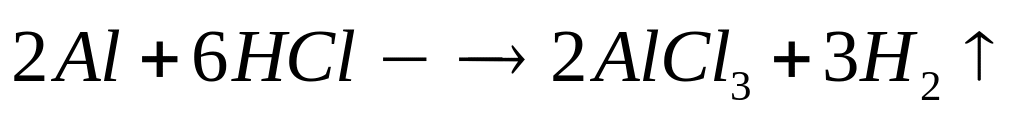 2
моль 3 моль
27 г/моль
2
моль 3 моль
27 г/моль
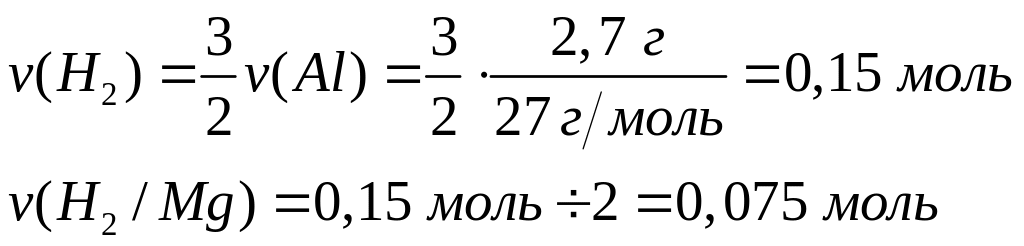
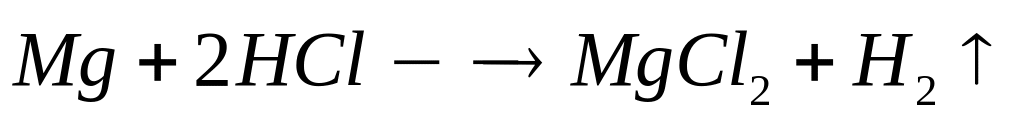 1
моль 1 моль
24 г/моль
1
моль 1 моль
24 г/моль
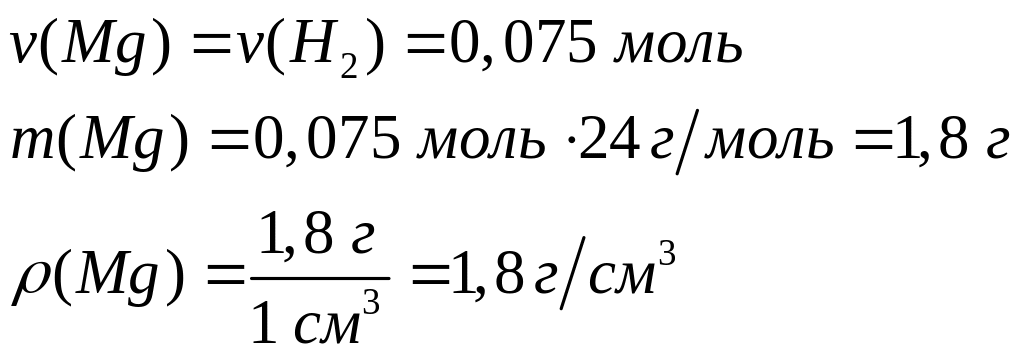 Решите:
Два
кубика одинакового размера, один из
которых изготовлен из алюминия, а другой
– из железа, растворили в соляной
кислоте. Объем водорода, выделившегося
в первом случае, оказался в 1,0668 раза
большим, чем во втором случае. Какова
плотность железа, если плотность
алюминия равна
?
Решите:
Два
кубика одинакового размера, один из
которых изготовлен из алюминия, а другой
– из железа, растворили в соляной
кислоте. Объем водорода, выделившегося
в первом случае, оказался в 1,0668 раза
большим, чем во втором случае. Какова
плотность железа, если плотность
алюминия равна
?Какой объем водорода выделяется при взаимодействии 4,86 г алюминия с раствором гидроксида натрия при 25С и давлении 102400 Па?
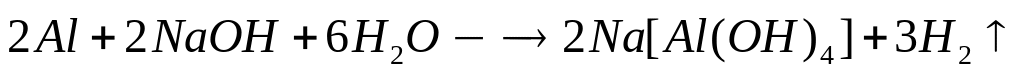 2
моль 3 моль
27 г/моль
2
моль 3 моль
27 г/моль
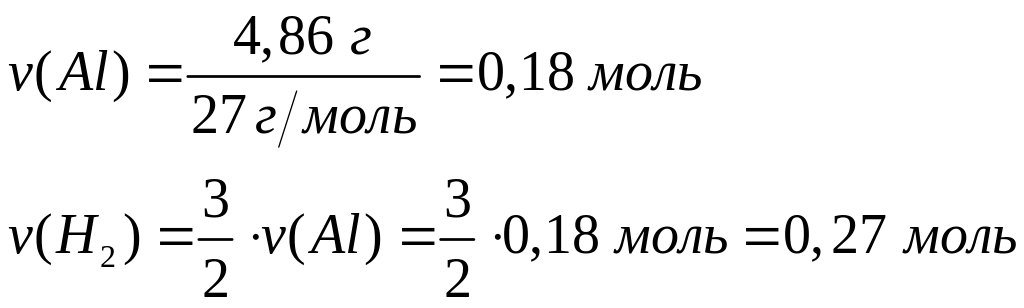
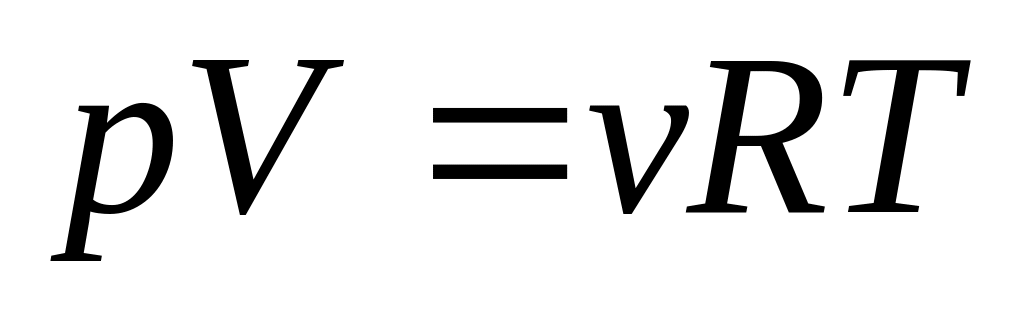
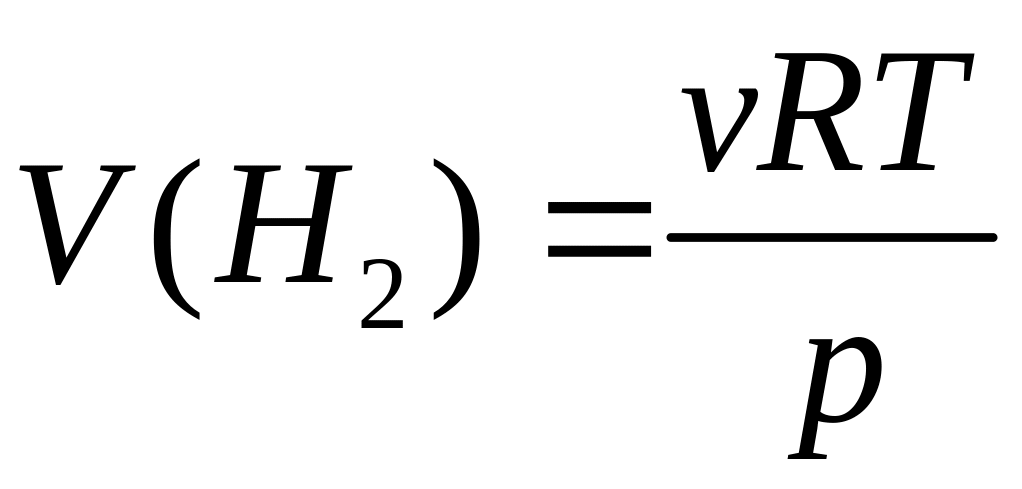
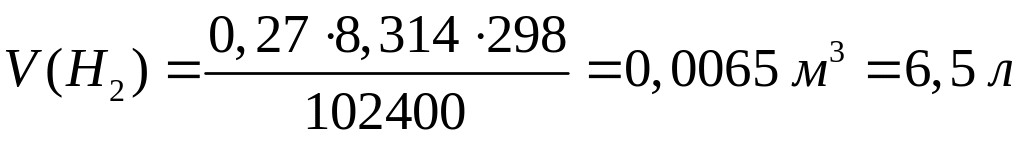 Решите:
Какой
объем водорода выделяется при
взаимодействии 5,94 г алюминия с раствором
соляной кислоты при 22С
и давлении 102300 Па?
Решите:
Какой
объем водорода выделяется при
взаимодействии 5,94 г алюминия с раствором
соляной кислоты при 22С
и давлении 102300 Па?Сколько атомов алюминия содержится в 1 г алюминиевой бронзы, содержащей 10% алюминия?
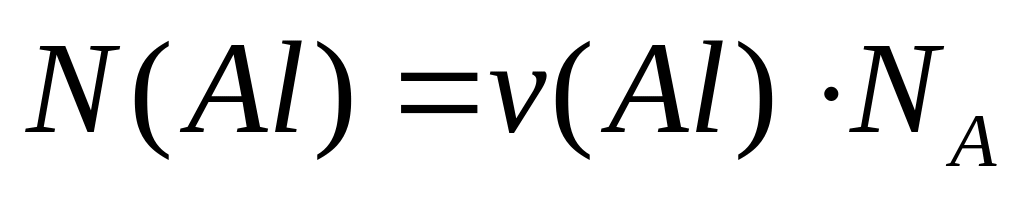
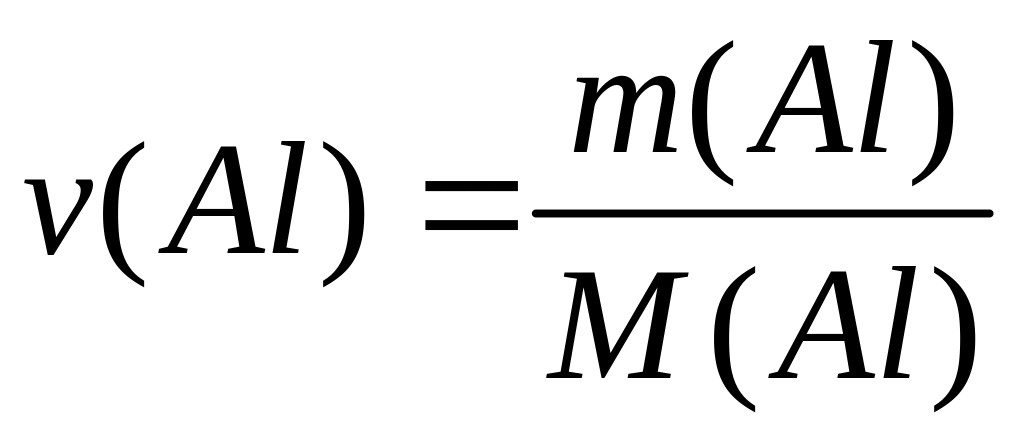
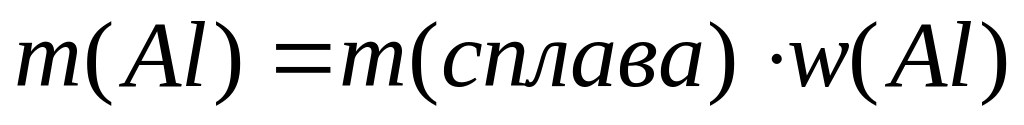
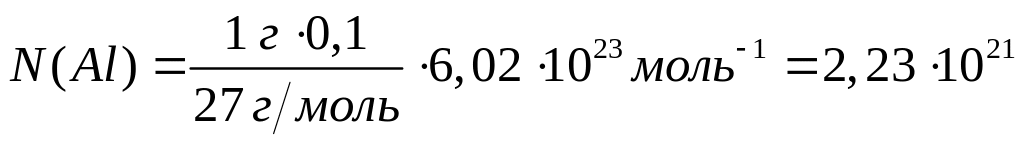 Решите:
Сколько атомов алюминия
содержится в 5 г дуралюмина (люраль или
дюралюминий), содержащего 90% алюминия?
Решите:
Сколько атомов алюминия
содержится в 5 г дуралюмина (люраль или
дюралюминий), содержащего 90% алюминия?При взаимодействии кубика алюминия объемом 0,405 см3 с водным раствором соляной кислоты выделилось 1,3608 л газа (н.у.). Вычислите плотность алюминия. 2 моль 3 моль 7 г/моль 22,4 л/моль

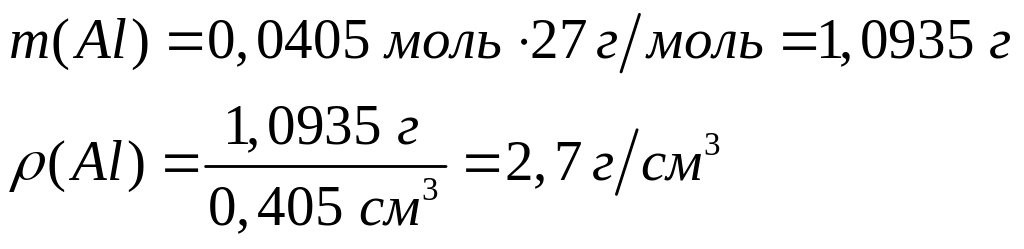 Решите:
При
взаимодействии кубика магния объемом
1,6 см3 с водным раствором соляной
кислоты выделилось 2,688 л газа (н.у.).
Вычислите плотность магния.
Решите:
При
взаимодействии кубика магния объемом
1,6 см3 с водным раствором соляной
кислоты выделилось 2,688 л газа (н.у.).
Вычислите плотность магния.Сколько по массе алюминия вступит в реакцию с 9,6 г смеси
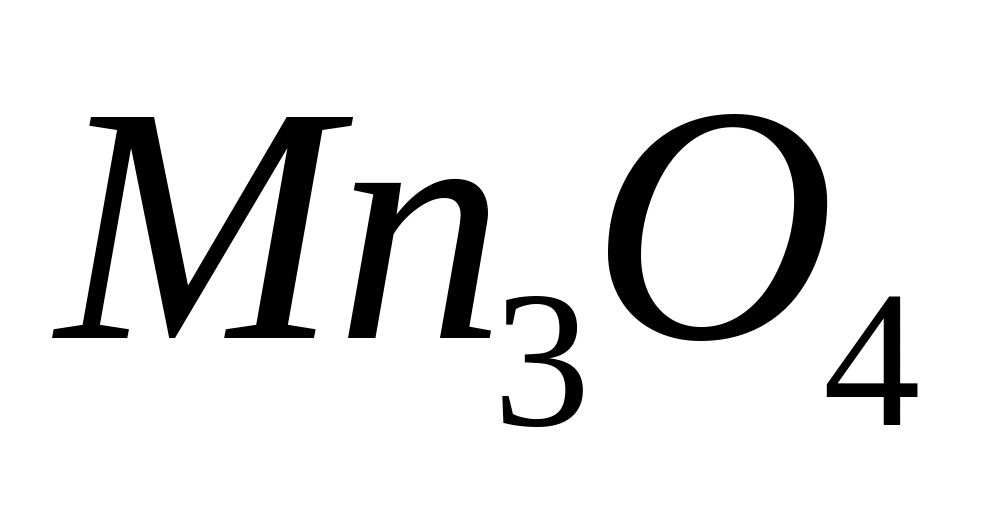 и
и
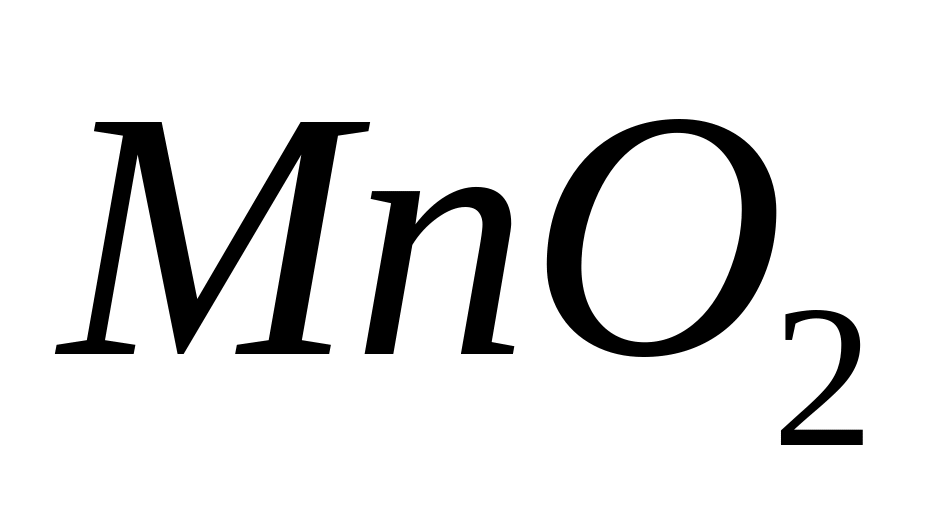 ,
содержащей 75% марганца?
,
содержащей 75% марганца?
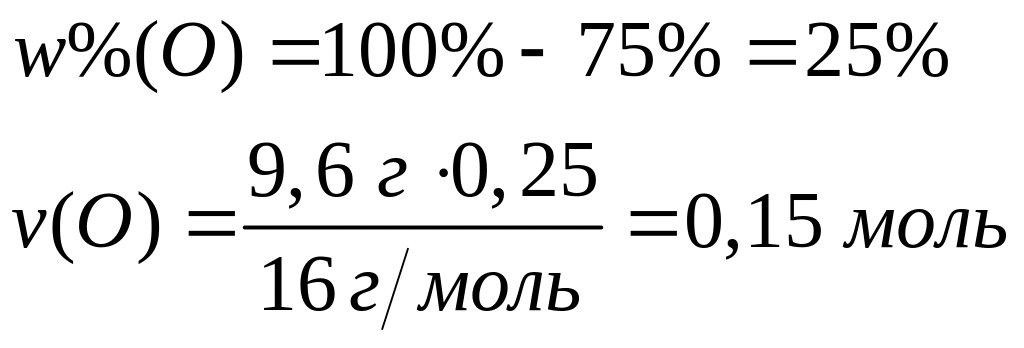
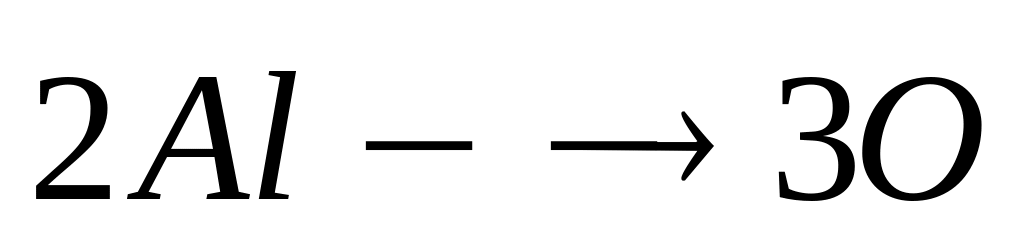
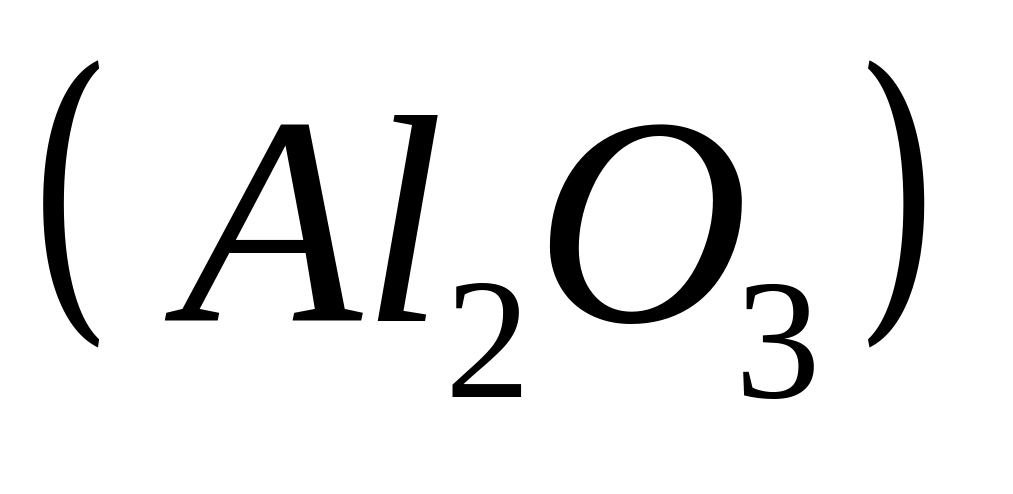 2
моль 3 моль
27 г/моль
2
моль 3 моль
27 г/моль
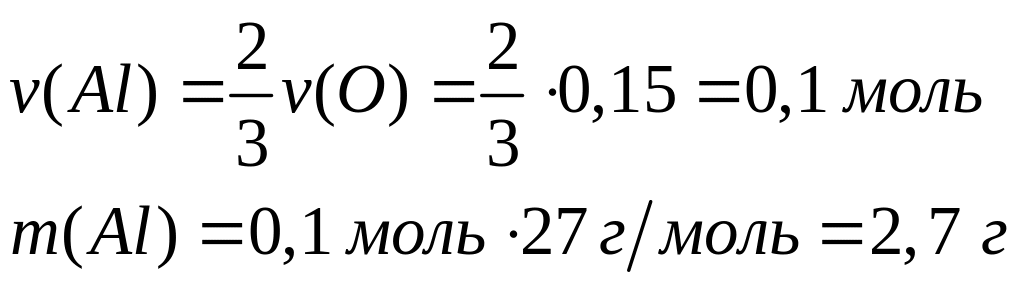 Решите:
Сколько
по массе алюминия вступит в реакцию с
23,6 г смеси Fe2O3
и Fe3O4,
содержащей 71,18644% железа?
Решите:
Сколько
по массе алюминия вступит в реакцию с
23,6 г смеси Fe2O3
и Fe3O4,
содержащей 71,18644% железа?Массовая доля атомарного кислорода в смеси оксида и сульфата алюминия равна 50,560%. Вычислите массовые доли компонентов в смеси. х моль 3х моль у моль 12у моль
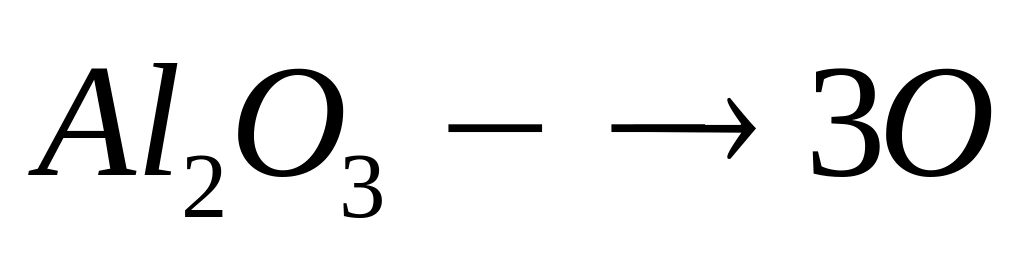
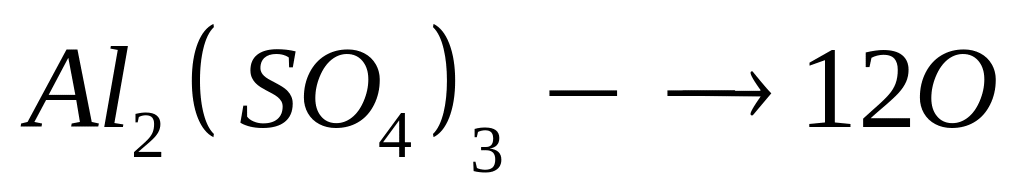 1
моль 3 моль 1 моль 12 моль
102
г/моль 16 г/моль 342 г/моль 16 г/моль
I
способ
1
моль 3 моль 1 моль 12 моль
102
г/моль 16 г/моль 342 г/моль 16 г/моль
I
способ
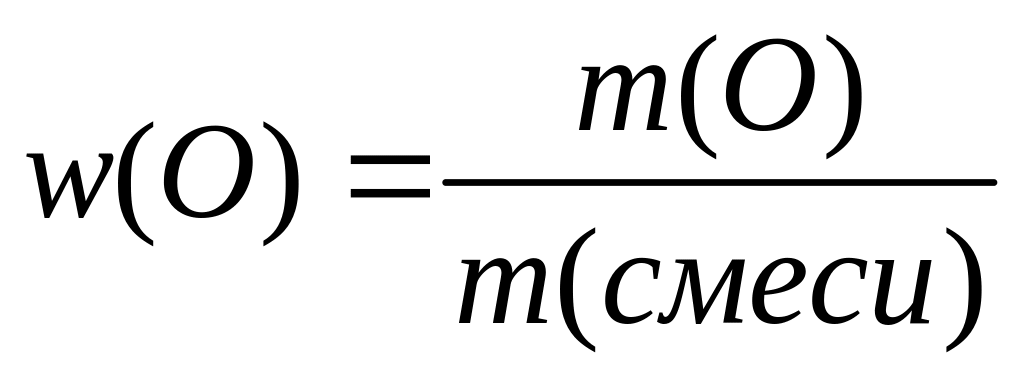
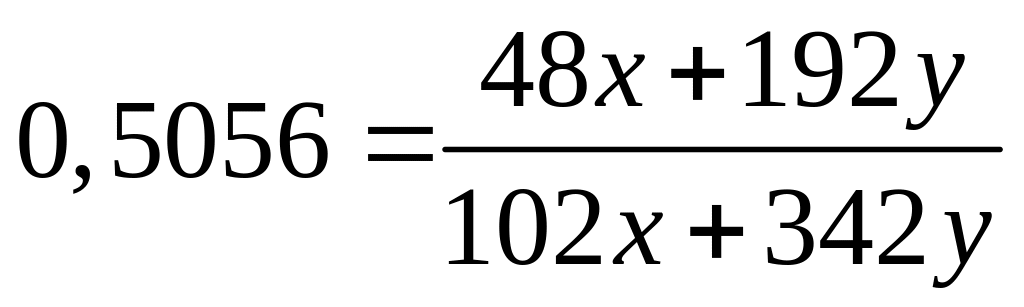
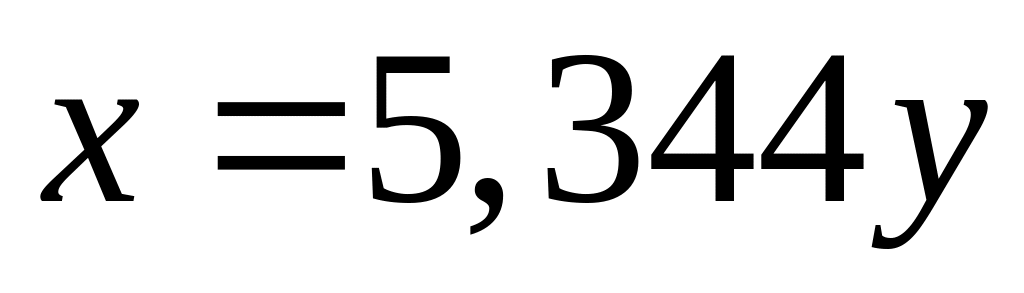
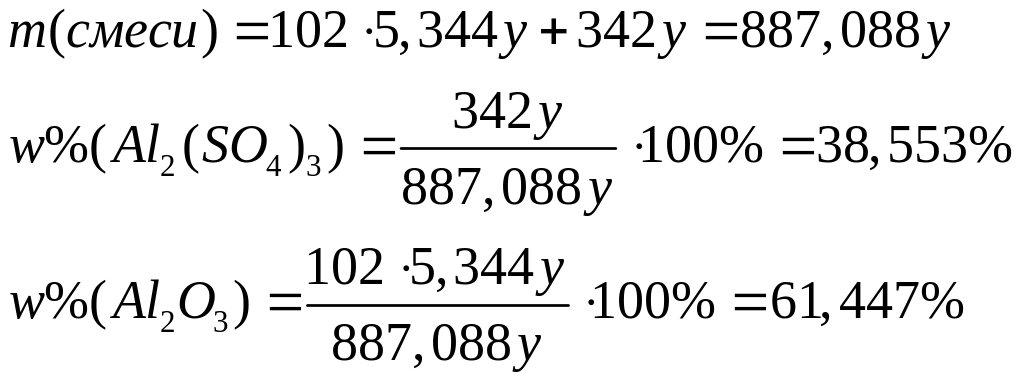 II
способ
II
способ
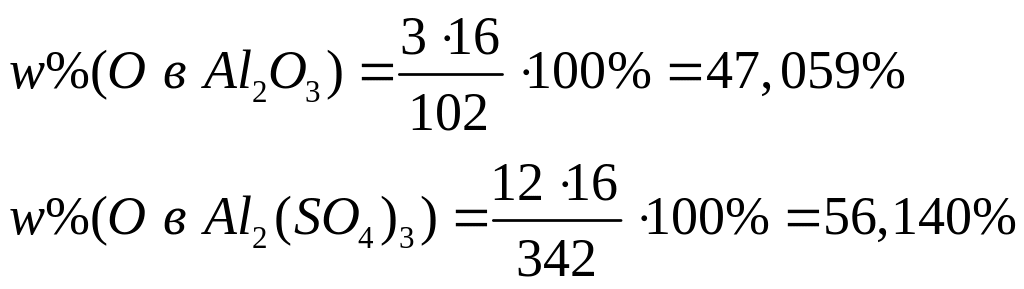
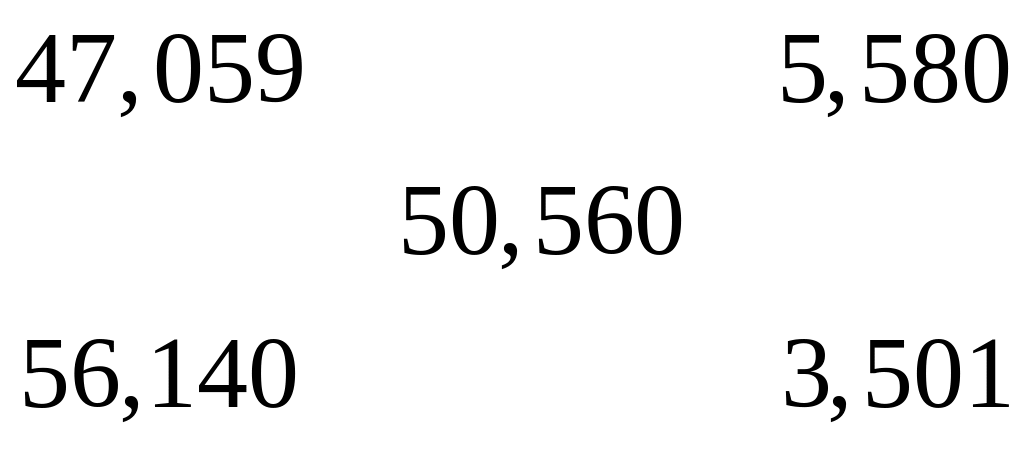
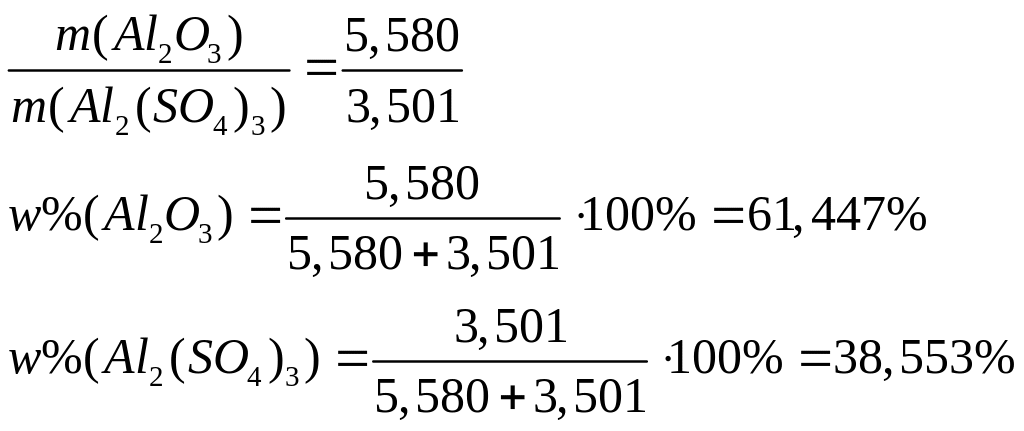 Решите:
а.
Массовая доля атомарного кислорода в
смеси оксида и нитрата алюминия равна
53,112%. Вычислите массовые доли компонентов
в смеси.
б. Массовая доля атомарного
алюминия в смеси сульфата и нитрата
алюминия равна 17,308%. Вычислите массовые
доли компонентов в смеси.
Решите:
а.
Массовая доля атомарного кислорода в
смеси оксида и нитрата алюминия равна
53,112%. Вычислите массовые доли компонентов
в смеси.
б. Массовая доля атомарного
алюминия в смеси сульфата и нитрата
алюминия равна 17,308%. Вычислите массовые
доли компонентов в смеси.С
 месь
хлорида и бромида алюминия массой
11,748 г обработали избытком хлора при
нагревании. Масса твердого остатка
после реакции составила 8,544 г. Вычислите
массовые доли компонентов в исходной
смеси.
х моль 1,5х моль х моль 1,5х
моль
месь
хлорида и бромида алюминия массой
11,748 г обработали избытком хлора при
нагревании. Масса твердого остатка
после реакции составила 8,544 г. Вычислите
массовые доли компонентов в исходной
смеси.
х моль 1,5х моль х моль 1,5х
моль
 2
моль 3 моль 2 моль 3 моль
267
г/моль 71 г/моль 133,5 г/моль 160 г/моль
I
способ
2
моль 3 моль 2 моль 3 моль
267
г/моль 71 г/моль 133,5 г/моль 160 г/моль
I
способ
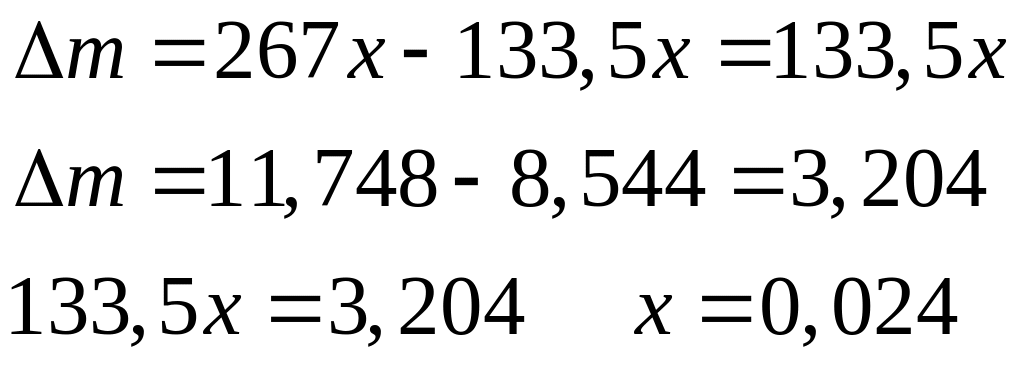
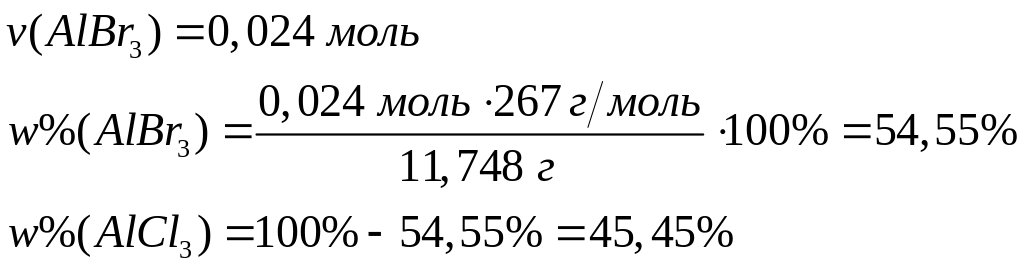 II
способ
II
способ
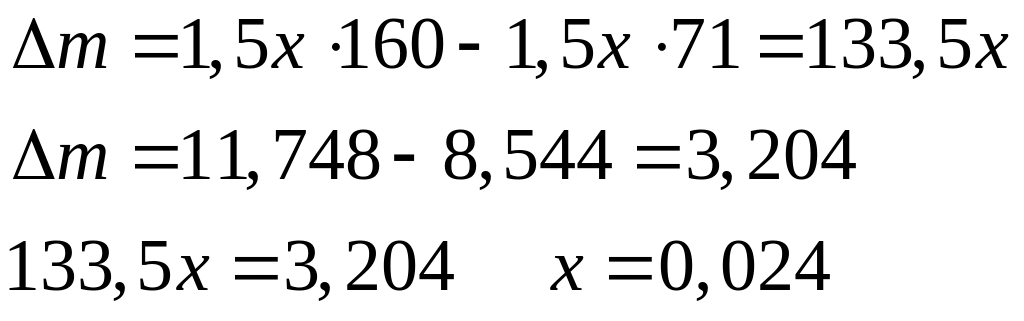 см.
способ I
III
способ
пусть
см.
способ I
III
способ
пусть
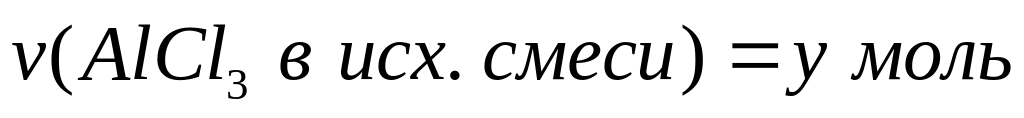
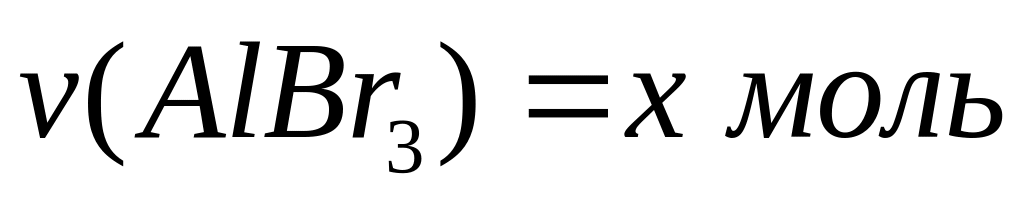
 см.
способ I
Решите:
Смесь
хлорида и иодида алюминия массой 11,46 г
обработали избытком хлора при нагревании.
Масса твердого остатка после реакции
составила 7,3425 г. Вычислите массовые
доли компонентов в исходной смеси.
см.
способ I
Решите:
Смесь
хлорида и иодида алюминия массой 11,46 г
обработали избытком хлора при нагревании.
Масса твердого остатка после реакции
составила 7,3425 г. Вычислите массовые
доли компонентов в исходной смеси.Смесь алюминия и оксида алюминия, содержащая 6,25% примесей, полностью прореагировала с необходимым количеством концентрированного раствора гидроксида натрия. При этом выделилось 6,72 л газа (н.у.). Через полученный раствор пропустили углекислый газ и получили осадок, который прокалили. Масса продукта прокаливания составила 12,75 г. Определите массу исходной смеси. 2 моль 3 моль 27 г/моль 22,4 л/моль
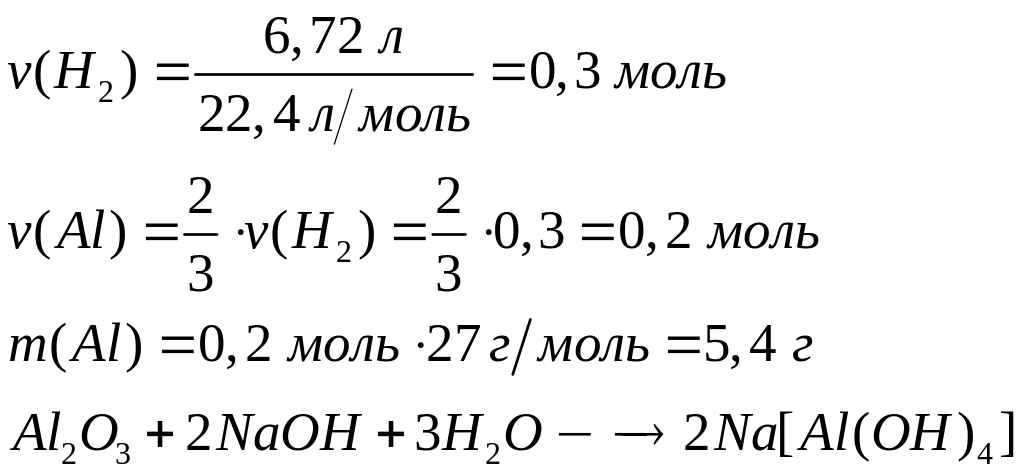 1
моль
102 г/моль
1
моль
102 г/моль
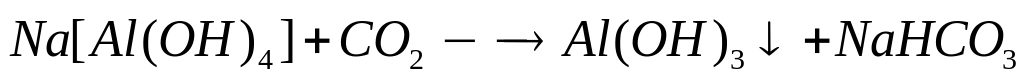 1
моль 1 моль
1
моль 1 моль
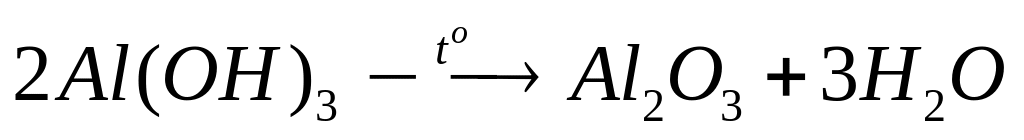 2
моль 1 моль
2
моль 1 моль
 Решите:
Смесь
алюминия и метагидроксида алюминия,
содержащая 4% примесей, полностью
прореагировала с необходимым количеством
концентрированного раствора гидроксида
натрия. При этом выделилось 6,048 л газа
(н.у.). Через полученный раствор пропустили
углекислый газ и получили осадок,
который прокалили. Масса продукта
прокаливания составила 12,24 г. Определите
массу исходной смеси.
Решите:
Смесь
алюминия и метагидроксида алюминия,
содержащая 4% примесей, полностью
прореагировала с необходимым количеством
концентрированного раствора гидроксида
натрия. При этом выделилось 6,048 л газа
(н.у.). Через полученный раствор пропустили
углекислый газ и получили осадок,
который прокалили. Масса продукта
прокаливания составила 12,24 г. Определите
массу исходной смеси.Сколько теплоты выделится при окислении кислородом 3,24 г алюминия? Теплота образования оксида алюминия равна 1675 кДж/моль.
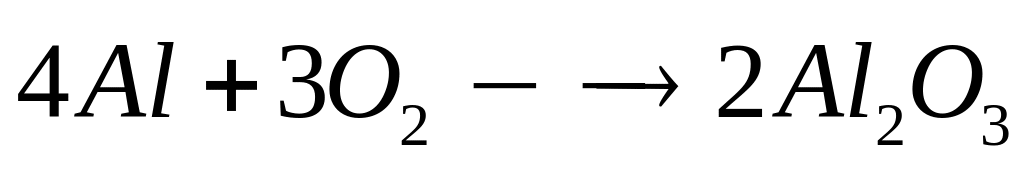 4
моль 2 моль
27 г/моль
4
моль 2 моль
27 г/моль
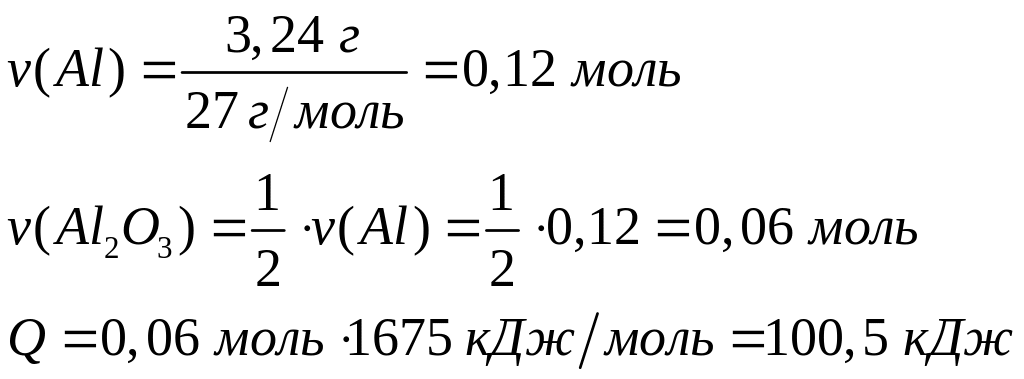 Решите:
Сколько
теплоты выделится при окислении хлором
4,32 г алюминия? Теплота образования
хлорида алюминия равна 697 кДж/моль.
Решите:
Сколько
теплоты выделится при окислении хлором
4,32 г алюминия? Теплота образования
хлорида алюминия равна 697 кДж/моль.При взаимодействии 4,32 г алюминия с необходимой массой углерода выделяется 8,36 кДж теплоты. Определите теплоту образования карбида (метанида) алюминия.
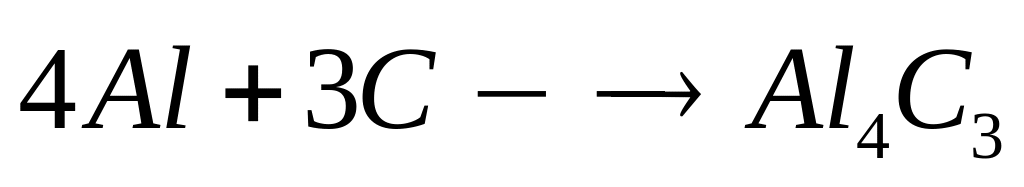 4
моль 1 моль
27 г/моль
4
моль 1 моль
27 г/моль
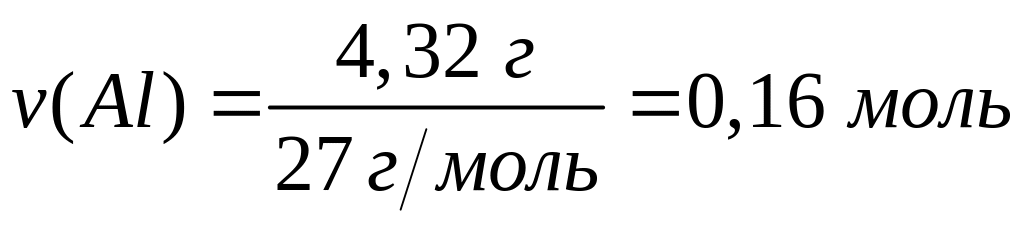
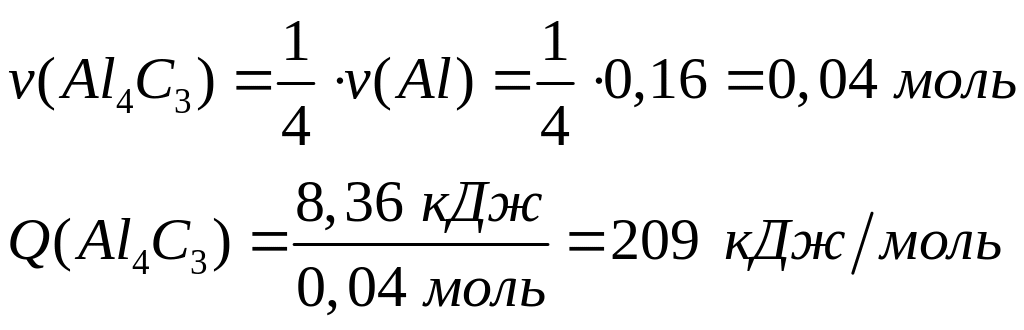 Решите:
При
взаимодействии 6,48 г алюминия с кислородом
выделяется 201 кДж теплоты. Определите
теплоту образования оксида алюминия.
Решите:
При
взаимодействии 6,48 г алюминия с кислородом
выделяется 201 кДж теплоты. Определите
теплоту образования оксида алюминия.При окислении сульфида алюминия кислородом выделяется 73,68 кДж теплоты. Какой максимальный объем 25%-го раствора гидроксида калия (=1,24 г/мл) необходим для поглощения выделившегося при окислении газа? При окислении1 моль сульфида алюминия выделяется 1842 кДж теплоты. 0,04 моль 0,12 моль
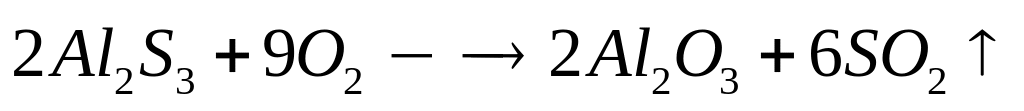 2
моль 6 моль
2
моль 6 моль

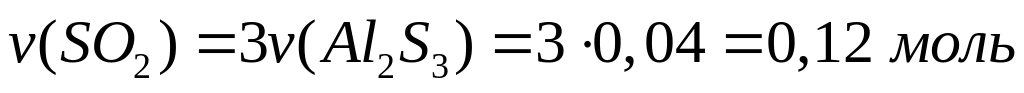
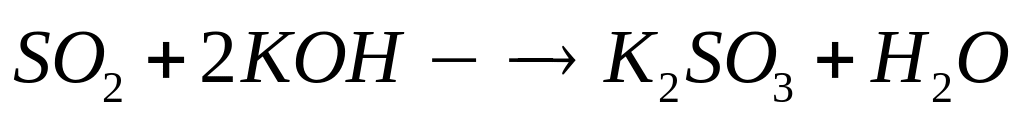 1
моль 2 моль
56 г/моль
1
моль 2 моль
56 г/моль
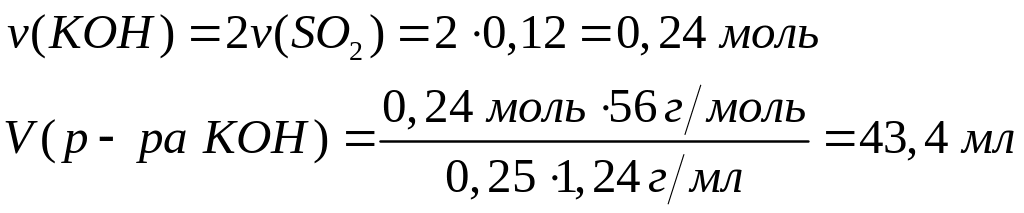 Решите:
При
окислении карбида алюминия (Al4C3)
кислородом выделяется 216,15 кДж теплоты.
Какой максимальный объем 25%-го раствора
гидроксида калия (=1,24
г/мл) необходим для поглощения
выделившегося при окислении газа? При
окислении 1 моль
карбида алюминия выделяется 4323
кДж теплоты.
Решите:
При
окислении карбида алюминия (Al4C3)
кислородом выделяется 216,15 кДж теплоты.
Какой максимальный объем 25%-го раствора
гидроксида калия (=1,24
г/мл) необходим для поглощения
выделившегося при окислении газа? При
окислении 1 моль
карбида алюминия выделяется 4323
кДж теплоты.Какой объем хлора вступит в реакцию с алюминием, если при этом выделилось 55,76 кДж теплоты? Теплота образования хлорида алюминия из алюминия и хлора равна 697 кДж/моль.
 2
моль 3 моль 2 моль
22,4
л/моль
2
моль 3 моль 2 моль
22,4
л/моль
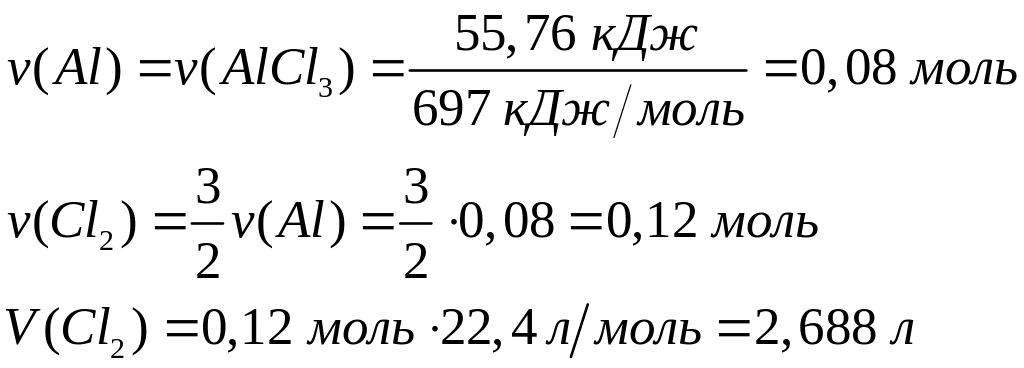 Решите:
Какой
объем брома (=3,12
г/мл) вступит в реакцию с алюминием,
если при этом выделилось 41,12 кДж теплоты?
Теплота образования бромида алюминия
из алюминия и брома равна 514 кДж/моль.
Решите:
Какой
объем брома (=3,12
г/мл) вступит в реакцию с алюминием,
если при этом выделилось 41,12 кДж теплоты?
Теплота образования бромида алюминия
из алюминия и брома равна 514 кДж/моль.При взаимодействии 3,6 г смеси алюминия и магния с хлором выделяется 94,16 кДж теплоты. Определите массовые доли металлов в смеси. Теплоты образования хлоридов алюминия и магния соответственно равны 697 кДж/моль и 640 кДж/моль. х моль х моль
 2
моль 2 моль
27 г/моль
у моль
у моль
2
моль 2 моль
27 г/моль
у моль
у моль
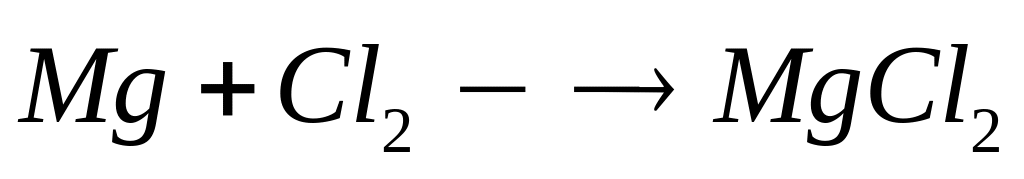 1
моль 1 моль
24 г/моль
1
моль 1 моль
24 г/моль
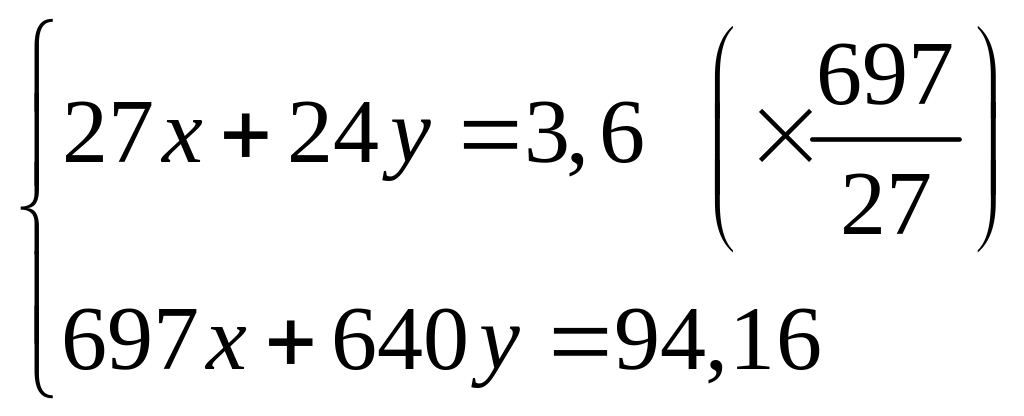
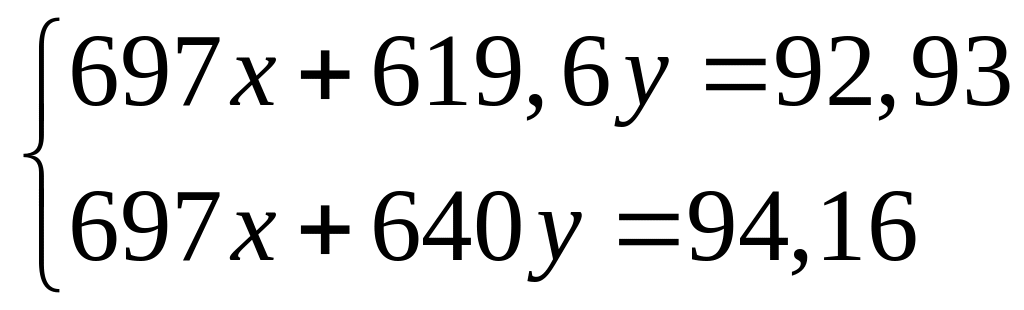

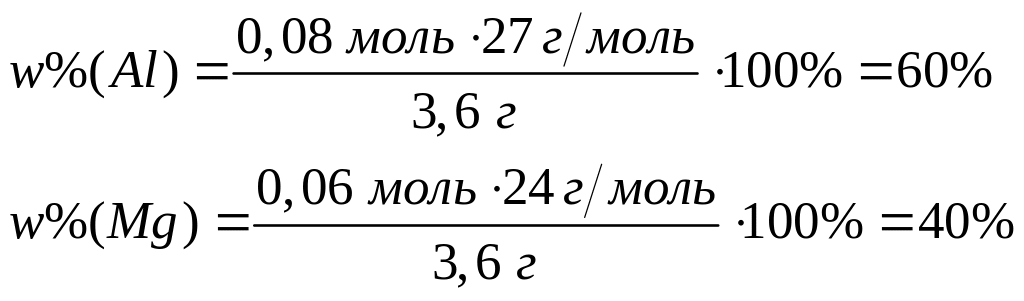 Решите:
При
взаимодействии 6,6 г смеси алюминия и
железа с хлором выделяется 77,7 кДж
теплоты. Определите массовые доли
металлов в смеси. Теплоты образования
хлоридов алюминия и железа соответственно
равны 514 кДж/моль и 267 кДж/моль.
Решите:
При
взаимодействии 6,6 г смеси алюминия и
железа с хлором выделяется 77,7 кДж
теплоты. Определите массовые доли
металлов в смеси. Теплоты образования
хлоридов алюминия и железа соответственно
равны 514 кДж/моль и 267 кДж/моль.При взаимодействии 4,98 г алюминия и цинка с хлором, находящихся в молярном соотношении 2:3, выделяется 52,78 кДж теплоты. Определите теплоту образования хлорида цинка, если теплота образования хлорида алюминия равна 697 кДж/моль.
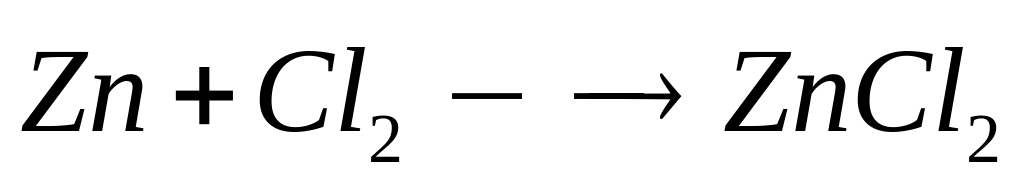 2
моль 2 моль 1 моль 1 моль
27
г/моль 65 г/моль
2
моль 2 моль 1 моль 1 моль
27
г/моль 65 г/моль
 ,
,
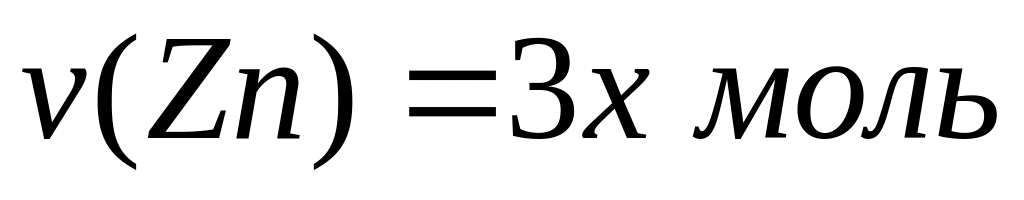
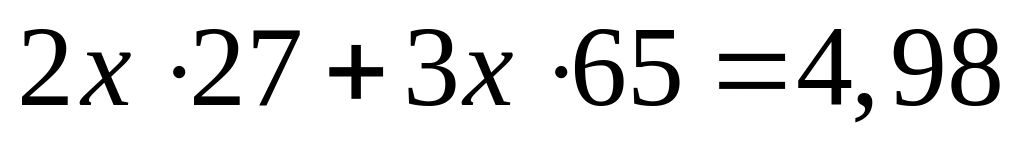
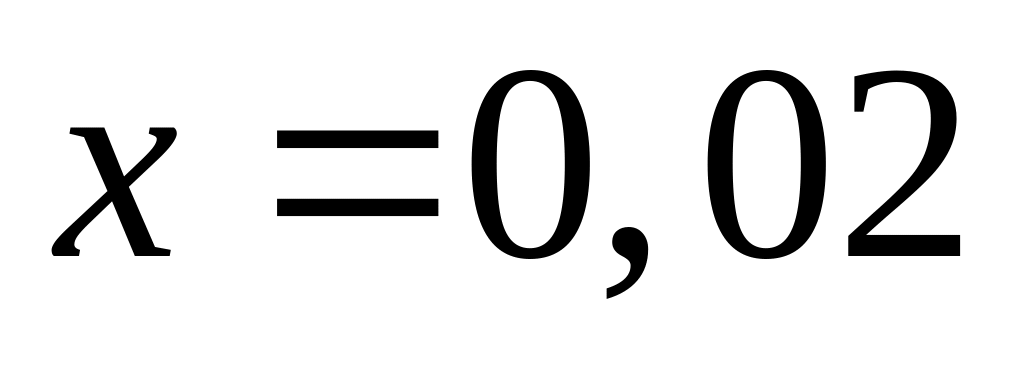
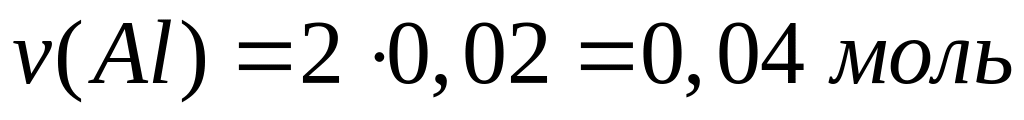
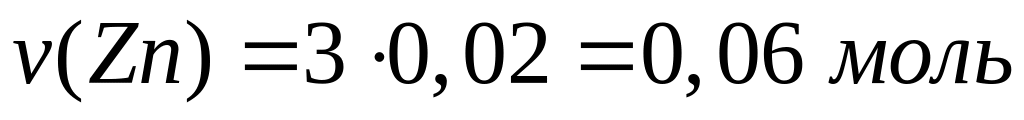
 Решите:
При
взаимодействии 9 г алюминия и магния с
фтором, находящихся в молярном соотношении
1:2, выделяется 450,96 кДж теплоты. Определите
теплоту образования фторида алюминия,
если теплота образования фторида магния
равна 1124 кДж/моль.
Решите:
При
взаимодействии 9 г алюминия и магния с
фтором, находящихся в молярном соотношении
1:2, выделяется 450,96 кДж теплоты. Определите
теплоту образования фторида алюминия,
если теплота образования фторида магния
равна 1124 кДж/моль.Для реакции алюминия с углеродом термохимическое уравнение имеет вид
 Сколько
теплоты выделится при взаимодействии
4,86 г алюминия с необходимым количеством
углерода.
4
моль 1 моль
27 г/моль
Сколько
теплоты выделится при взаимодействии
4,86 г алюминия с необходимым количеством
углерода.
4
моль 1 моль
27 г/моль
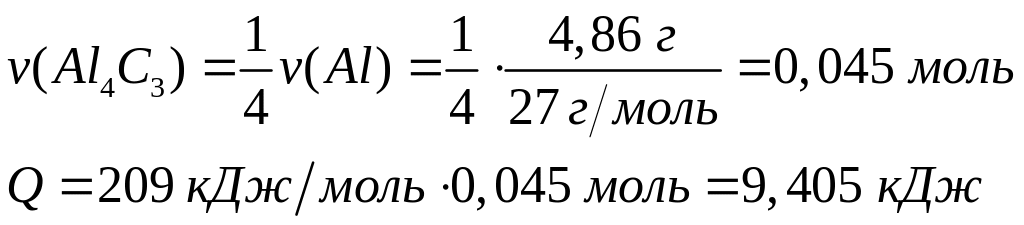 Решите:
Для
реакции алюминия с серой термохимическое
уравнение имеет вид
Решите:
Для
реакции алюминия с серой термохимическое
уравнение имеет вид
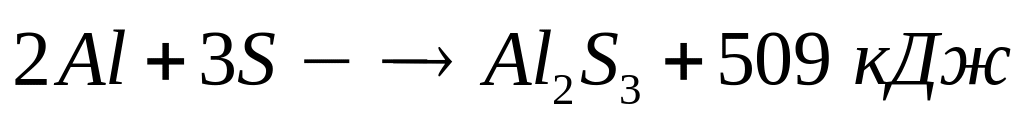 Сколько
теплоты выделится при взаимодействии
8,64 г алюминия с необходимым количеством
серы.
Сколько
теплоты выделится при взаимодействии
8,64 г алюминия с необходимым количеством
серы.Для полного разложения некоторого количества гидроксида алюминия потребовалось 38 кДж теплоты. Полученный оксид растворен в 82 мл 20%-го раствора гидроксида натрия (=1,22 г/мл). Рассчитайте массовые доли веществ в полученном растворе. Тепловой эффект разложения гидроксида алюминия равен -95 кДж/моль.
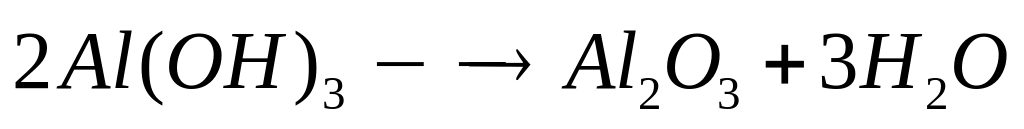 2
моль 1 моль
2
моль 1 моль
 0,2
моль 0,4 моль 0,4 моль
0,2
моль 0,4 моль 0,4 моль
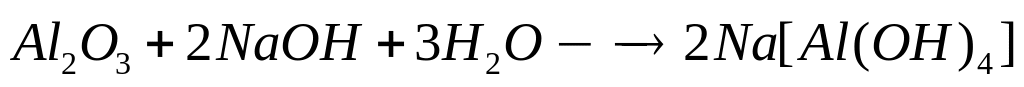 1
моль 2 моль 2 моль
102
г/моль 40 г/моль 118
г/моль
1
моль 2 моль 2 моль
102
г/моль 40 г/моль 118
г/моль
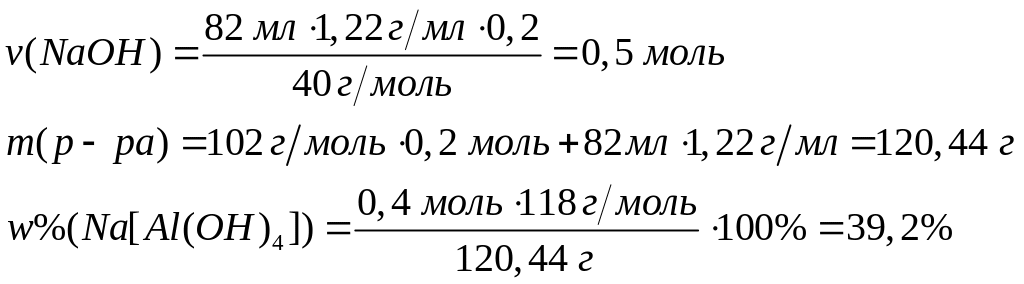
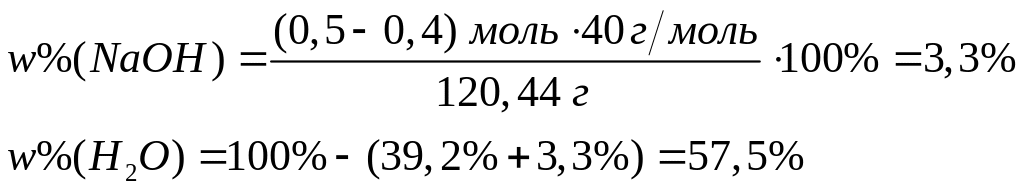 Решите:
Для
полного разложения некоторого количества
гидроксида алюминия потребовалось
33,25 кДж теплоты. Полученный оксид
растворен в 62,5 мл 25%-го раствора гидроксида
натрия (=1,28 г/мл).
Рассчитайте массовые доли веществ в
полученном растворе. Тепловой эффект
разложения гидроксида алюминия равен
-95 кДж/моль.
Решите:
Для
полного разложения некоторого количества
гидроксида алюминия потребовалось
33,25 кДж теплоты. Полученный оксид
растворен в 62,5 мл 25%-го раствора гидроксида
натрия (=1,28 г/мл).
Рассчитайте массовые доли веществ в
полученном растворе. Тепловой эффект
разложения гидроксида алюминия равен
-95 кДж/моль.При окислении смеси алюминия и магния кислородом выделяется 98,25 кДж теплоты. Продукты окисления полностью реагируют с 96,1 мл 20%-го раствора азотной кислоты (=1,115 г/мл). Вычислите массовые доли нитратов в полученном растворе. Теплоты образования оксидов алюминия и магния соответственно равны 1675 кДж/моль и 600 кДж/моль. х моль 0,5х моль у моль у моль
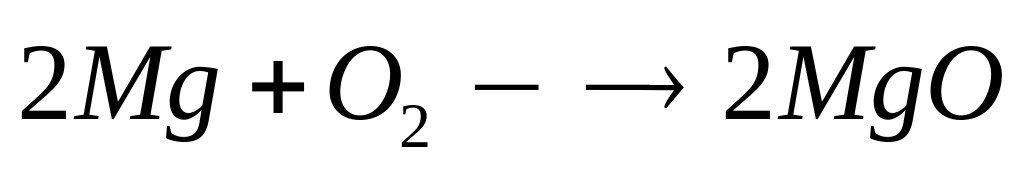 4
моль 2 моль 2 моль 2
моль
0,5х моль 3х моль х моль
4
моль 2 моль 2 моль 2
моль
0,5х моль 3х моль х моль
 1
моль 6 моль 2 моль
102 г/моль 63
г/моль 213 г/моль
у моль 2у моль
у моль
1
моль 6 моль 2 моль
102 г/моль 63
г/моль 213 г/моль
у моль 2у моль
у моль
 1
моль 2 моль 1 моль
40 г/моль
148 г/моль
1
моль 2 моль 1 моль
40 г/моль
148 г/моль

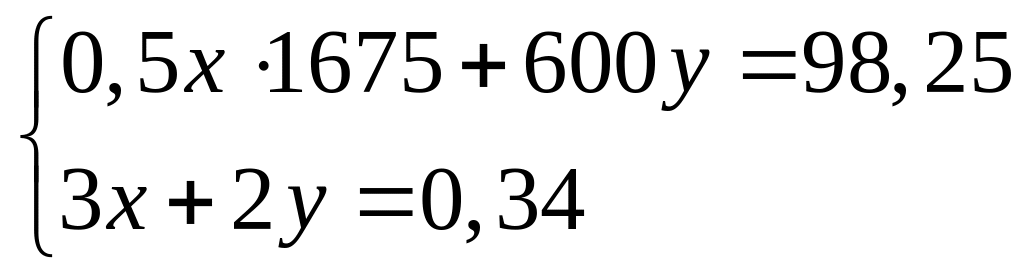
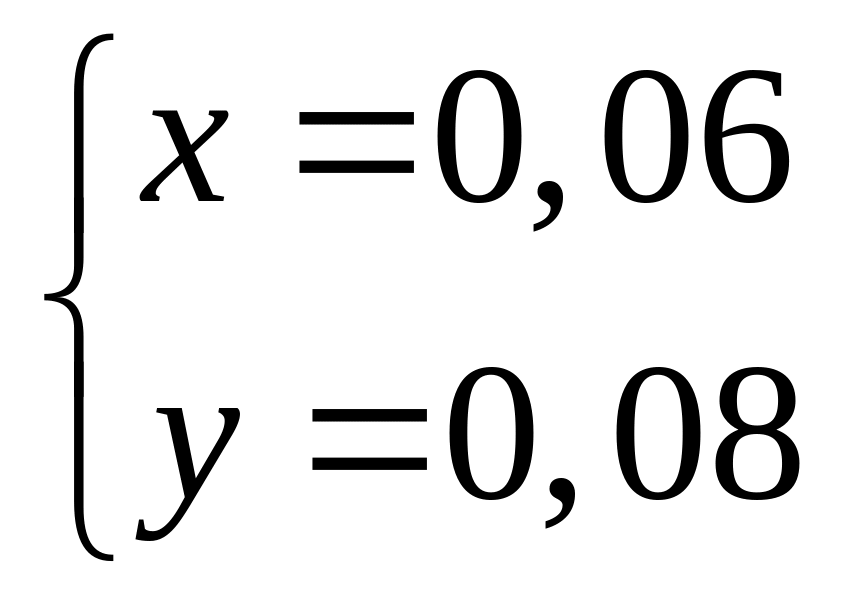
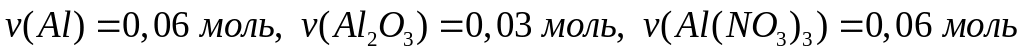
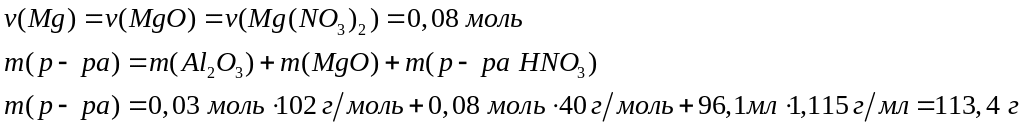
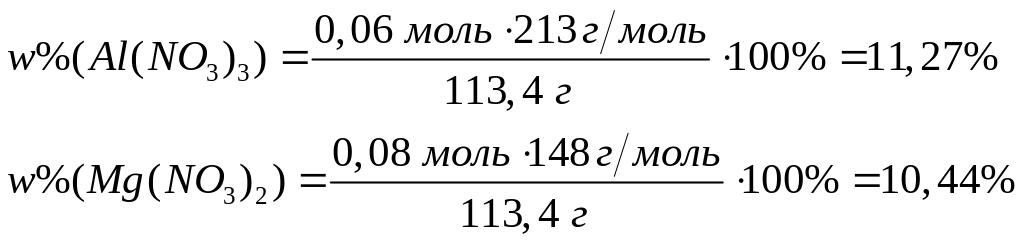 Решите:
При
окислении смеси алюминия и магния
кислородом выделяется 117,9 кДж теплоты.
Продукты окисления полностью реагируют
с 86,2 мл 16%-го раствора соляной кислоты
(=1,08 г/мл). Вычислите
массовые доли хлоридов в полученном
растворе. Теплоты образования оксидов
алюминия и магния соответственно равны
1675 кДж/моль и 600 кДж/моль.
Решите:
При
окислении смеси алюминия и магния
кислородом выделяется 117,9 кДж теплоты.
Продукты окисления полностью реагируют
с 86,2 мл 16%-го раствора соляной кислоты
(=1,08 г/мл). Вычислите
массовые доли хлоридов в полученном
растворе. Теплоты образования оксидов
алюминия и магния соответственно равны
1675 кДж/моль и 600 кДж/моль.Растворимость хлорида алюминия при 30С равна 470 г/л. Вычислите массовую долю хлорида алюминия в насыщенном растворе.
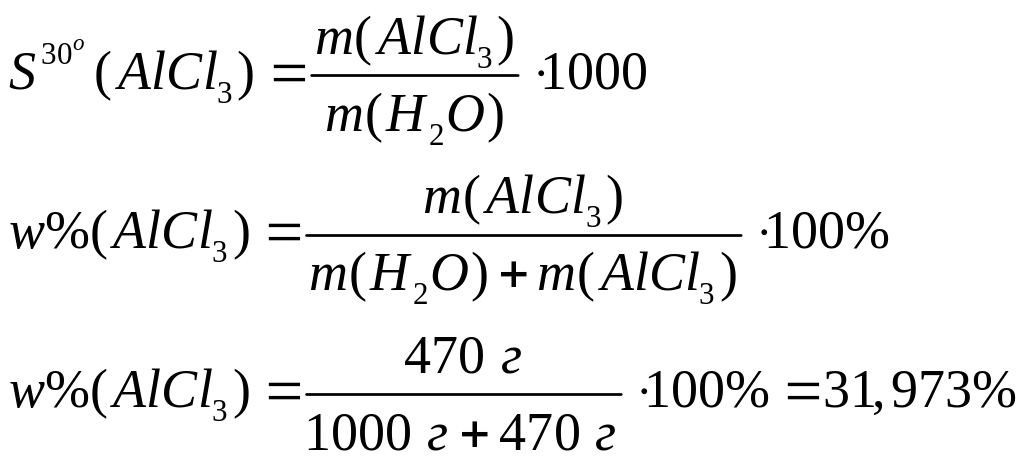 Решите:
Растворимость
нитрата алюминия при 20С
равна 626 г/л. Вычислите массовую долю
нитрата алюминия в насыщенном растворе.
Решите:
Растворимость
нитрата алюминия при 20С
равна 626 г/л. Вычислите массовую долю
нитрата алюминия в насыщенном растворе.Массовая доля нитрата алюминия в насыщенном при 25С растворе равна 39,5%. Вычислите растворимость нитрата алюминия при данной температуре.
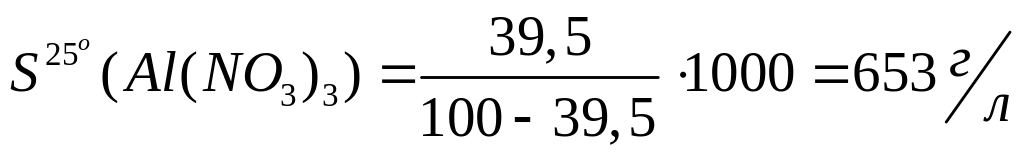 Решите:
Массовая
доля хлорида алюминия в насыщенном при
25С растворе равна
31,082%. Вычислите растворимость хлорида
алюминия при данной температуре.
Решите:
Массовая
доля хлорида алюминия в насыщенном при
25С растворе равна
31,082%. Вычислите растворимость хлорида
алюминия при данной температуре.Массовая доля сульфата алюминия в насыщенном при 30С растворе равна 28% (=1,333 г/мл). Вычислите растворимость и молярную концентрацию сульфата алюминия.
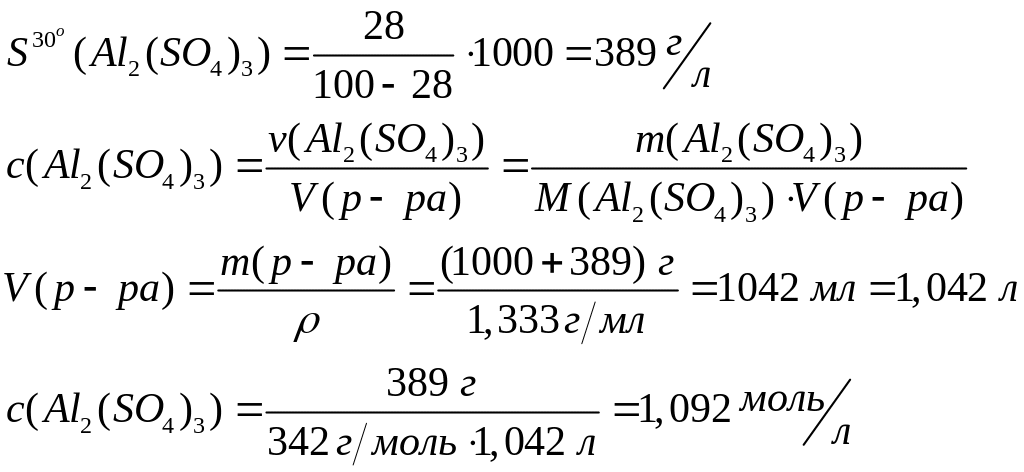 Решите:
Массовая
доля нитрата алюминия в насыщенном при
20С растворе равна
38,5% (=1,375 г/мл).
Вычислите растворимость и молярную
концентрацию нитрата алюминия.
Решите:
Массовая
доля нитрата алюминия в насыщенном при
20С растворе равна
38,5% (=1,375 г/мл).
Вычислите растворимость и молярную
концентрацию нитрата алюминия.Растворимость сульфата алюминия при 25С равна 385 г/л. Вычислите молярную концентрацию сульфата алюминия в растворе, если его плотность =1,328 г/мл.
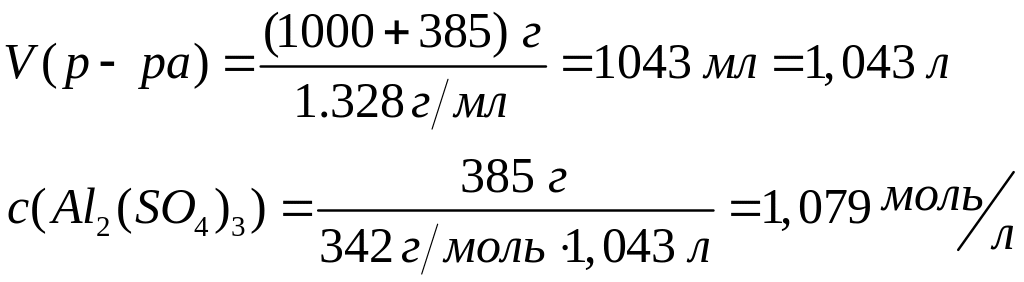 Решите:
Растворимость
хлорида алюминия при 25С
равна 451 г/л. Вычислите молярную
концентрацию хлорида алюминия в
растворе, если его плотность =1,429
г/мл.
Решите:
Растворимость
хлорида алюминия при 25С
равна 451 г/л. Вычислите молярную
концентрацию хлорида алюминия в
растворе, если его плотность =1,429
г/мл.Сколько по массе
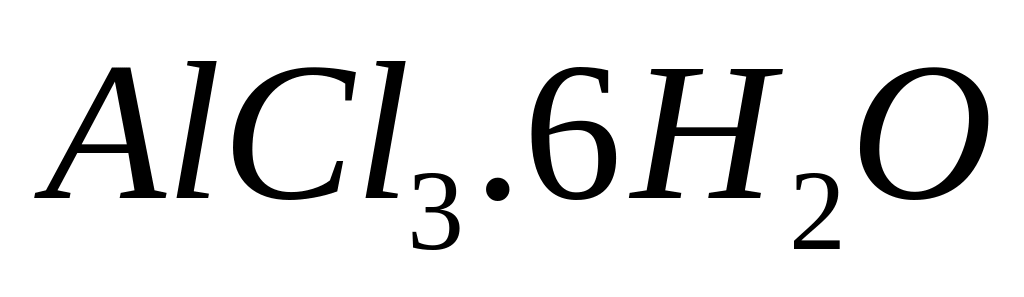 и какой объем воды необходимы для
приготовления 500 мл 16%-го раствора
хлорида алюминия (=1,149
г/мл)?
I способ
и какой объем воды необходимы для
приготовления 500 мл 16%-го раствора
хлорида алюминия (=1,149
г/мл)?
I способ
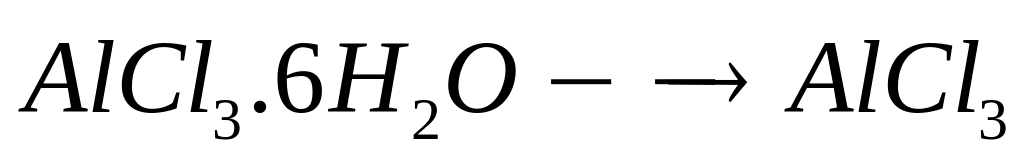 1 моль 1 моль
241,5 г/моль
133,5 г/моль
1 моль 1 моль
241,5 г/моль
133,5 г/моль
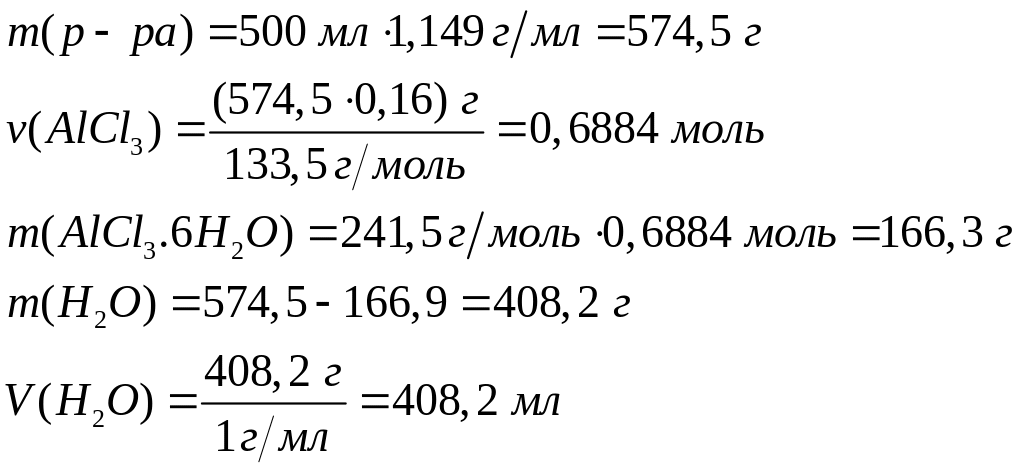 II
способ
II
способ
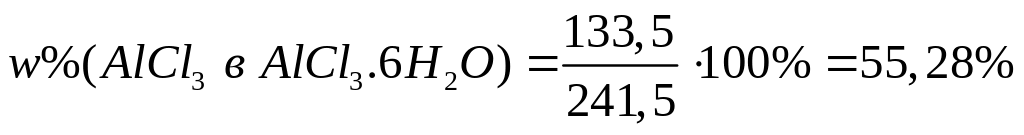
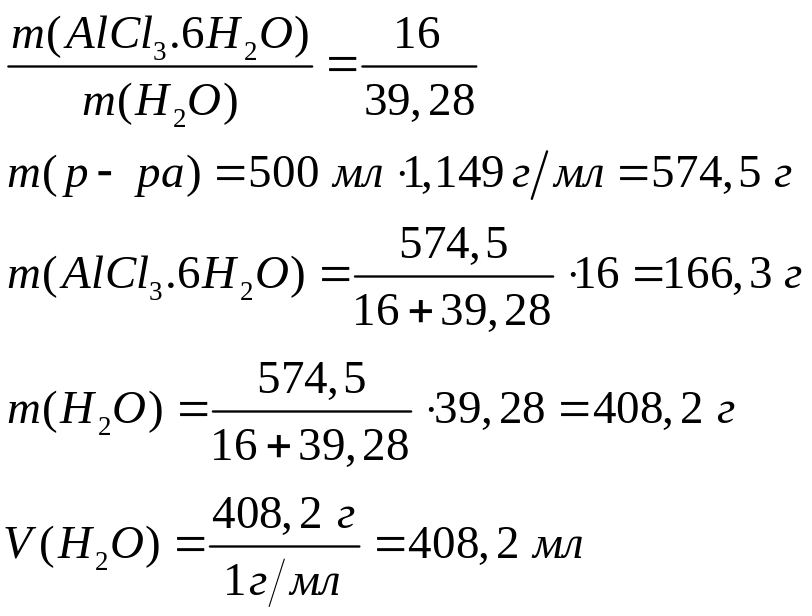 Решите:
Сколько
по массе
Решите:
Сколько
по массе
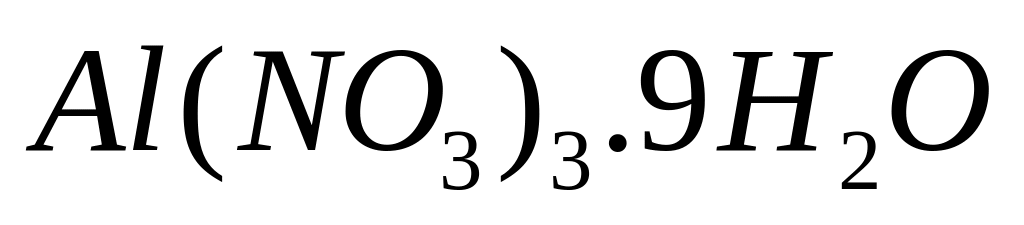 и какой объем воды необходимы для
приготовления 750 мл 30%-го раствора
нитрата алюминия (=1,28
г/мл)?
и какой объем воды необходимы для
приготовления 750 мл 30%-го раствора
нитрата алюминия (=1,28
г/мл)?С колько по массе необходимо растворить в 250 мл 10%-го раствора нитрата алюминия (=1,081 г/мл), чтобы получить 24%-ный раствор (=1,215 г/мл)?
 1 моль 1 моль
375 г/моль
213 г/моль
I способ
1 моль 1 моль
375 г/моль
213 г/моль
I способ
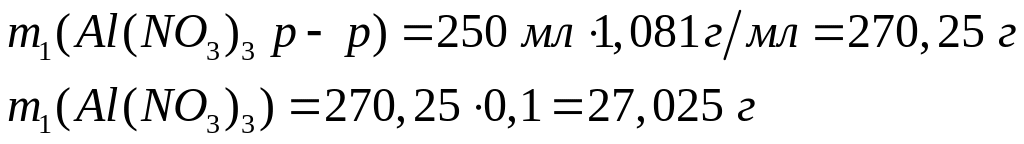 Пусть
Пусть
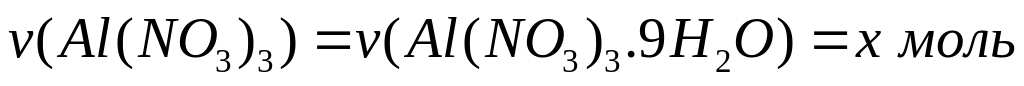 ,
тогда
,
тогда
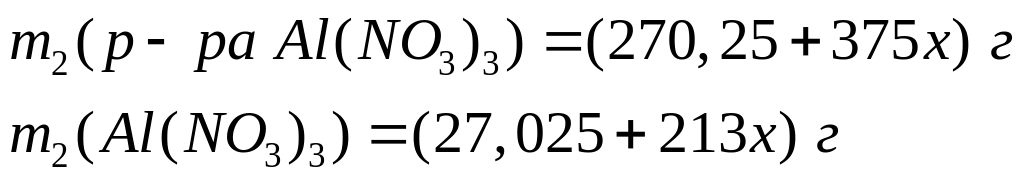
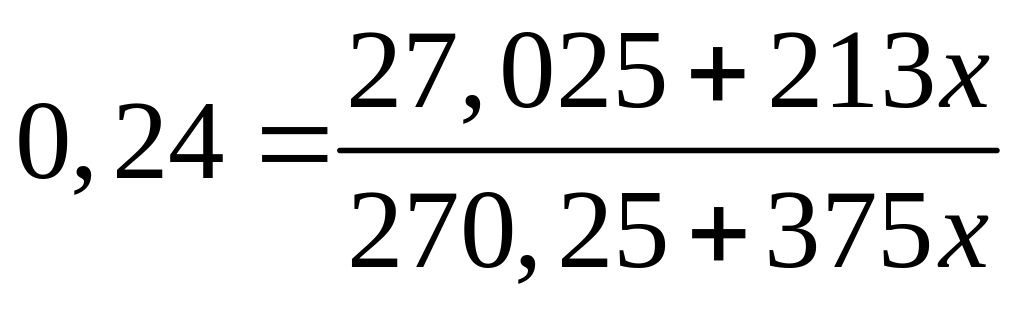
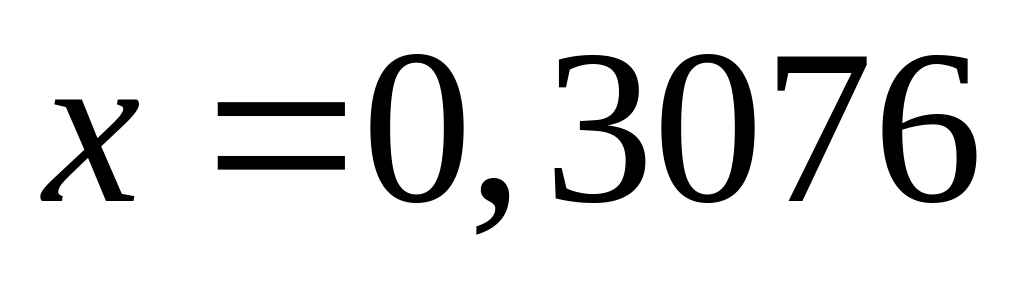
 II
способ
II
способ
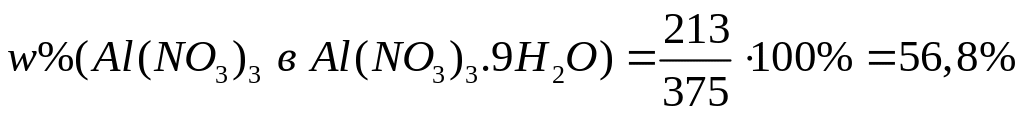 Пусть
Пусть
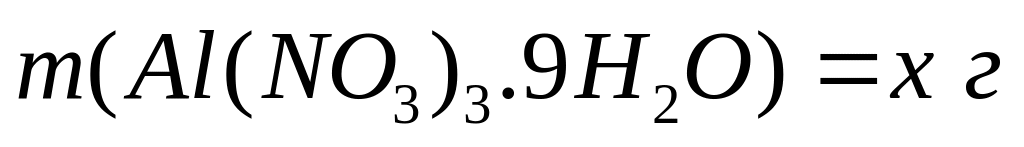 ,
тогда
,
тогда
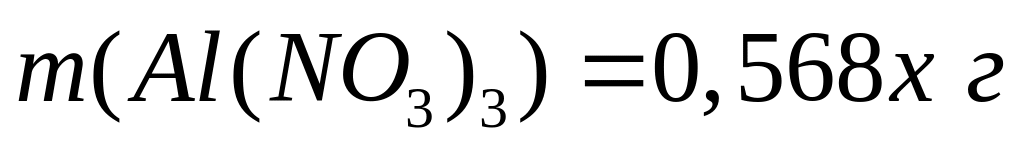
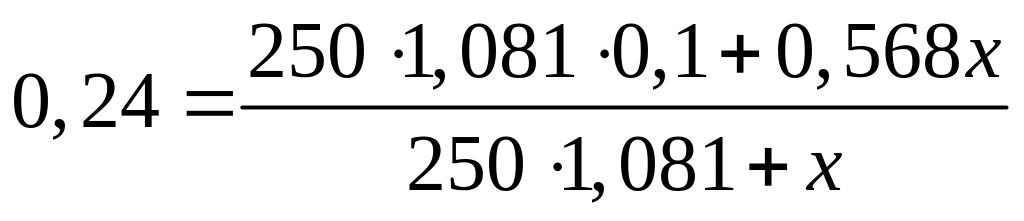
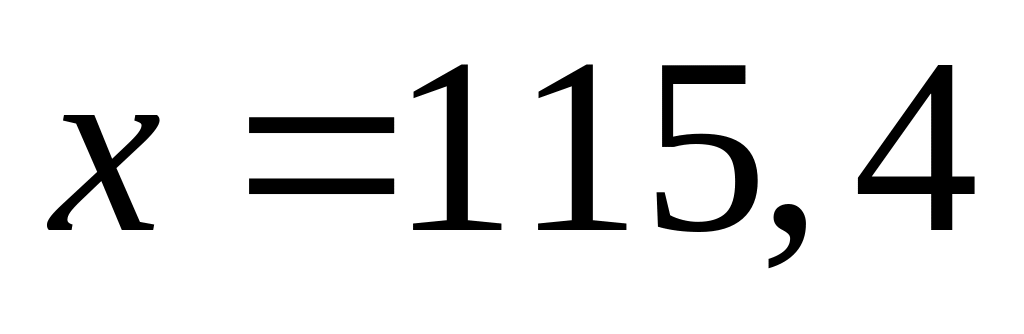
 III
способ
III
способ
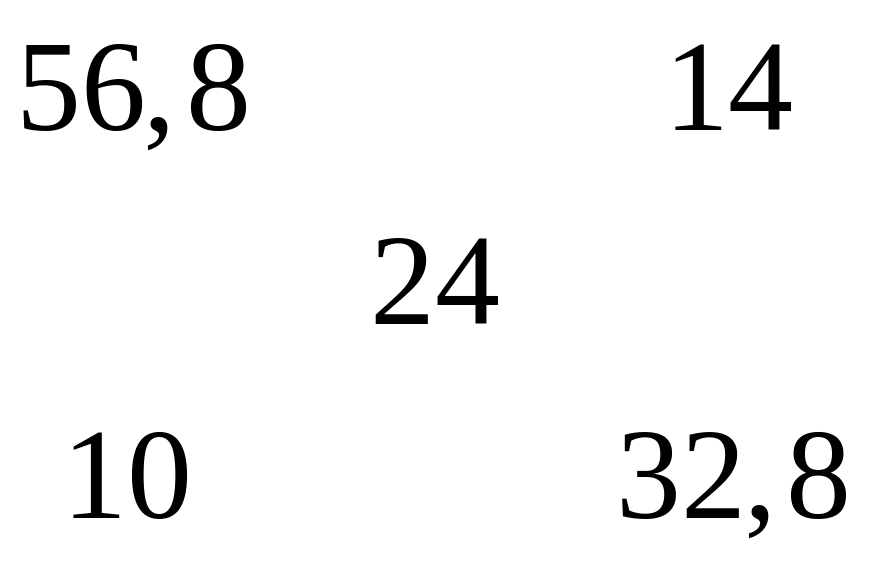
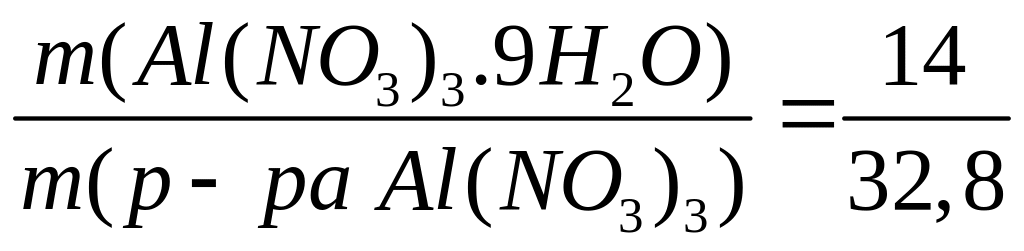
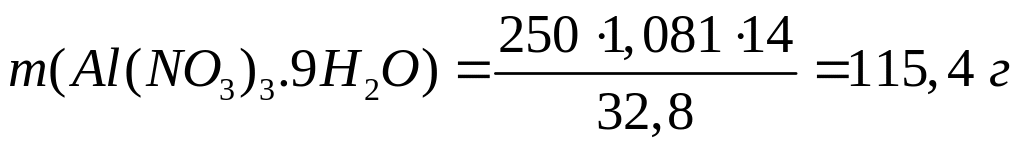 Решите:
Сколько
по массе
Решите:
Сколько
по массе
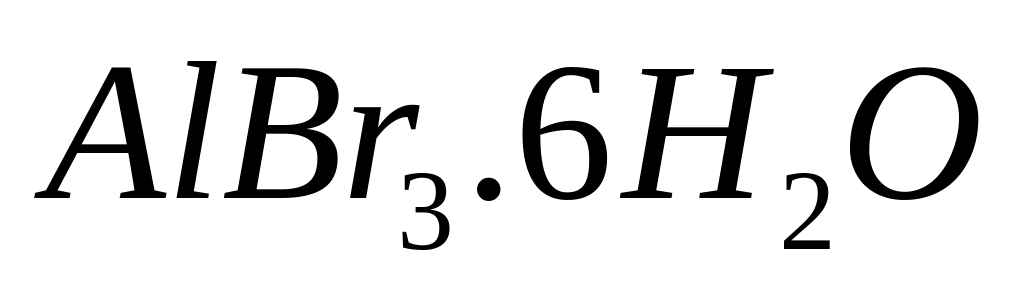 необходимо растворить в 300 мл 8%-го
раствора бромида алюминия (=1,062
г/мл), чтобы получить 22%-ный раствор
(=1,193 г/мл)?
необходимо растворить в 300 мл 8%-го
раствора бромида алюминия (=1,062
г/мл), чтобы получить 22%-ный раствор
(=1,193 г/мл)?Н онагидрат нитрата алюминия массой 60 г растворили в 167,2 мл воды и получили раствор объемом 201,8 мл. Вычислите массовую долю нитрата алюминия в растворе, его молярную концентрацию и плотность раствора. 1 моль 1 моль 375 г/моль 213 г/моль
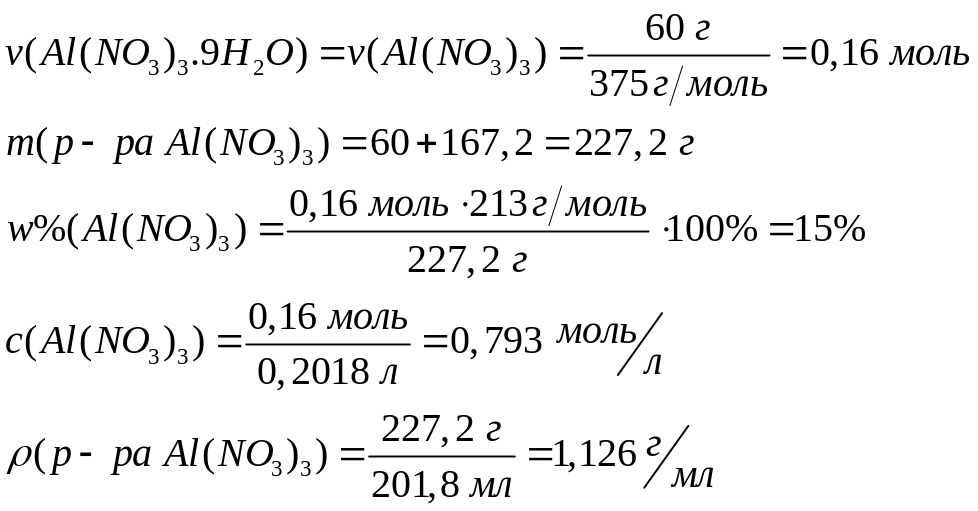 II
способ
II
способ
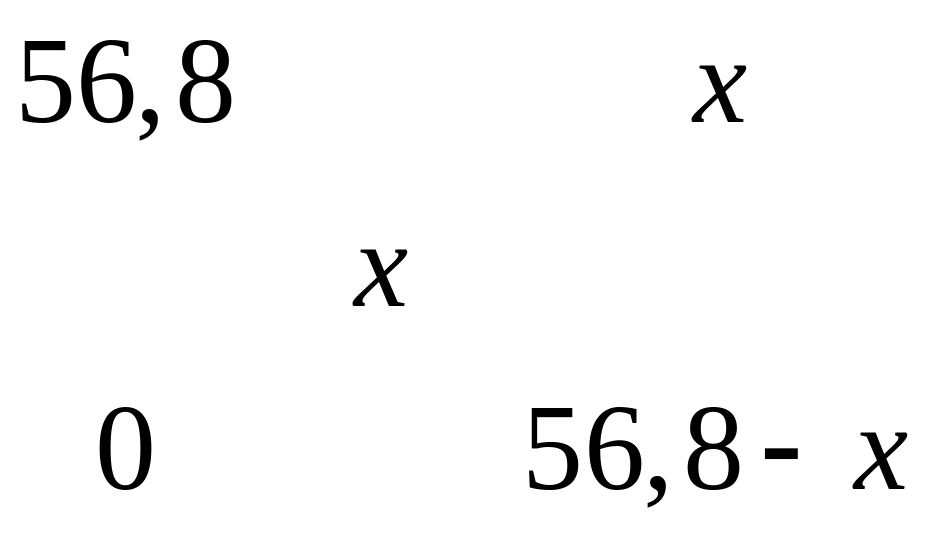

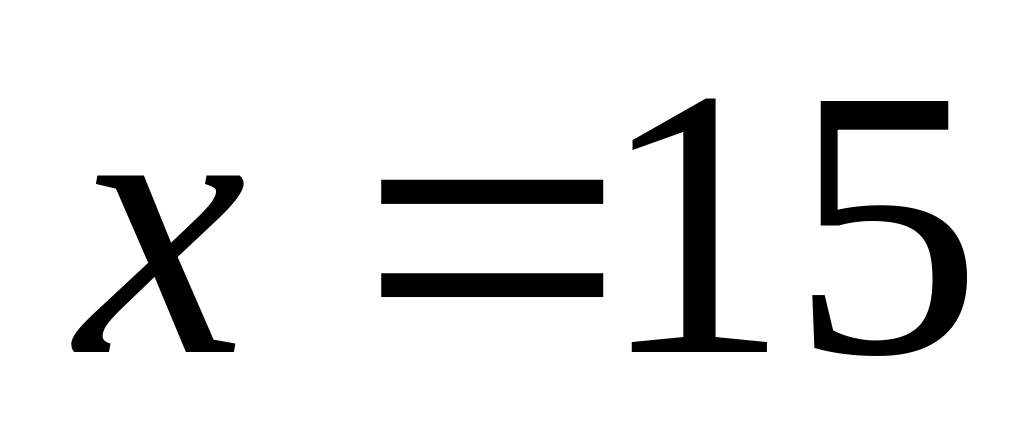
 Решите:
Гексагидрат
хлорида алюминия массой 96,6 г растворили
в 170,4 мл воды и получили раствор объемом
224,6 мл. Вычислите массовую долю хлорида
алюминия в растворе, его молярную
концентрацию и плотность раствора.
Решите:
Гексагидрат
хлорида алюминия массой 96,6 г растворили
в 170,4 мл воды и получили раствор объемом
224,6 мл. Вычислите массовую долю хлорида
алюминия в растворе, его молярную
концентрацию и плотность раствора.К
 300 мл 12%-го раствора сульфата алюминия
(=1,129 г/мл) прилили
200 мл 20%-го раствора сульфата алюминия
(=1,225 г/мл). Какова
массовая доля сульфата алюминия в
полученном растворе?
I
способ
300 мл 12%-го раствора сульфата алюминия
(=1,129 г/мл) прилили
200 мл 20%-го раствора сульфата алюминия
(=1,225 г/мл). Какова
массовая доля сульфата алюминия в
полученном растворе?
I
способ
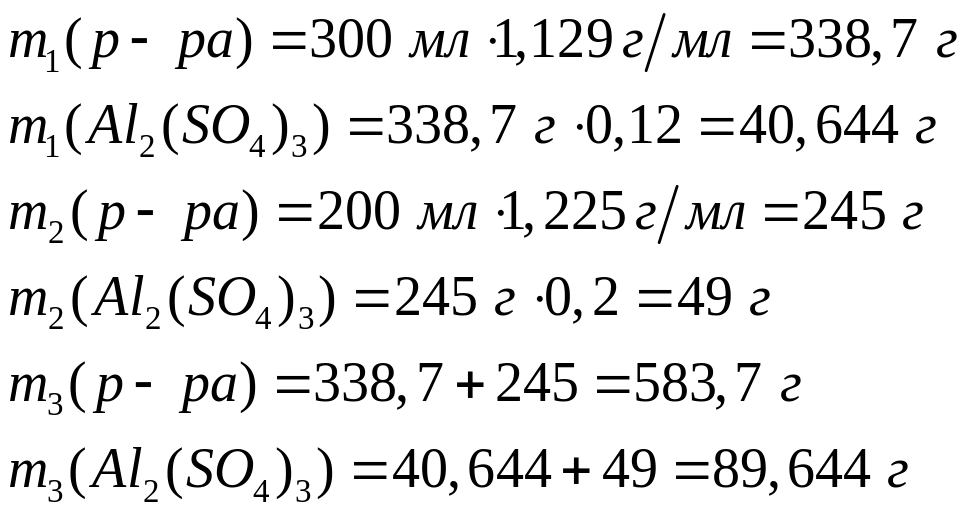
 или
или
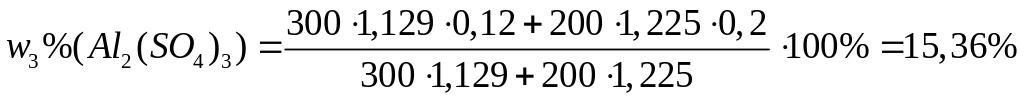 II
способ
II
способ
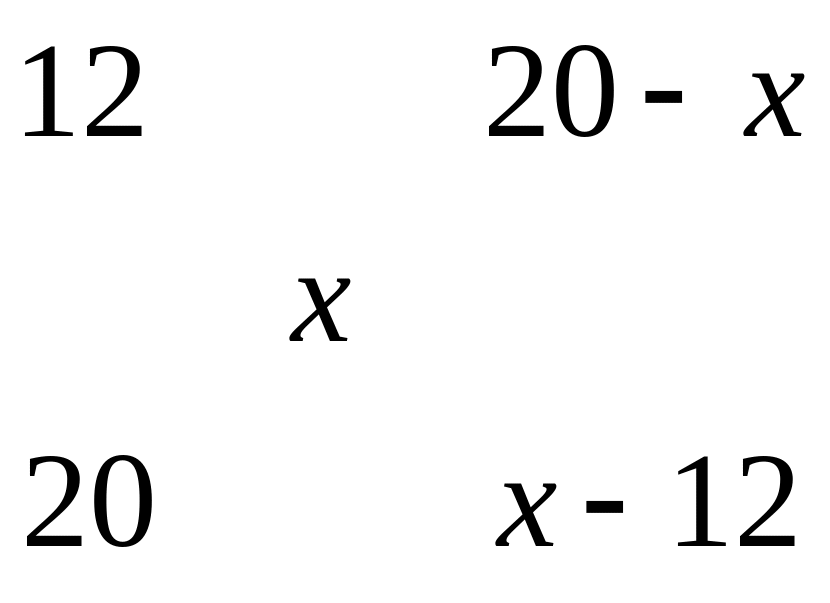
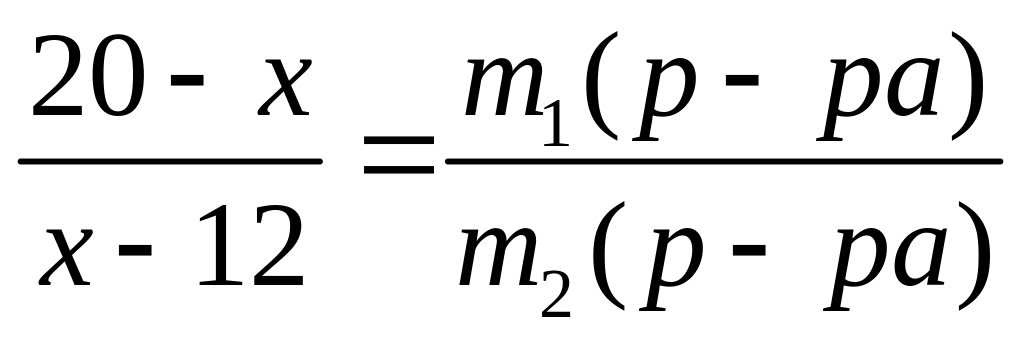
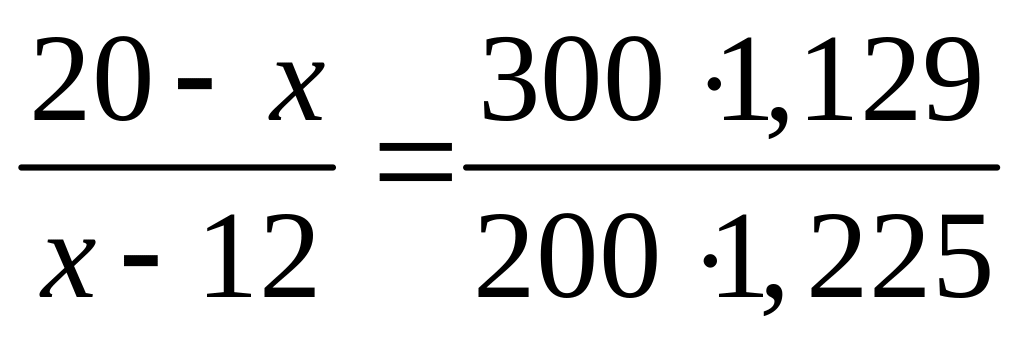
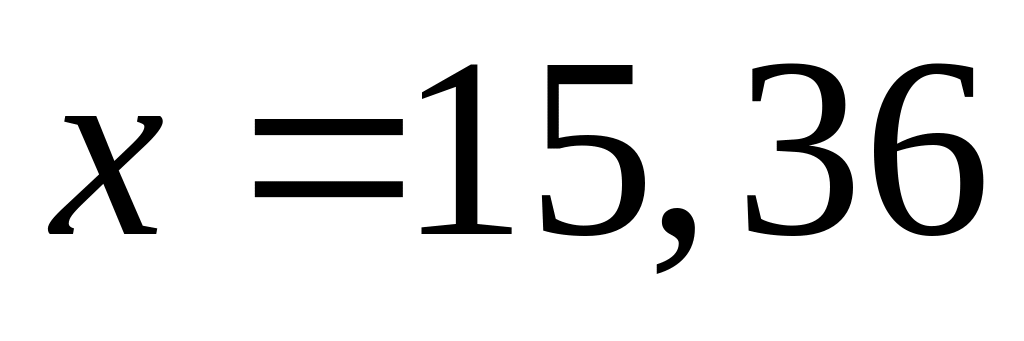
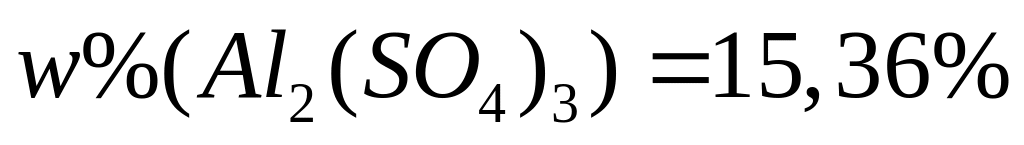 Решите:
К
200 мл 10%-го раствора нитрата алюминия
(=1,081 г/мл) прилили
300 мл 32%-го раствора нитрата алюминия
(=1,304 г/мл). Какова
массовая доля нитрата алюминия в
полученном растворе?
Решите:
К
200 мл 10%-го раствора нитрата алюминия
(=1,081 г/мл) прилили
300 мл 32%-го раствора нитрата алюминия
(=1,304 г/мл). Какова
массовая доля нитрата алюминия в
полученном растворе?К
 акой
объем 30%-го раствора нитрата алюминия
(=1,281 г/мл) необходимо
добавить к 200 мл 5%-го раствора нитрата
алюминия (=1,039 г/мл),
чтобы получить 15%-ный раствор?
I способ
Пусть
акой
объем 30%-го раствора нитрата алюминия
(=1,281 г/мл) необходимо
добавить к 200 мл 5%-го раствора нитрата
алюминия (=1,039 г/мл),
чтобы получить 15%-ный раствор?
I способ
Пусть
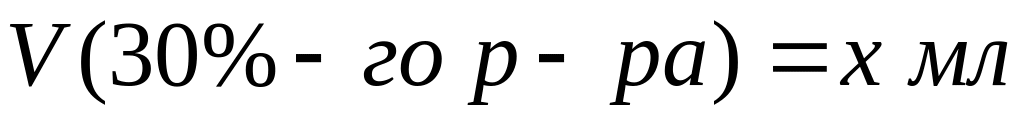 ,
тогда
,
тогда
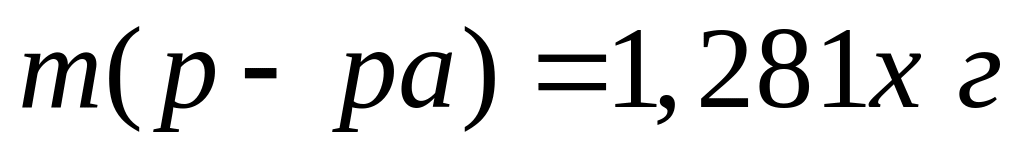
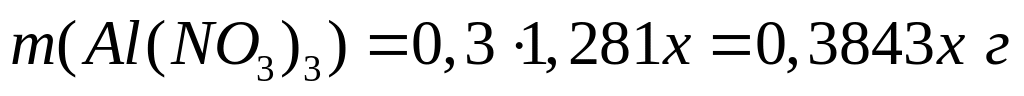
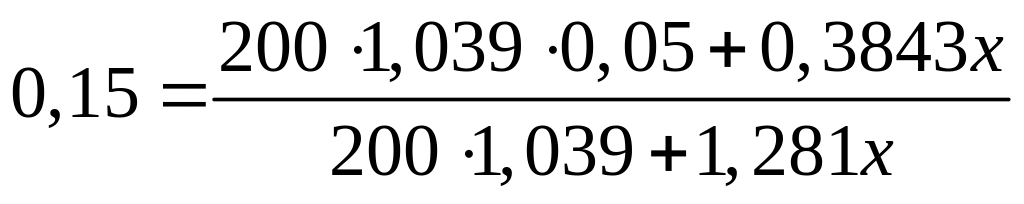
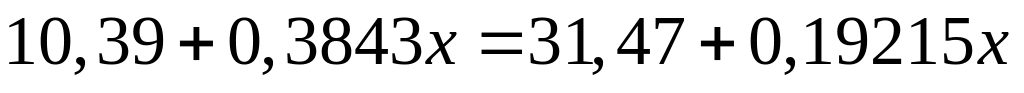

 II
способ
II
способ
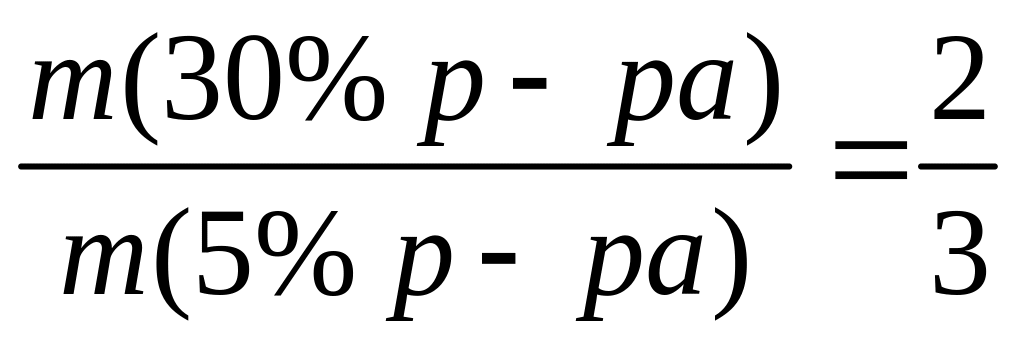
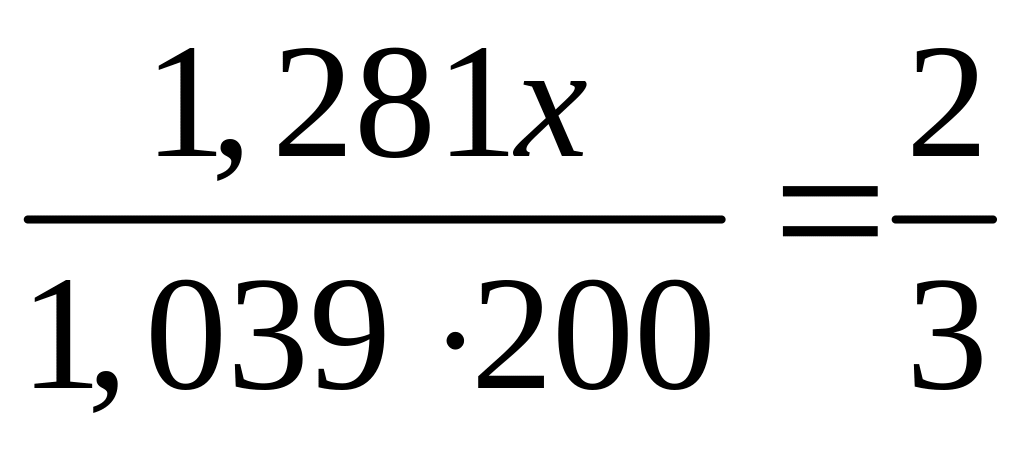 Решите:
Какой
объем 28%-го раствора сульфата алюминия
(=1,333 г/мл) необходимо
добавить к 300 мл 8%-го раствора сульфата
алюминия (=1,083 г/мл),
чтобы получить 15%-ный раствор?
Решите:
Какой
объем 28%-го раствора сульфата алюминия
(=1,333 г/мл) необходимо
добавить к 300 мл 8%-го раствора сульфата
алюминия (=1,083 г/мл),
чтобы получить 15%-ный раствор?К
 акой
объем 20%-го раствора соляной кислоты
(=1,1 г/мл) вступит в
реакцию с 5,94 г алюминия? Какова массовая
доля хлорида алюминия в растворе?
0,22
моль 0,66 моль 0,22 моль 0,33 моль
акой
объем 20%-го раствора соляной кислоты
(=1,1 г/мл) вступит в
реакцию с 5,94 г алюминия? Какова массовая
доля хлорида алюминия в растворе?
0,22
моль 0,66 моль 0,22 моль 0,33 моль
 2
моль 6 моль 2 моль 3 моль
27
г/моль 36,5 г/моль 133,5 г/моль
2г/моль
2
моль 6 моль 2 моль 3 моль
27
г/моль 36,5 г/моль 133,5 г/моль
2г/моль
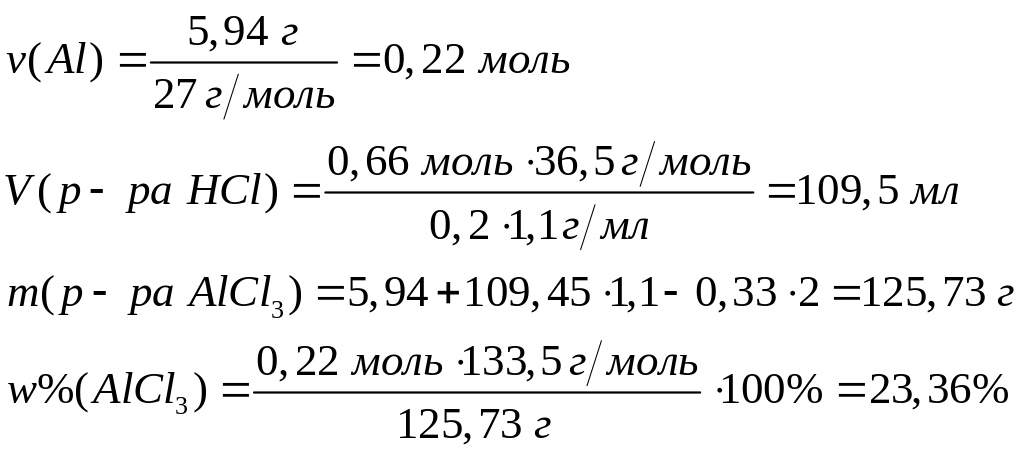 Решите:
Какой
объем 20%-го раствора серной кислоты
(=1,139 г/мл) вступит
в реакцию с 6,75 г алюминия? Какова
массовая доля сульфата алюминия в
растворе?
Решите:
Какой
объем 20%-го раствора серной кислоты
(=1,139 г/мл) вступит
в реакцию с 6,75 г алюминия? Какова
массовая доля сульфата алюминия в
растворе?Сколько по массе оксида алюминия вступит в реакцию с 105,6 мл 25%-го раствора азотной кислоты (=1,146 г/мл)? Какова массовая доля нитрата алюминия в растворе?
 1
моль 6 моль 2 моль
102 г/моль
63 г/моль 213 г/моль
1
моль 6 моль 2 моль
102 г/моль
63 г/моль 213 г/моль
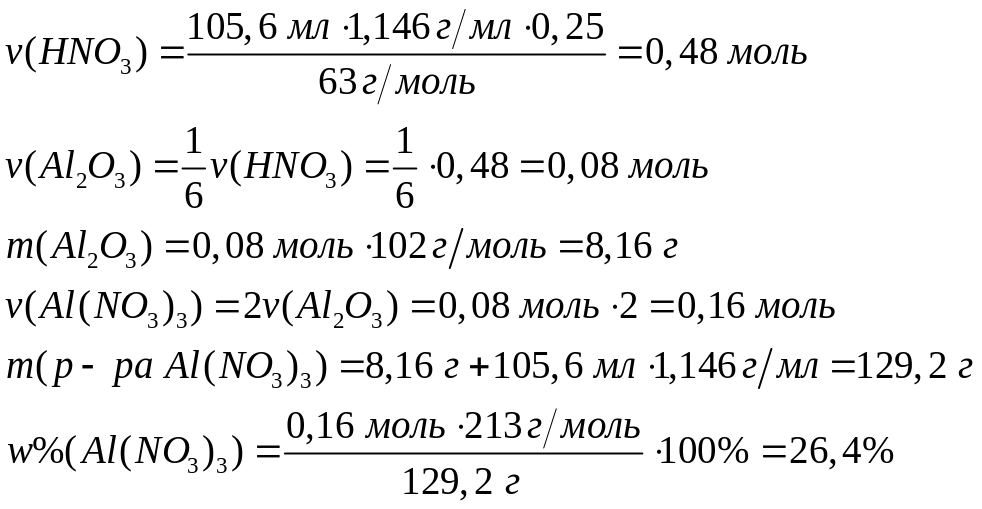 Решите:
Сколько
по массе карбида алюминия вступит в
реакцию с 74,7 мл 20%-го раствора соляной
кислоты (=1,1 г/мл)?
Какова массовая доля хлорида алюминия
в растворе?
Решите:
Сколько
по массе карбида алюминия вступит в
реакцию с 74,7 мл 20%-го раствора соляной
кислоты (=1,1 г/мл)?
Какова массовая доля хлорида алюминия
в растворе?Смесь алюминия и железа полностью реагирует с 8,064 л хлора. Такая же масса смеси полностью реагирует с 109,5 мл 20%-го раствора соляной кислоты (=1,1 г/мл). Каковы массовые доли металлов в исходной смеси? х моль 1,5х моль у моль 1,5у моль
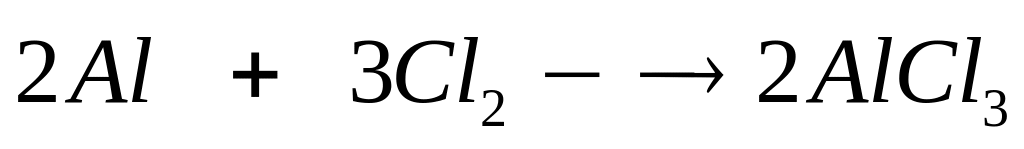
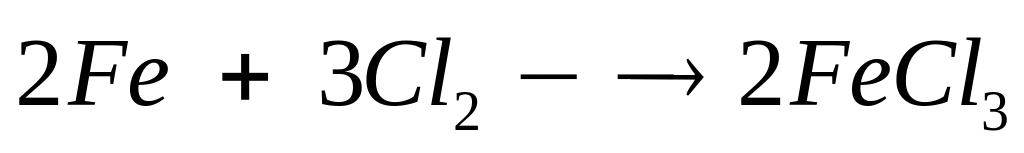 2
моль 3 моль 2 моль 3 моль
27 г/моль
22,4 л/моль 56 г/моль
2
моль 3 моль 2 моль 3 моль
27 г/моль
22,4 л/моль 56 г/моль
 х
моль 3х моль
х
моль 3х моль
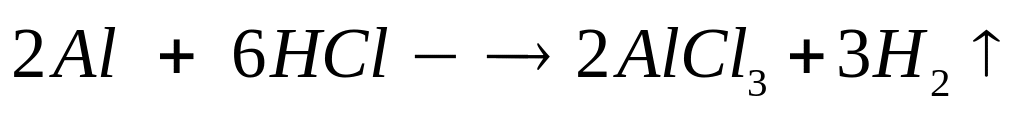 2
моль 6 моль
36,5 г/моль
у моль
2у моль
2
моль 6 моль
36,5 г/моль
у моль
2у моль
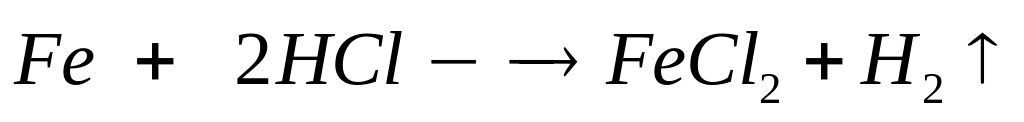 1
моль 2 моль
1
моль 2 моль
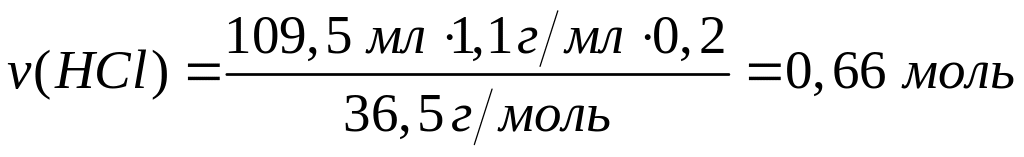
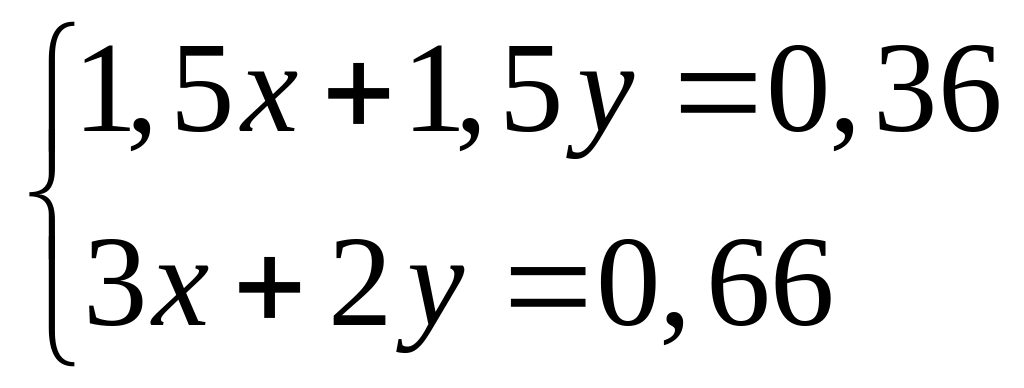
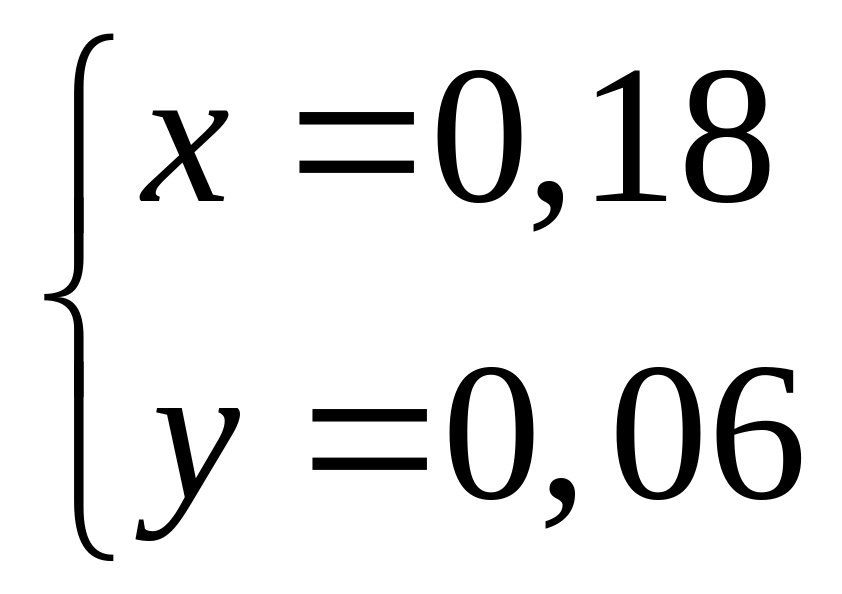
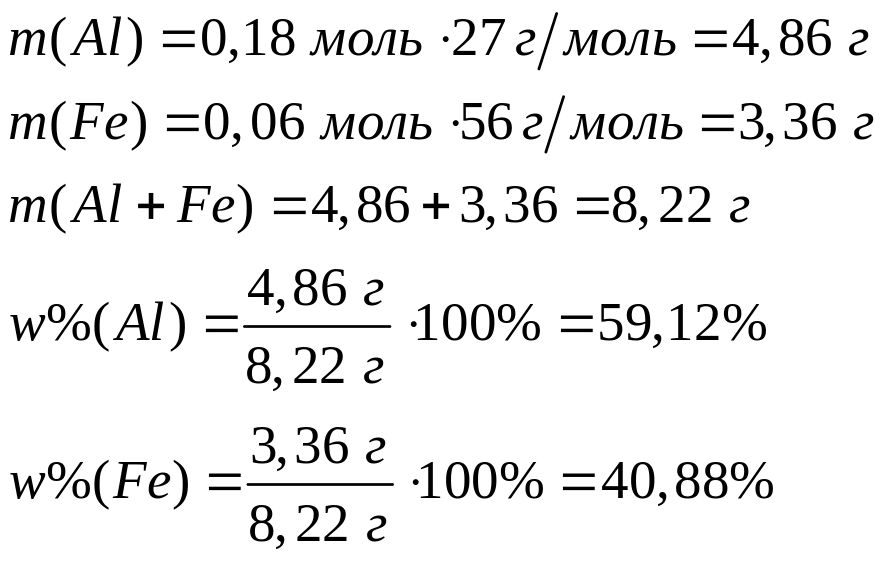 Решите:
Смесь
алюминия и хрома полностью реагирует
с 6,72 л хлора. Такая же масса смеси
полностью реагирует с 118,31 мл 20%-го
раствора серной кислоты (=1,139
г/мл). Каковы массовые доли металлов в
исходной смеси?
Решите:
Смесь
алюминия и хрома полностью реагирует
с 6,72 л хлора. Такая же масса смеси
полностью реагирует с 118,31 мл 20%-го
раствора серной кислоты (=1,139
г/мл). Каковы массовые доли металлов в
исходной смеси?Какой объем 20%-го раствора гидроксида натрия (=1,219 г/мл) вступит в реакцию с 7,2 г карбида алюминия?
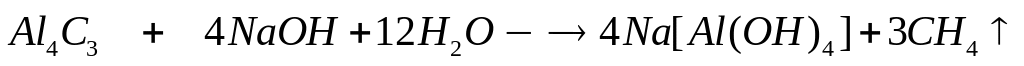 1
моль 4 моль
144 г/моль 40
г/моль
1
моль 4 моль
144 г/моль 40
г/моль
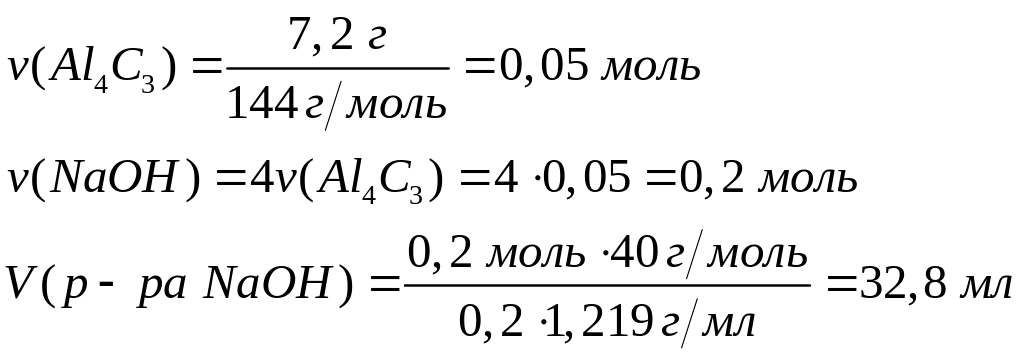 Решите:
Какой
объем 25%-го раствора гидроксида калия
(=1,24 г/мл) вступит
в реакцию с 9 г сульфида алюминия?
Решите:
Какой
объем 25%-го раствора гидроксида калия
(=1,24 г/мл) вступит
в реакцию с 9 г сульфида алюминия?Смесь сульфида и карбида алюминия массой 13,26 г полностью реагирует с 176,6 мл 15%-го раствора соляной кислоты (=1,075 г/мл). Определите массовую долю хлорида алюминия в полученном растворе. х моль 6х моль 2х моль 3х моль
 1
моль 6 моль 2 моль 3 моль
150
г/моль 36,5 г/моль 133,5 г/моль 34 г/моль
у
моль 12 у моль 4у моль 3у моль
1
моль 6 моль 2 моль 3 моль
150
г/моль 36,5 г/моль 133,5 г/моль 34 г/моль
у
моль 12 у моль 4у моль 3у моль
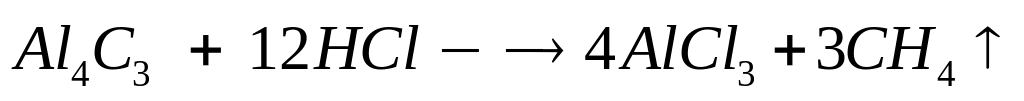 1
моль 12 моль 4 моль 3 моль
144
г/моль 16 г/моль
1
моль 12 моль 4 моль 3 моль
144
г/моль 16 г/моль
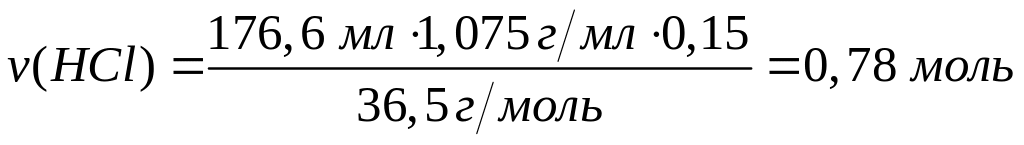
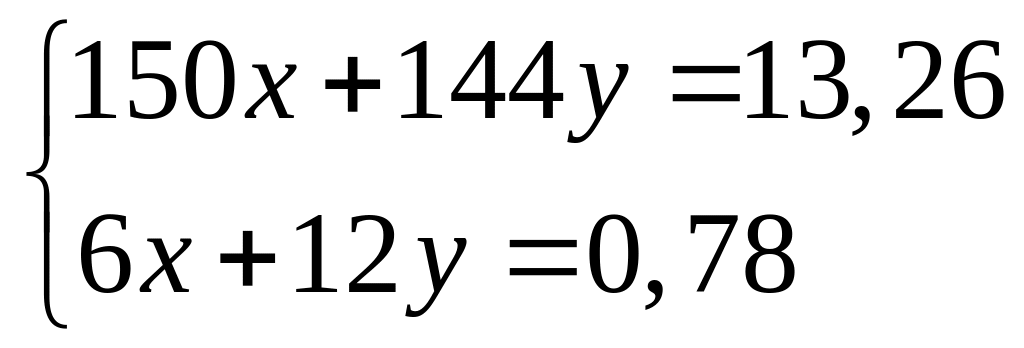
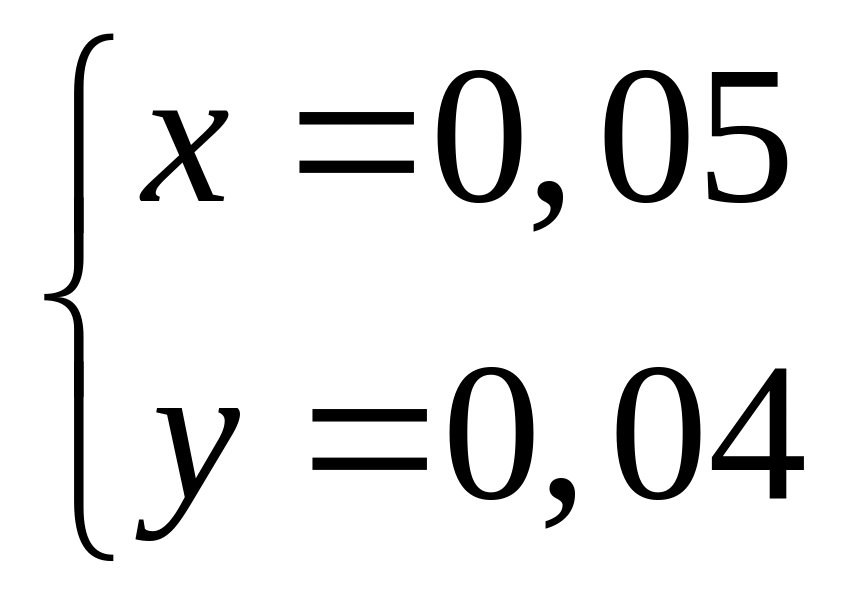
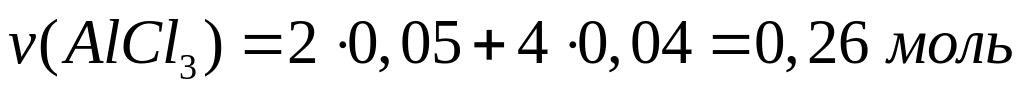
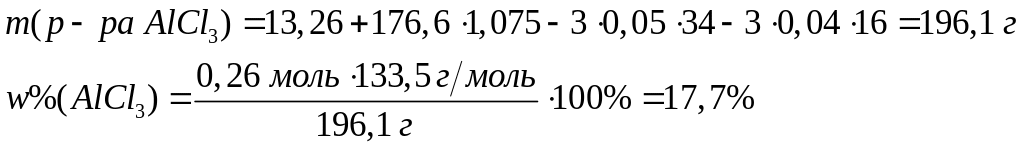 Решите:
Смесь
алюминия и сульфида алюминия массой
7,74 г полностью реагирует с 116,2 мл 20%-го
раствора серной кислоты (=1,139
г/мл). Определите массовую долю сульфата
алюминия в полученном растворе.
Решите:
Смесь
алюминия и сульфида алюминия массой
7,74 г полностью реагирует с 116,2 мл 20%-го
раствора серной кислоты (=1,139
г/мл). Определите массовую долю сульфата
алюминия в полученном растворе.Смесь оксида, карбида и сульфида алюминия полностью реагирует с 167,8 мл 20%-го раствора серной кислоты (=1,139 г/мл), при этом выделяется 4,032 л смеси газов с относительной плотностью по гелию 6,25. Определите массовые доли компонентов в исходной смеси, массовую долю сульфата алюминия в растворе.
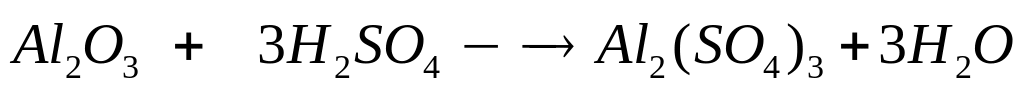 1
моль 3 моль 1 моль
102 г/моль
98 г/моль 342 г/моль
1
моль 3 моль 1 моль
102 г/моль
98 г/моль 342 г/моль
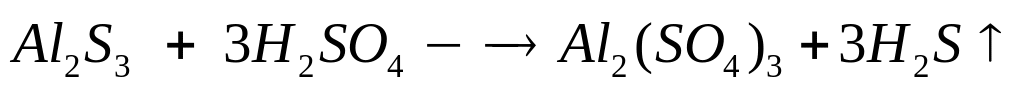 1
моль 3 моль 1 моль 3 моль
150
г/моль 34 г/моль
1
моль 3 моль 1 моль 3 моль
150
г/моль 34 г/моль
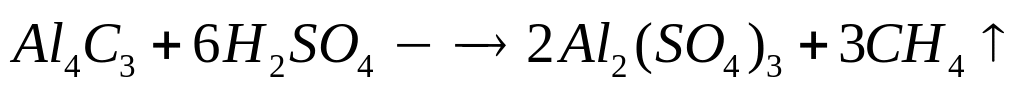 1
моль 6 моль 2 моль 3 моль
144
г/моль 16 г/моль
1
моль 6 моль 2 моль 3 моль
144
г/моль 16 г/моль
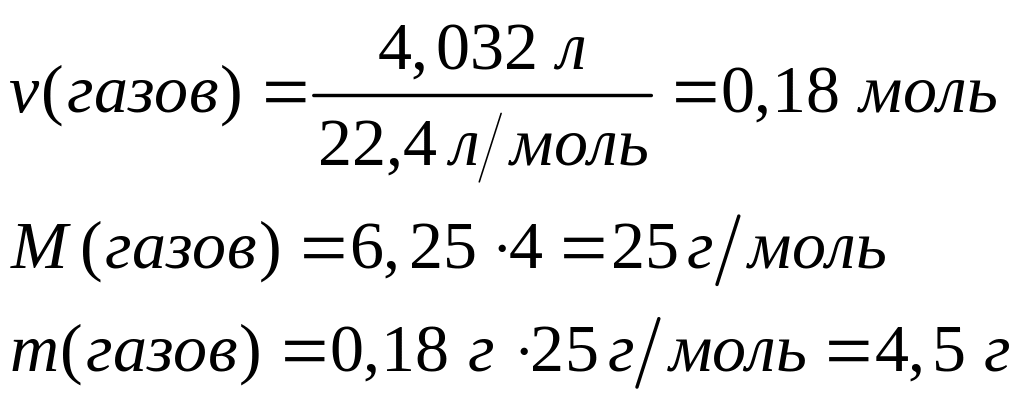 Пусть
Пусть
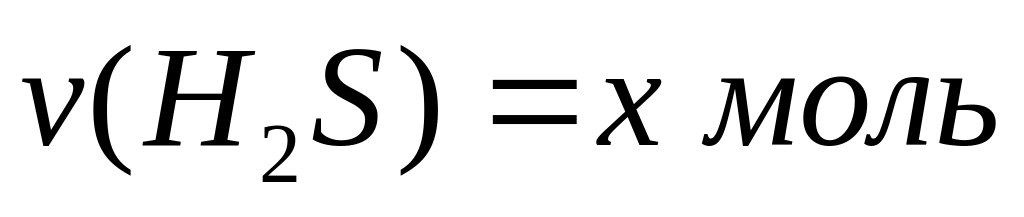 ,
тогда
,
тогда
 ,
,
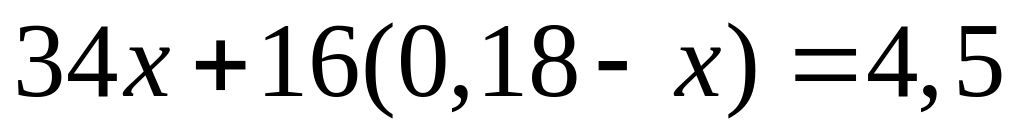
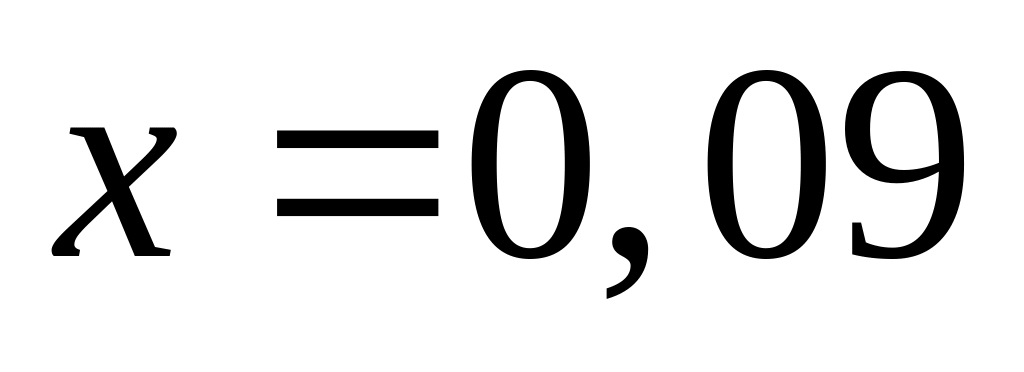
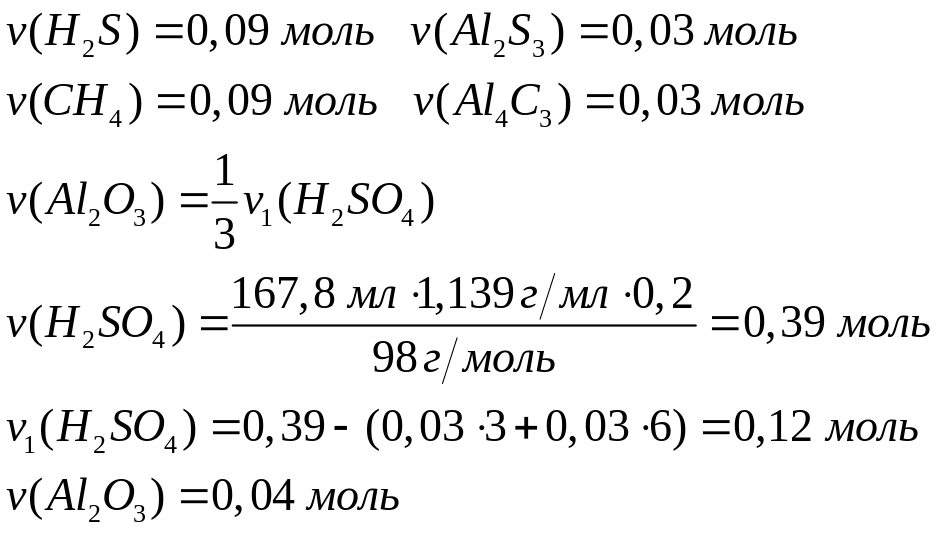
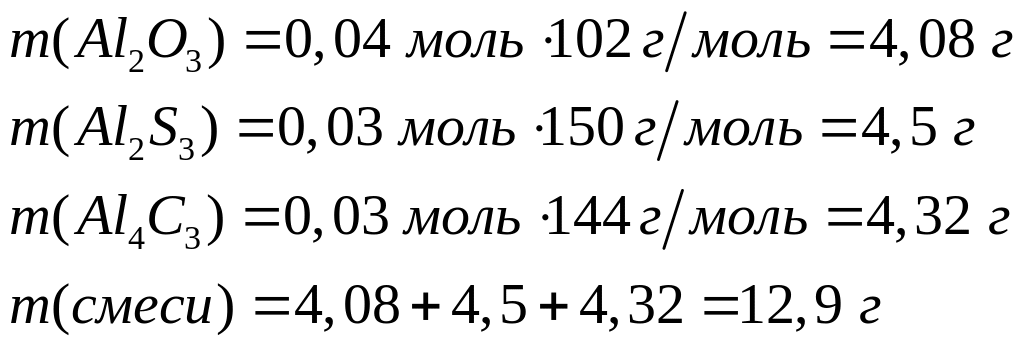
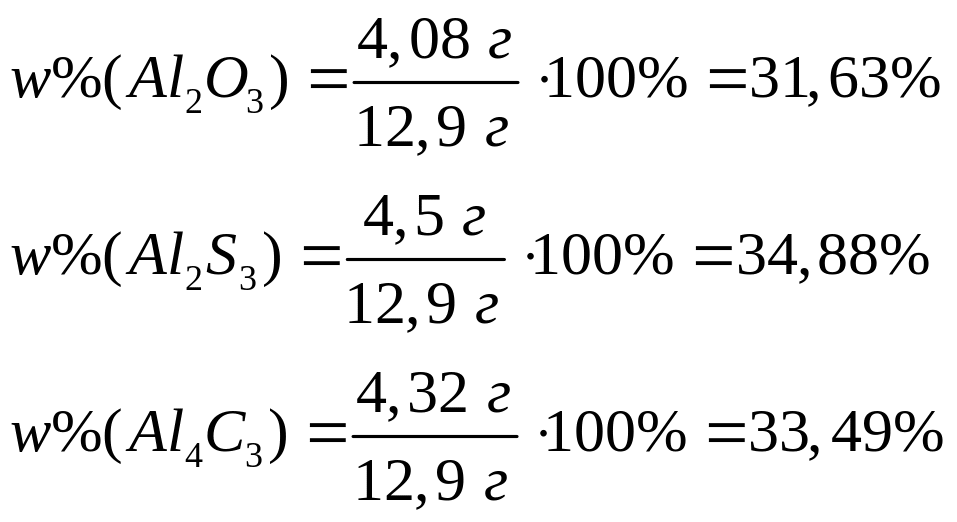
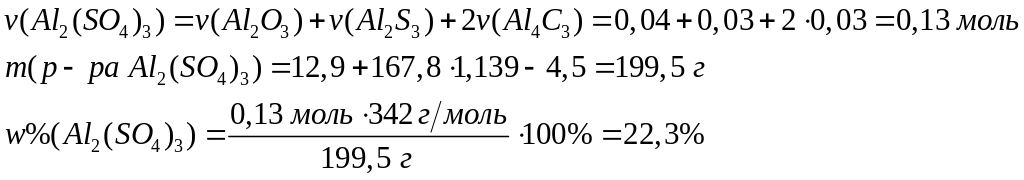 Решите:
Смесь
алюминия, оксида алюминия и карбида
алюминия полностью реагирует с 120,61 мл
20%-го раствора соляной кислоты (=1,15
г/мл), при этом выделяется 6,72 л смеси
газов с относительной плотностью по
гелию 1,9. Определите массовые доли
компонентов в исходной смеси, массовую
долю хлорида алюминия в растворе.
Решите:
Смесь
алюминия, оксида алюминия и карбида
алюминия полностью реагирует с 120,61 мл
20%-го раствора соляной кислоты (=1,15
г/мл), при этом выделяется 6,72 л смеси
газов с относительной плотностью по
гелию 1,9. Определите массовые доли
компонентов в исходной смеси, массовую
долю хлорида алюминия в растворе.Какой объем 15%-го раствора сульфида натрия (=1,176 г/мл) вступит в реакцию с 73,5 мл 10%-го раствора хлорида алюминия (=1,09 г/мл)? 0,06 моль 0,09 моль
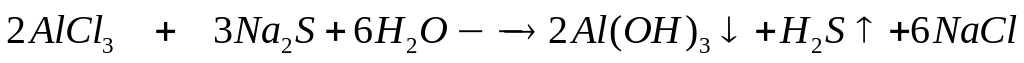 2
моль 3 моль
133,5 г/моль 78
г/моль
2
моль 3 моль
133,5 г/моль 78
г/моль
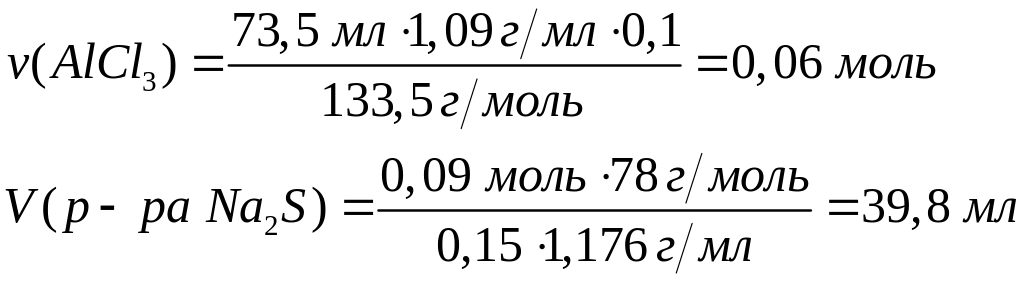 Решите:
Какой
объем 16%-го раствора сульфида натрия
(=1,189 г/мл) вступит
в реакцию с 54,5 мл 14%-го раствора нитрата
алюминия (=1,117 г/мл)?
Решите:
Какой
объем 16%-го раствора сульфида натрия
(=1,189 г/мл) вступит
в реакцию с 54,5 мл 14%-го раствора нитрата
алюминия (=1,117 г/мл)?Какой объем 20%-го раствора сульфата алюминия (=1,203 г/мл) вступит в реакцию с 73,2 мл 15%-го раствора карбоната натрия (=1,16 г/мл)? 0,04 моль 0,12 моль
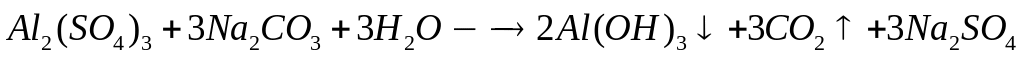 1
моль 3 моль
342 г/моль 106
г/моль
1
моль 3 моль
342 г/моль 106
г/моль
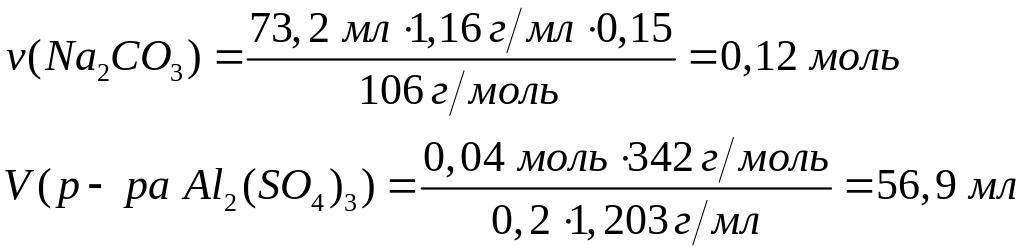 Решите:
Какой
объем 16%-го раствора хлорида алюминия
(=1,149 г/мл) вступит
в реакцию с 59 мл 18%-го раствора карбоната
калия (=1,17 г/мл)?
Решите:
Какой
объем 16%-го раствора хлорида алюминия
(=1,149 г/мл) вступит
в реакцию с 59 мл 18%-го раствора карбоната
калия (=1,17 г/мл)?Какой объем 10%-го раствора аммиака (=0,956 г/мл) вступит в реакцию с 72,5 мл 20%-го раствора нитрата алюминия (=1,176 г/мл)?
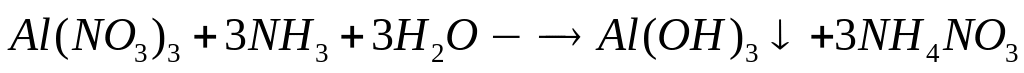 1
моль 3 моль
213 г/моль 17
г/моль
1
моль 3 моль
213 г/моль 17
г/моль
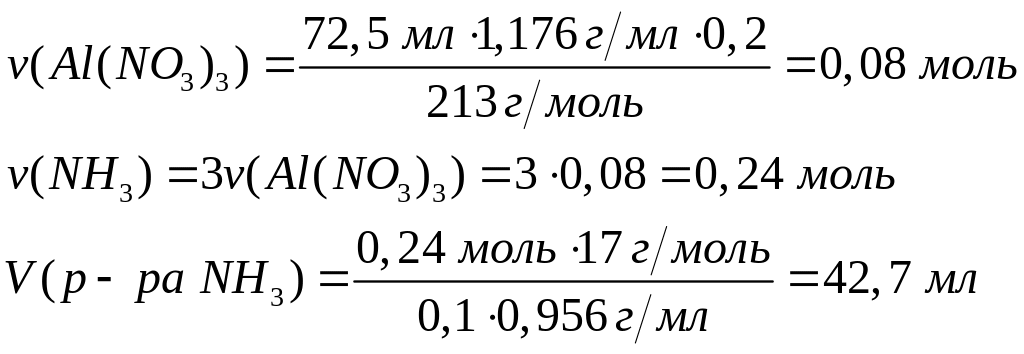 Решите:
Какой
объем 12%-го раствора аммиака (=0,95
г/мл) вступит в реакцию с 43,6 мл 16%-го
раствора хлорида алюминия (=1,149
г/мл)?
Решите:
Какой
объем 12%-го раствора аммиака (=0,95
г/мл) вступит в реакцию с 43,6 мл 16%-го
раствора хлорида алюминия (=1,149
г/мл)?Вычислите массовые доли веществ в растворе, полученном при взаимодействии 86,3 мл 14%-го раствора сульфата алюминия (=1,133 г/мл) с 115,6 мл 22%-го раствора хлорида бария (=1,227 г/мл). 0,04 моль 0,12 моль 0,08 моль 0,12 моль
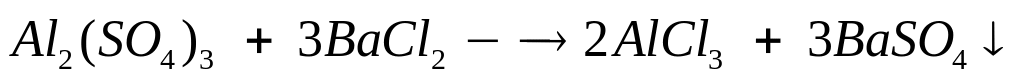 1
моль 3 моль 2 моль 3 моль
342
г/моль 208 г/моль 133,5 г/моль 208
г/моль
1
моль 3 моль 2 моль 3 моль
342
г/моль 208 г/моль 133,5 г/моль 208
г/моль
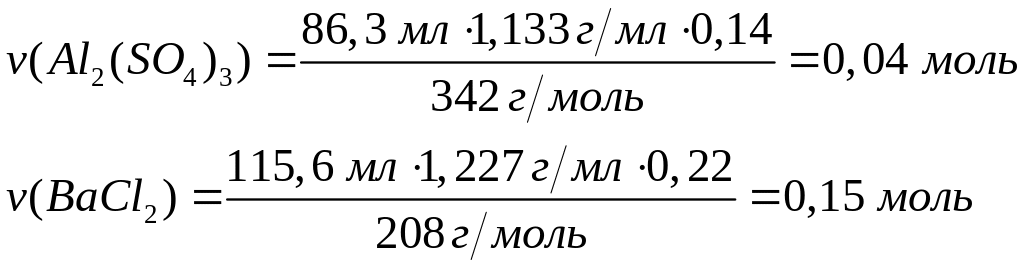 Сульфат
алюминия реагирует полностью, а в
растворе после реакции содержится 0,08
моль хлорида алюминия и 0,03 моль хлорида
бария.
Сульфат
алюминия реагирует полностью, а в
растворе после реакции содержится 0,08
моль хлорида алюминия и 0,03 моль хлорида
бария.
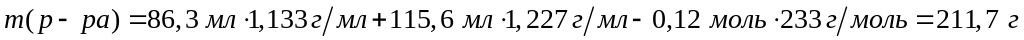
 Решите:
Вычислите
массовые доли веществ в растворе,
полученном при взаимодействии 58,1 мл
16%-го раствора хлорида алюминия (=1,149
г/мл) со 123,88 мл 30%-го раствора нитрата
свинца (=1,336 г/мл).
Решите:
Вычислите
массовые доли веществ в растворе,
полученном при взаимодействии 58,1 мл
16%-го раствора хлорида алюминия (=1,149
г/мл) со 123,88 мл 30%-го раствора нитрата
свинца (=1,336 г/мл).Какой объем раствора нитрата алюминия концентрацией 1,8 моль (=1,28 г/мл) необходимо добавить к 300 мл воды, чтобы получить 10%-ый раствор нитрата алюминия? Пусть
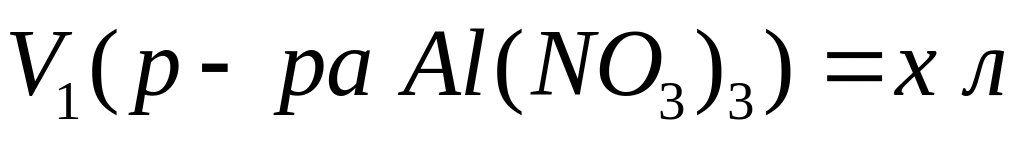 (1000х мл) и в этом растворе
(1000х мл) и в этом растворе
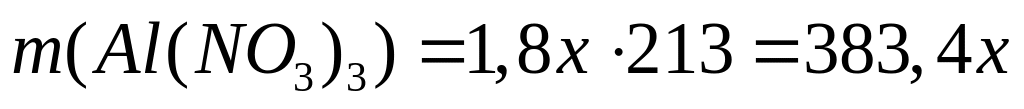 (г)
(г)
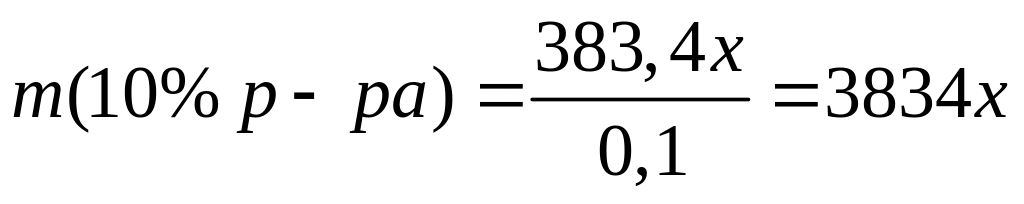 (г)
(г)
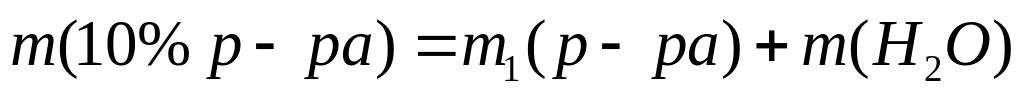
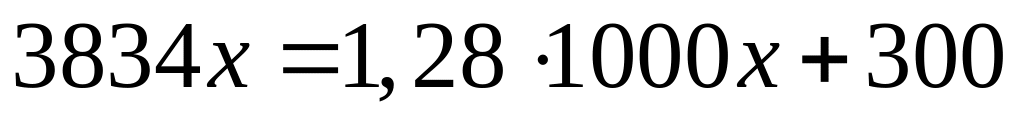
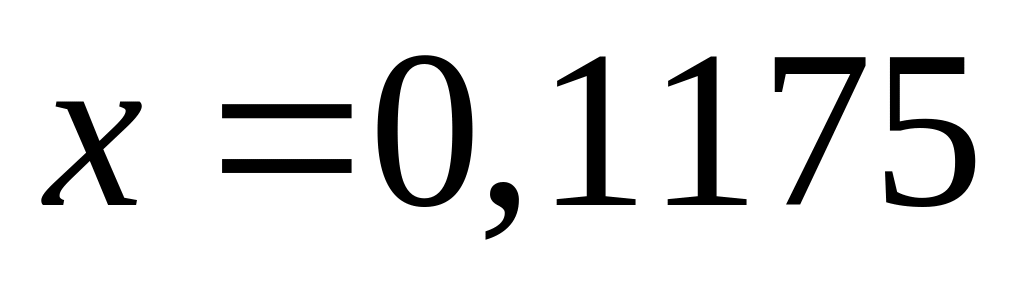
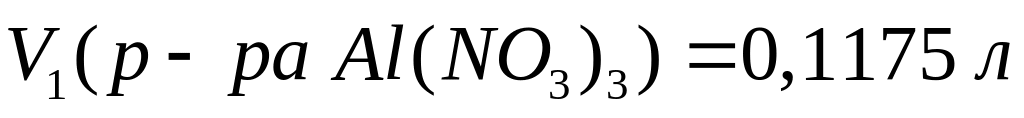 (117,5 мл)
Решите:
Какой объем
раствора сульфата алюминия концентрацией
0,944 моль (=1,292 г/мл)
необходимо добавить к 200 мл воды, чтобы
получить 15%-ый раствор нитрата алюминия?
(117,5 мл)
Решите:
Какой объем
раствора сульфата алюминия концентрацией
0,944 моль (=1,292 г/мл)
необходимо добавить к 200 мл воды, чтобы
получить 15%-ый раствор нитрата алюминия?Сколько по массе необходимо растворить в 500 мл 12%-го раствора нитрата алюминия (=1,099 г/мл), чтобы получить раствор нитрата алюминия концентрацией 1,103 моль/л (=1,176 г/мл)?
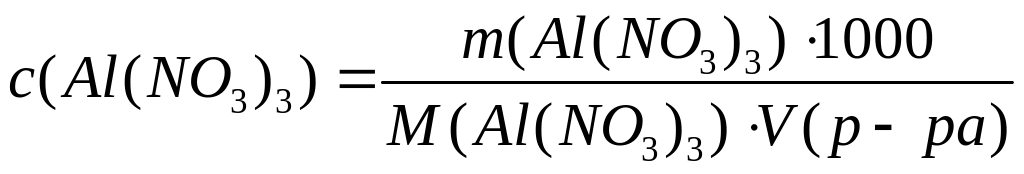 (объем в мл)
1 моль 1 моль
375 г/моль
213 г/моль
(объем в мл)
1 моль 1 моль
375 г/моль
213 г/моль
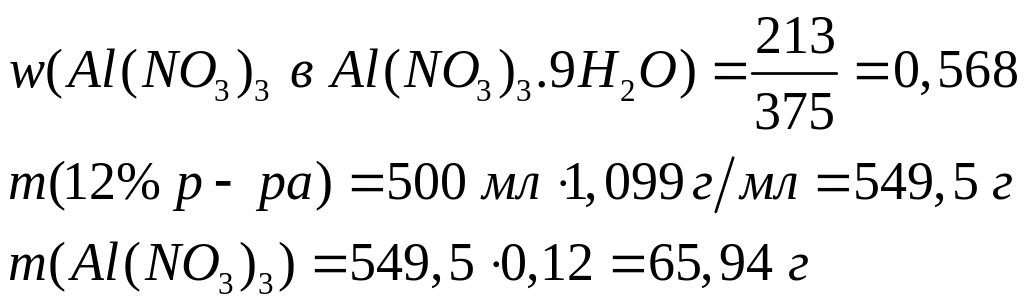
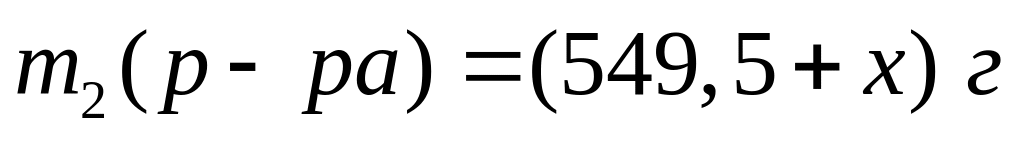 ,
где
,
где

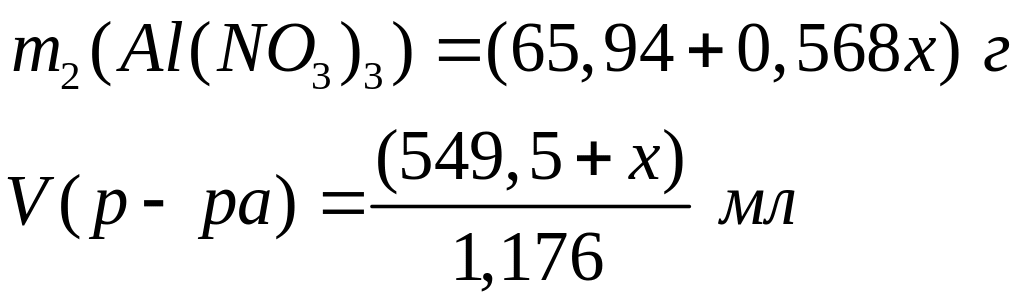
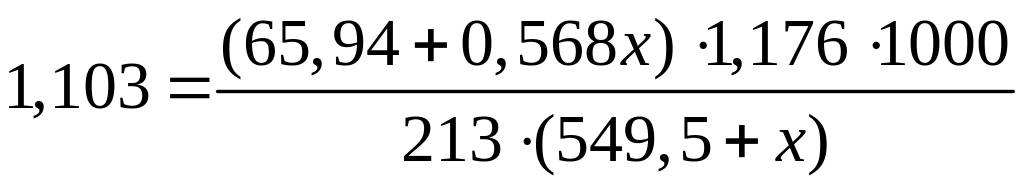
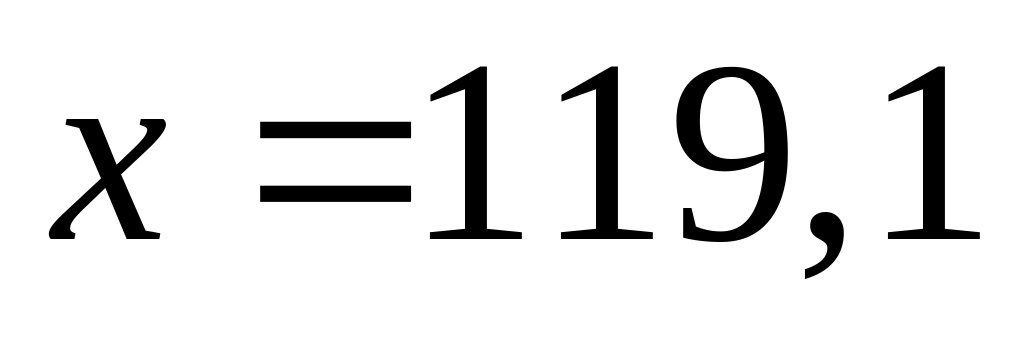
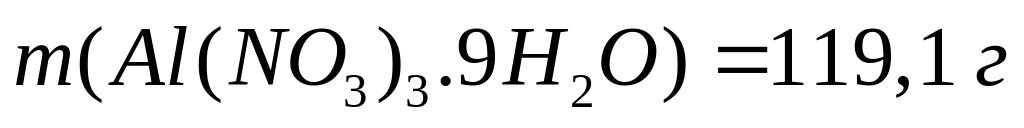 Решите:
Сколько
по массе
необходимо растворить в 300 мл 6%-го
раствора хлорида алюминия (=1,052
г/мл), чтобы получить раствор хлорида
алюминия концентрацией 1,377 моль/л
(=1,149 г/мл)?
Решите:
Сколько
по массе
необходимо растворить в 300 мл 6%-го
раствора хлорида алюминия (=1,052
г/мл), чтобы получить раствор хлорида
алюминия концентрацией 1,377 моль/л
(=1,149 г/мл)?При растворении в 250 мл 10%-го раствора сульфата алюминия (=1,105 г/мл) 166,5 г
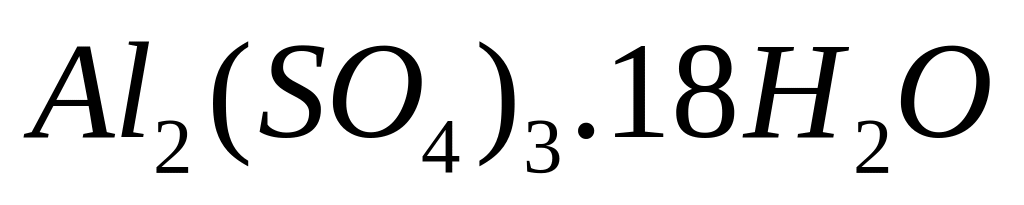 получили 339 мл раствора. Определите
молярную концентрацию сульфата алюминия
в растворе, плотность раствора.
получили 339 мл раствора. Определите
молярную концентрацию сульфата алюминия
в растворе, плотность раствора.
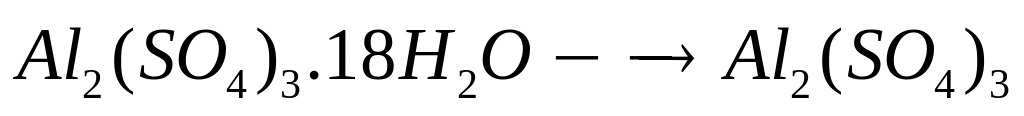 1 моль 1 моль
666 г/моль
342 г/моль
1 моль 1 моль
666 г/моль
342 г/моль
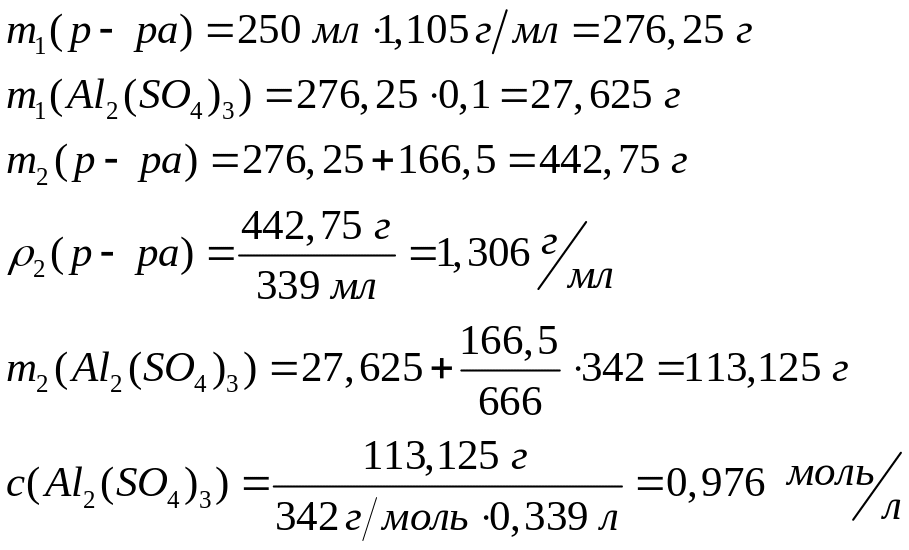 Решите:
При
растворении в 500 мл 8%-го раствора нитрата
алюминия (=1,063 г/мл)
284 г
получили 666 мл раствора. Определите
молярную концентрацию сульфата алюминия
в растворе, плотность раствора.
Решите:
При
растворении в 500 мл 8%-го раствора нитрата
алюминия (=1,063 г/мл)
284 г
получили 666 мл раствора. Определите
молярную концентрацию сульфата алюминия
в растворе, плотность раствора.При смешивании 400 мл 10%-го раствора нитрата алюминия (=1,081 г/мл) и 600 мл 20%-го раствора нитрата алюминия (=1,176 г/мл) получили раствор с плотностью 1,136 г/мл. Определите молярную концентрацию нитрата алюминия в конечном растворе.

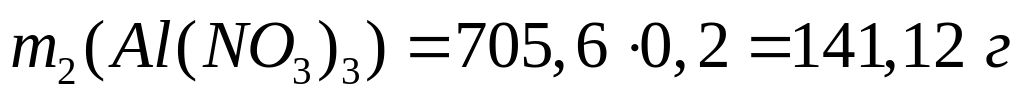
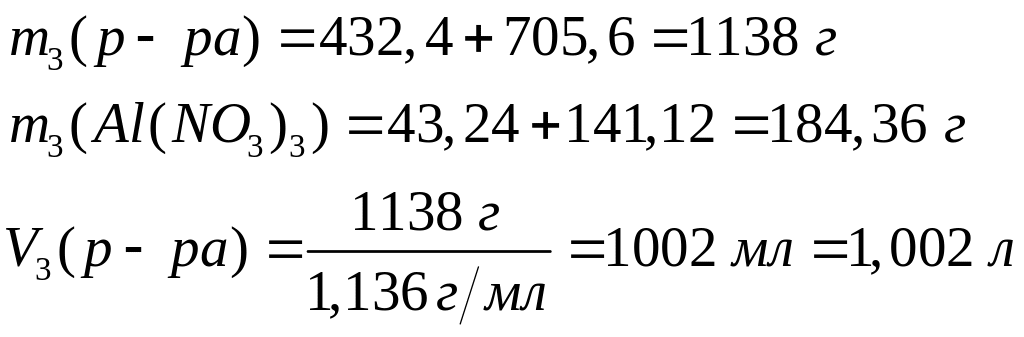
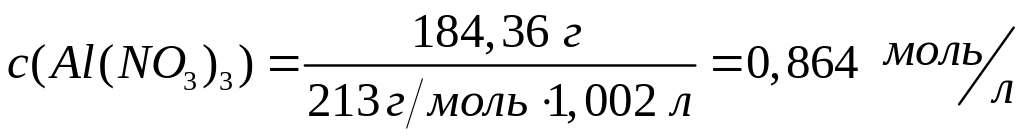 Решите:
При
смешивании 250 мл 8%-го раствора сульфата
алюминия (=1,083 г/мл)
и 500 мл 28%-го раствора сульфата алюминия
(=1,333 г/мл) получили
раствор с плотностью 1,252 г/мл. Определите
молярную концентрацию нитрата алюминия
в конечном растворе.
Решите:
При
смешивании 250 мл 8%-го раствора сульфата
алюминия (=1,083 г/мл)
и 500 мл 28%-го раствора сульфата алюминия
(=1,333 г/мл) получили
раствор с плотностью 1,252 г/мл. Определите
молярную концентрацию нитрата алюминия
в конечном растворе.Какова молярная концентрация 10%-го раствора бромида алюминия (=1,079 г/мл)?


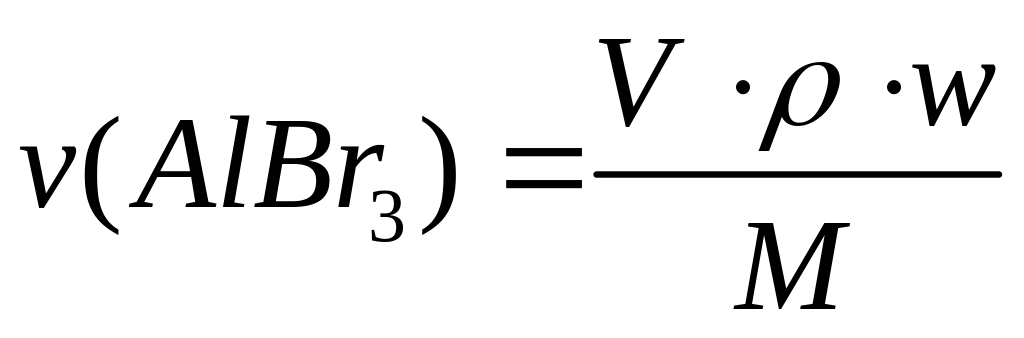 Пусть
Пусть
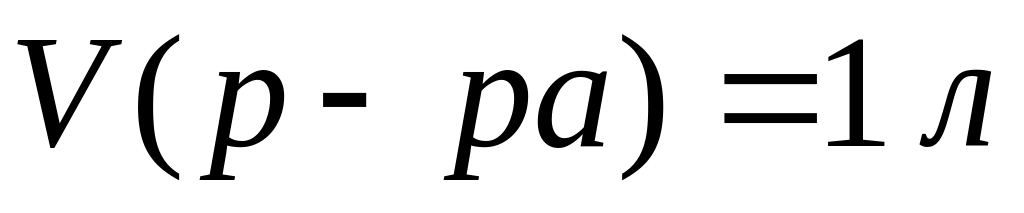 (1000 мл)
(1000 мл)
 Решите:
Какова
молярная концентрация 30%-го раствора
нитрата алюминия (=1,28
г/мл)?
Решите:
Какова
молярная концентрация 30%-го раствора
нитрата алюминия (=1,28
г/мл)?Какова массовая доля хлорида алюминия в растворе концентрацией 1,378 моль/л (=1,149 г/мл)? Пусть
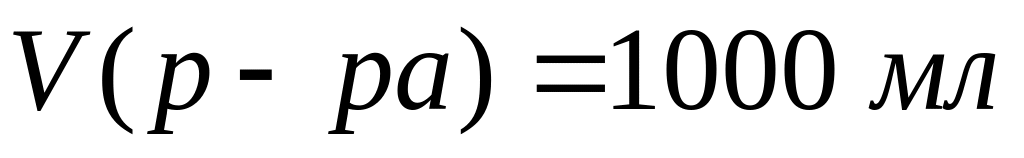 (1 л)
(1 л)
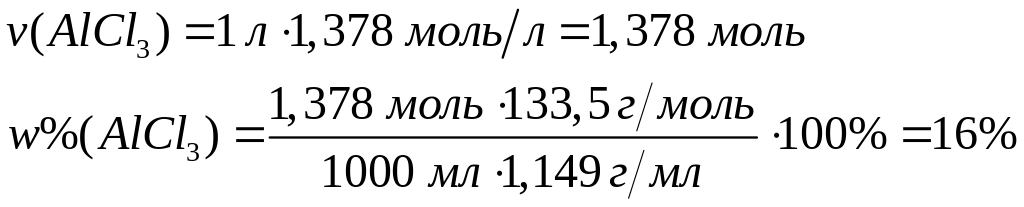 Решите:
Какова
массовая доля нитрата алюминия в
растворе концентрацией 1,361 моль/л
(=1,136 г/мл)?
Решите:
Какова
массовая доля нитрата алюминия в
растворе концентрацией 1,361 моль/л
(=1,136 г/мл)?Какой объем 10%-го раствора нитрата алюминия (=1,099 г/мл) и сколько по массе необходимо для приготовления 500 мл раствора нитрата алюминия концентрацией 0,8 моль/л (=1,127 г/мл)? Пусть
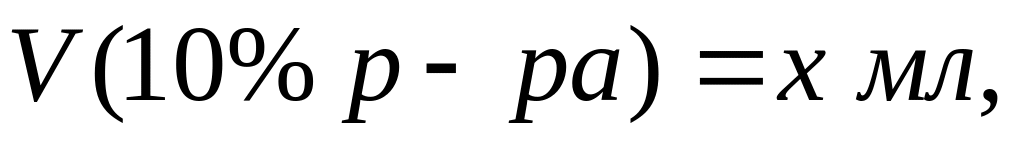
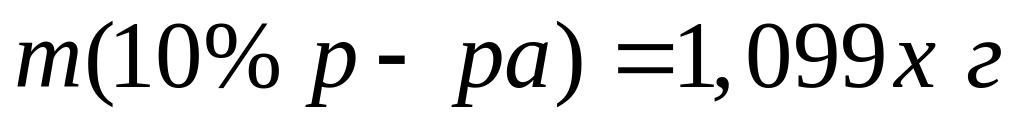 а
а
 у моль у моль
1 моль 1 моль
375 г/моль
213 г/моль
у моль у моль
1 моль 1 моль
375 г/моль
213 г/моль
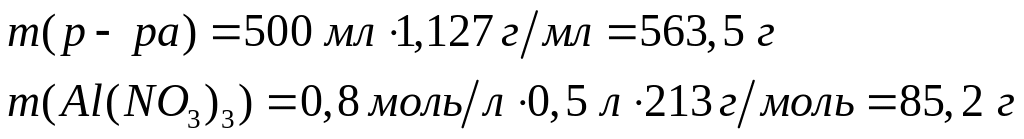
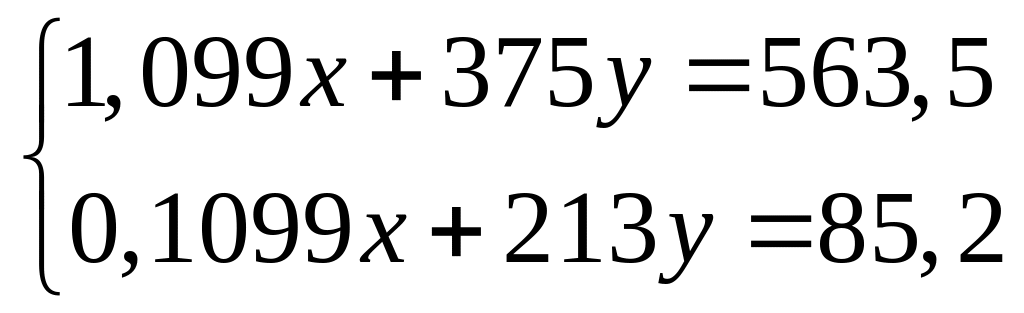
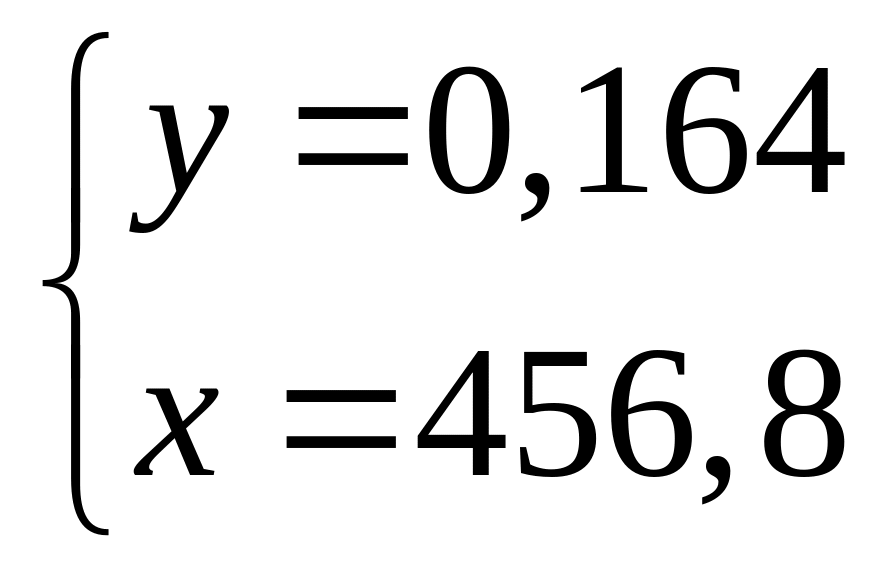
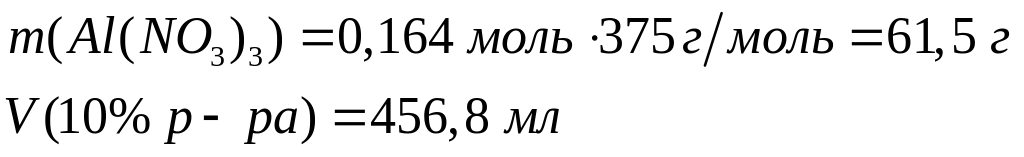 Решите:
Какой
объем 12%-го раствора сульфата алюминия
(=1,129 г/мл) и сколько
по массе
необходимо для приготовления 750 мл
раствора нитрата алюминия концентрацией
0,944 моль/л (=1,292
г/мл)?
Решите:
Какой
объем 12%-го раствора сульфата алюминия
(=1,129 г/мл) и сколько
по массе
необходимо для приготовления 750 мл
раствора нитрата алюминия концентрацией
0,944 моль/л (=1,292
г/мл)?Нонагидрат нитрата алюминия массой 85,14 г растворили в 250 мл раствора нитрата алюминия (=1,117 г/мл). Массовая доля нитрата алюминия в полученном растворе увеличилась на 10%. Вычислите массовую долю нитрата алюминия в исходном растворе. 1 моль 1 моль 375 г/моль 213 г/моль
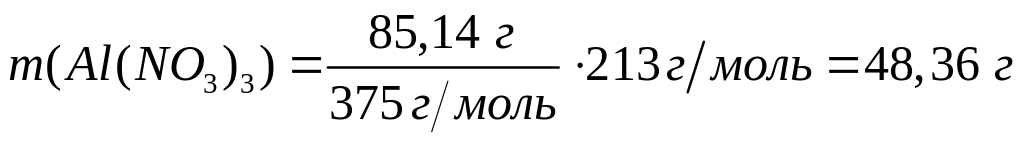 Пусть
Пусть
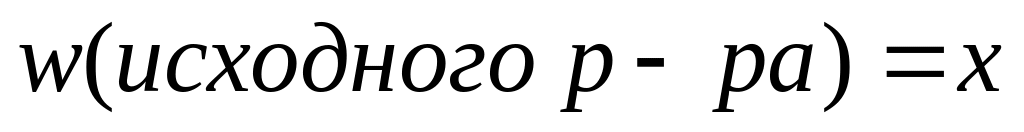 ,
,
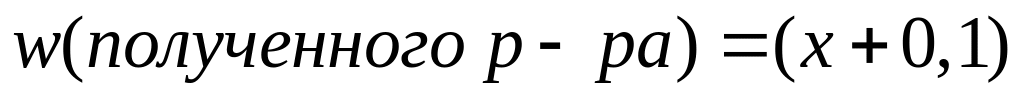 .
.

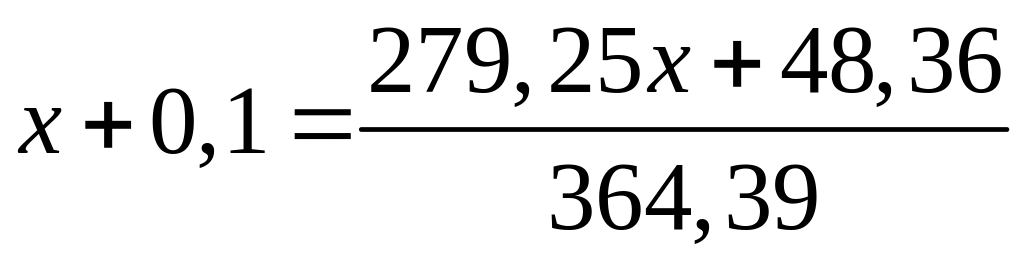
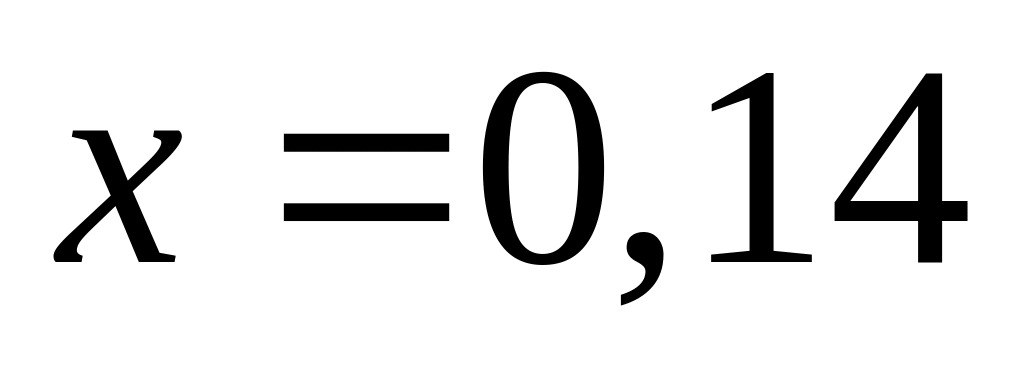
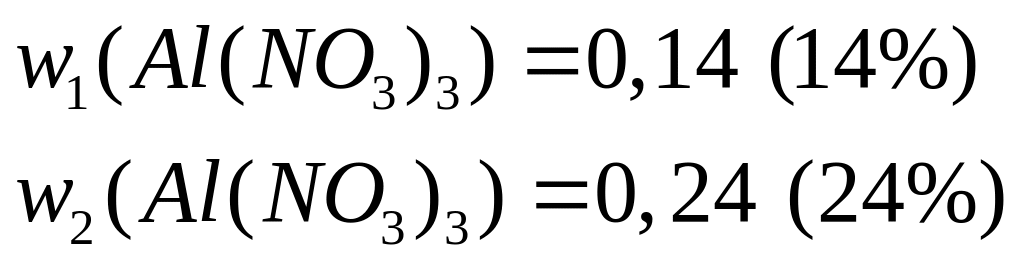 Решите:
Гексагидрат
хлорида алюминия массой 180,4 г растворили
в 300 мл раствора хлорида алюминия
(=1,071 г/мл). Массовая
доля хлорида алюминия в полученном
растворе увеличилась на 10%. Вычислите
массовую долю хлорида алюминия в
исходном растворе.
Решите:
Гексагидрат
хлорида алюминия массой 180,4 г растворили
в 300 мл раствора хлорида алюминия
(=1,071 г/мл). Массовая
доля хлорида алюминия в полученном
растворе увеличилась на 10%. Вычислите
массовую долю хлорида алюминия в
исходном растворе.Смесь сульфатов меди (II) и алюминия растворили в воде и получили 50 мл раствора. 25 мл раствора обработали избытком раствора гидроксида натрия, полученный осадок отфильтровали и прокалили. Масса твердого остатка составила 1,2 г. 25 мл раствора обработали избытком раствора гидрата аммиака, полученный осадок отфильтровали и прокалили. Масса твердого остатка составила 2,04 г. Вычислите молярные концентрации сульфатов в исходном растворе.
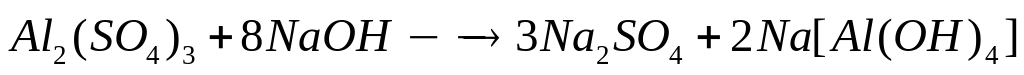
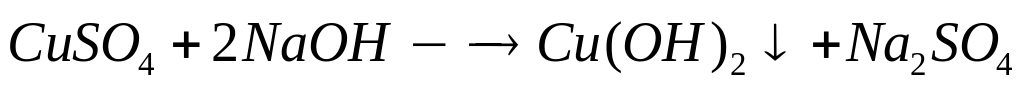 1
моль 1 моль
1
моль 1 моль
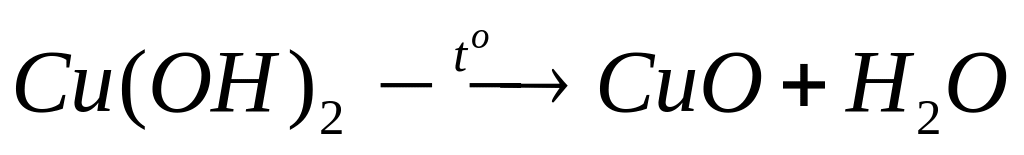 1 моль 1 моль
80
г/моль
1 моль 1 моль
80
г/моль
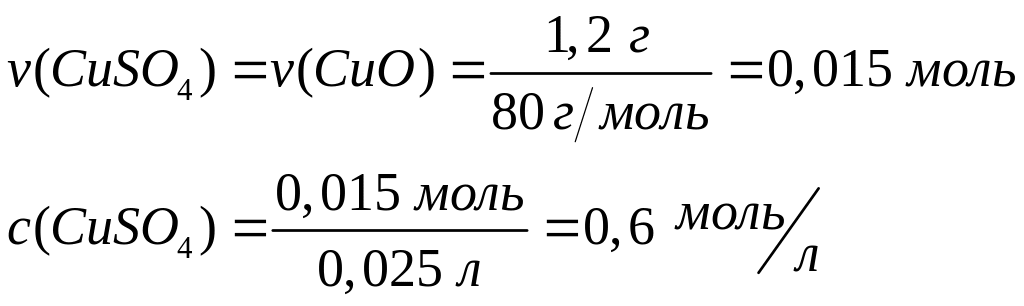
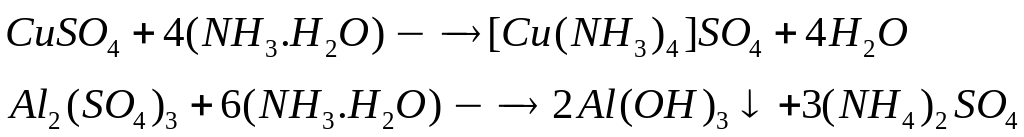 1 моль 2 моль
2 моль 1 моль
102 г/моль
1 моль 2 моль
2 моль 1 моль
102 г/моль
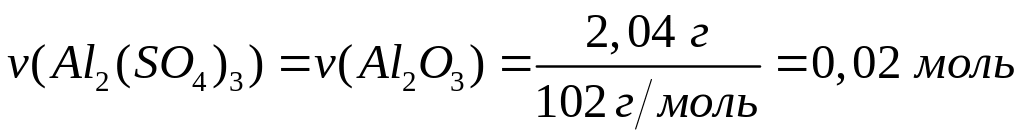
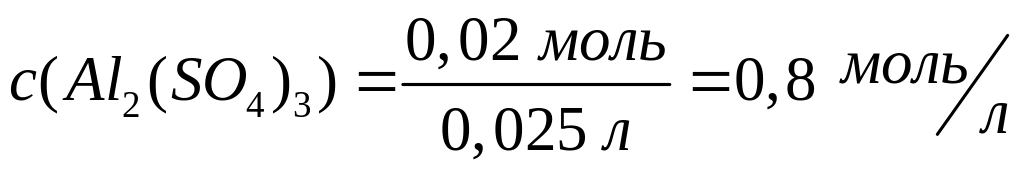 Решите:
Смесь
нитратов меди (II) и алюминия
растворили в воде и получили 60 мл
раствора. 30 мл раствора обработали
избытком раствора гидроксида натрия,
полученный осадок отфильтровали и
прокалили. Масса твердого остатка
составила 1,6 г. 30 мл раствора обработали
избытком раствора гидрата аммиака,
полученный осадок отфильтровали и
прокалили. Масса твердого остатка
составила 3,06 г. Вычислите молярные
концентрации нитратов в исходном
растворе.
Решите:
Смесь
нитратов меди (II) и алюминия
растворили в воде и получили 60 мл
раствора. 30 мл раствора обработали
избытком раствора гидроксида натрия,
полученный осадок отфильтровали и
прокалили. Масса твердого остатка
составила 1,6 г. 30 мл раствора обработали
избытком раствора гидрата аммиака,
полученный осадок отфильтровали и
прокалили. Масса твердого остатка
составила 3,06 г. Вычислите молярные
концентрации нитратов в исходном
растворе.К 10 мл олеума, содержащего 20% серного ангидрида и имеющего плотность 1,9 г/мл, осторожно прилили 81 мл воды. Вычислите массовую долю серной кислоты в полученном растворе. Сколько по массе алюминия можно растворить в полученном растворе?
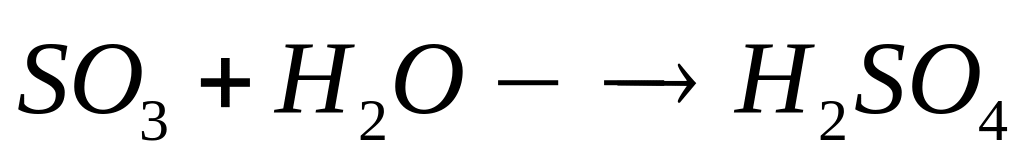 1
моль 1 моль
80 г/моль 98
г/моль
1
моль 1 моль
80 г/моль 98
г/моль

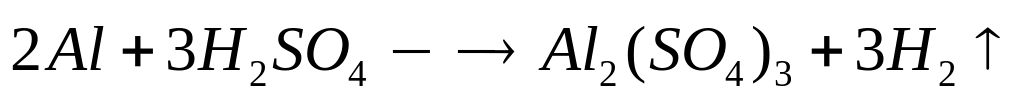 2
моль 3 моль
27 г/моль
2
моль 3 моль
27 г/моль
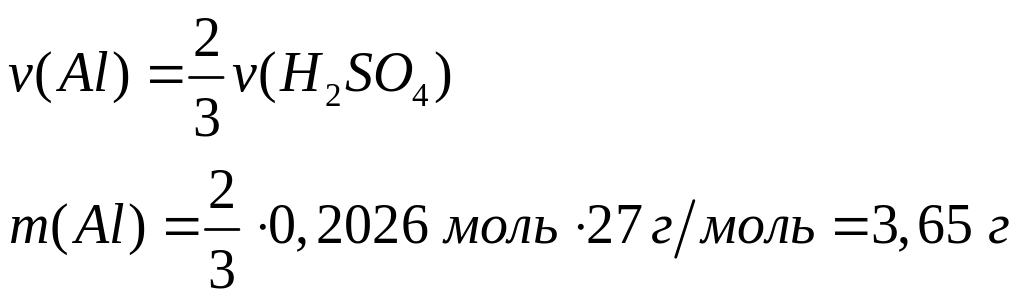 Решите:
К
7,8 г 20%-го олеума добавили 100 г 12,25%-го
раствора серной кислоты. Какова массовая
доля серной кислоты в полученном
растворе? Сколько по массе карбида
алюминия Al4C3
вступит в реакцию с полученным раствором?
Решите:
К
7,8 г 20%-го олеума добавили 100 г 12,25%-го
раствора серной кислоты. Какова массовая
доля серной кислоты в полученном
растворе? Сколько по массе карбида
алюминия Al4C3
вступит в реакцию с полученным раствором?Какой максимальный объем 25%-го раствора гидроксида натрия (=1,28 г/мл) вступит в реакцию с 58,1 мл 16%-го раствора хлорида алюминия (=1,149 г/мл)?
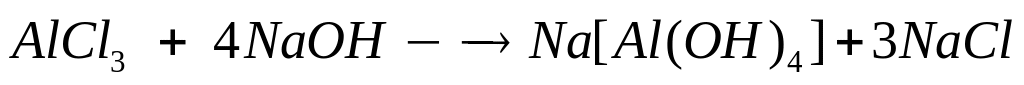 1
моль 4 моль
133,5 г/моль 40
г/моль
1
моль 4 моль
133,5 г/моль 40
г/моль
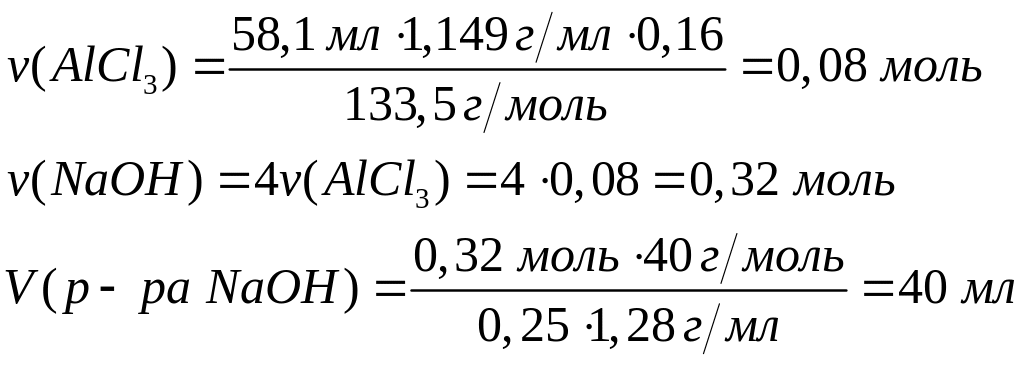 Решите:
Какой
максимальный объем 30%-го раствора
гидроксида натрия (=1,33
г/мл) вступит в реакцию с 55,8 мл 20%-го
раствора сульфата алюминия (=1,226
г/мл)?
Решите:
Какой
максимальный объем 30%-го раствора
гидроксида натрия (=1,33
г/мл) вступит в реакцию с 55,8 мл 20%-го
раствора сульфата алюминия (=1,226
г/мл)?Какой объем 25%-го раствора гидроксида калия (=1,24 г/мл) вступит в реакцию с 6,48 г алюминия?
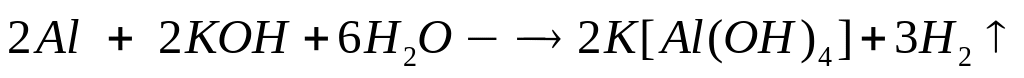 2
моль 2 моль
27 г/моль 56 г/моль
2
моль 2 моль
27 г/моль 56 г/моль
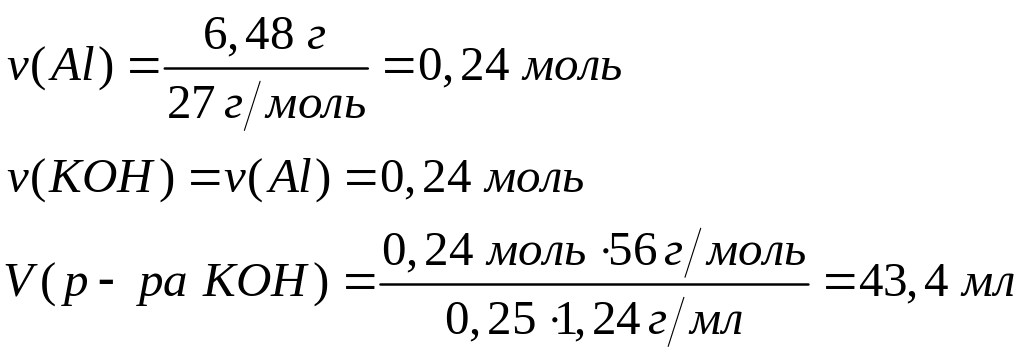 Решите:
Какой
объем 30%-го раствора гидроксида калия
(=1,29 г/мл) вступит
в реакцию с 8,775 г алюминия?
Решите:
Какой
объем 30%-го раствора гидроксида калия
(=1,29 г/мл) вступит
в реакцию с 8,775 г алюминия?Для полного растворения смеси хлорида алюминия и карбида алюминия необходимо 112,5 мл 25%-го раствора гидроксида натрия (=1,28 г/мл). При этом выделяется 5,04 л газа. Вычислите число атомов алюминия в исходной смеси. 0,075 моль 0,3 моль 0,225 моль
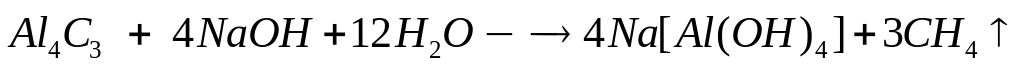 1
моль 4 моль
3 моль
40 г/моль
22,4 л/моль
1
моль 4 моль
3 моль
40 г/моль
22,4 л/моль
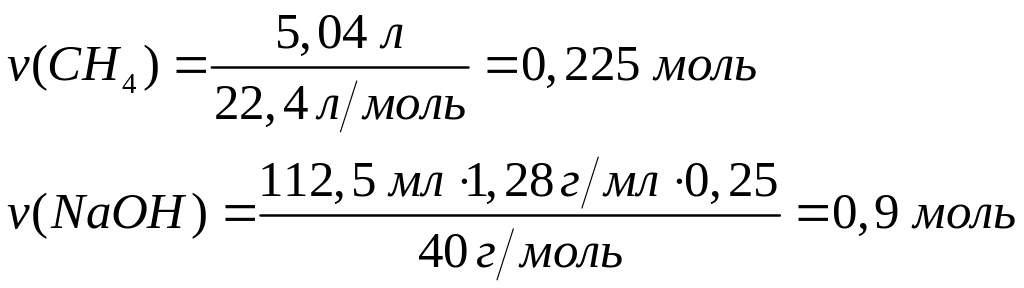 0,15
моль 0,6 моль
1
моль 4 моль
0,15
моль 0,6 моль
1
моль 4 моль
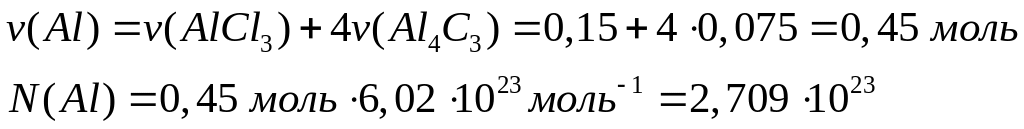 Решите:
Для
полного растворения смеси сульфида
алюминия и карбида алюминия необходимо
99,55 мл 20%-го раствора соляной кислоты
(=1,1 г/мл). При этом
выделяется 5,04 л газа. Вычислите число
атомов алюминия в исходной смеси.
Решите:
Для
полного растворения смеси сульфида
алюминия и карбида алюминия необходимо
99,55 мл 20%-го раствора соляной кислоты
(=1,1 г/мл). При этом
выделяется 5,04 л газа. Вычислите число
атомов алюминия в исходной смеси.Через раствор, полученный при взаимодействии 80,0 мл раствора хлорида алюминия
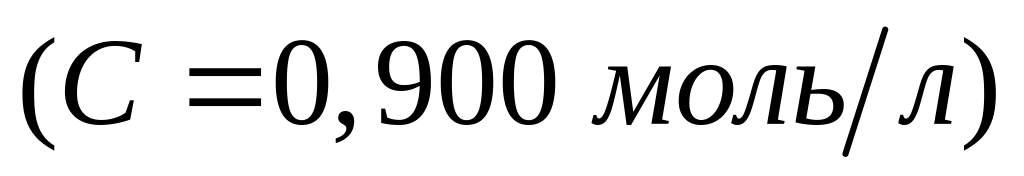 и 32 мл раствора гидроксида натрия
и 32 мл раствора гидроксида натрия
 ,
пропустили 5,6 л смеси бромоводорода с
водородом, имеющую относительную
плотность по гелию 4,45. Вычислите массу
образовавшегося осадка.
,
пропустили 5,6 л смеси бромоводорода с
водородом, имеющую относительную
плотность по гелию 4,45. Вычислите массу
образовавшегося осадка.
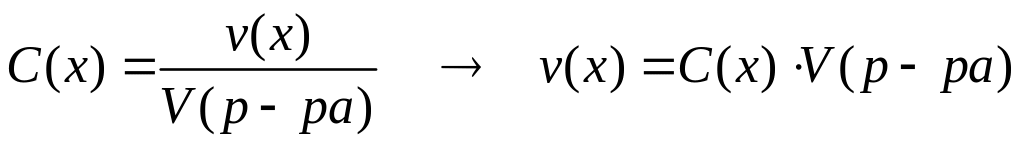
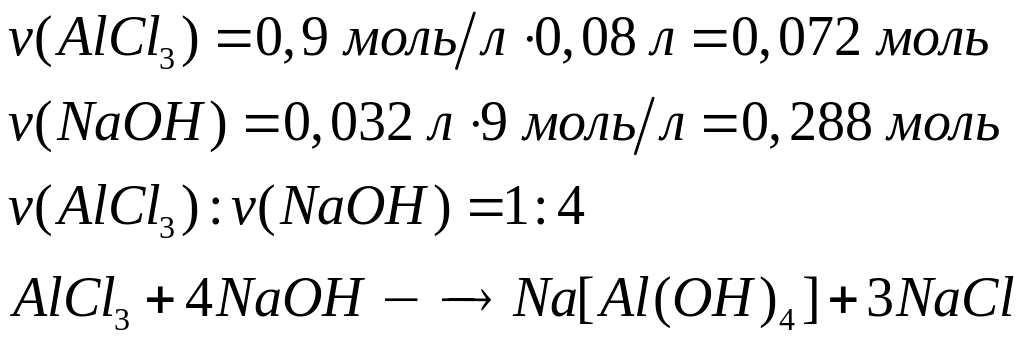 1
моль 4 моль 1 моль
1
моль 4 моль 1 моль
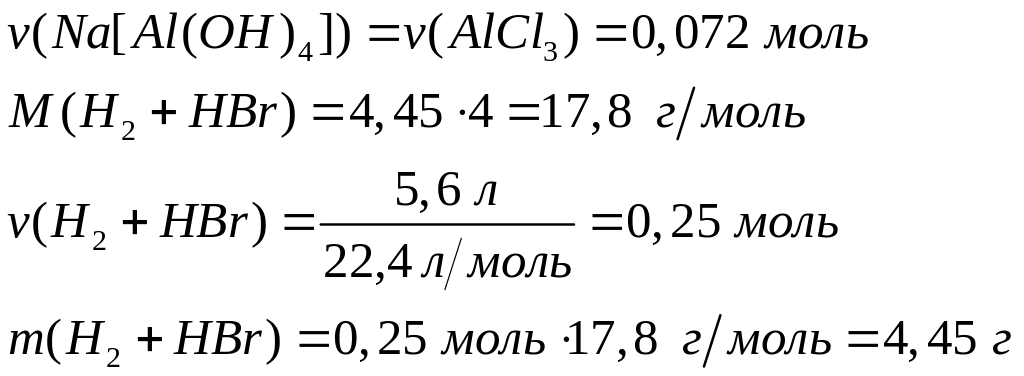 Пусть
Пусть
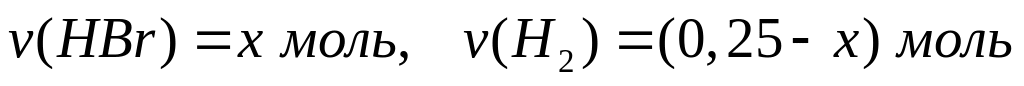
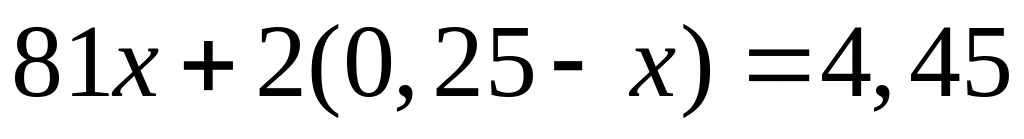
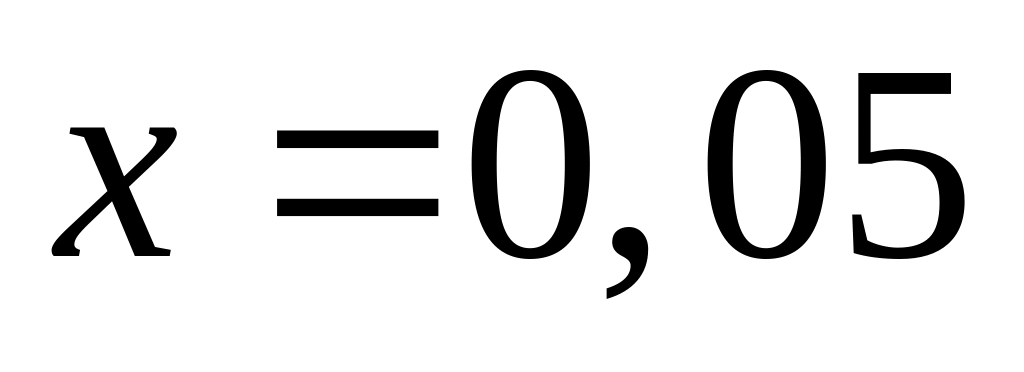
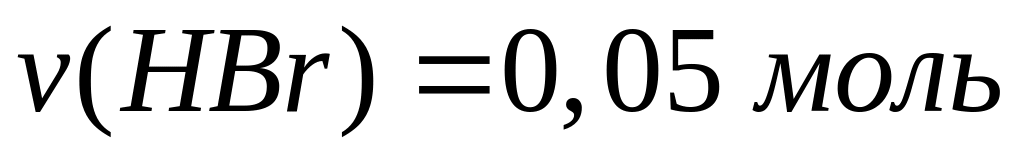 0,05 моль 0,05 моль 0,05 моль
0,05 моль 0,05 моль 0,05 моль
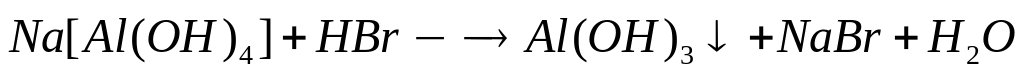 1 моль 1 моль 1 моль
78 г/моль
1 моль 1 моль 1 моль
78 г/моль
 Решите:
Через
раствор, полученный при взаимодействии
50,0 мл раствора сульфата алюминия
Решите:
Через
раствор, полученный при взаимодействии
50,0 мл раствора сульфата алюминия
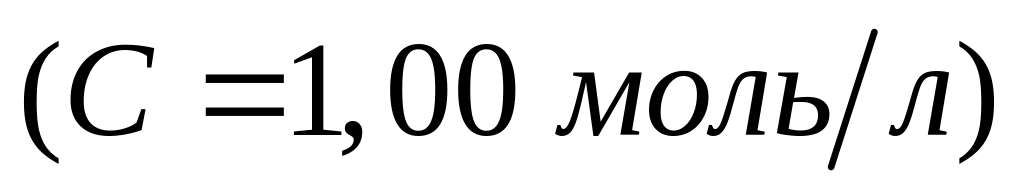 и 25 мл раствора гидроксида калия
и 25 мл раствора гидроксида калия
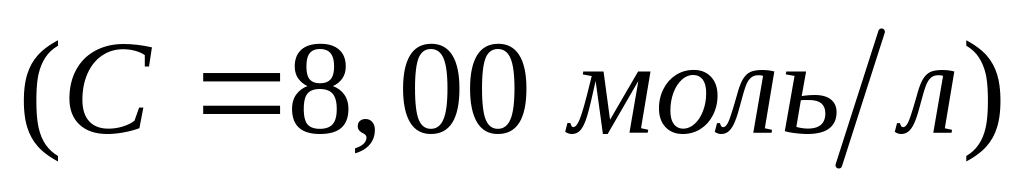 ,
пропустили 16,8 л смеси хлороводорода с
водородом, имеющей относительную
плотность по гелию 6,25. Вычислите массовые
доли веществ в конечном растворе.
,
пропустили 16,8 л смеси хлороводорода с
водородом, имеющей относительную
плотность по гелию 6,25. Вычислите массовые
доли веществ в конечном растворе.К 14,6%-ному раствору соляной кислоты добавили сульфид алюминия, масса которого составила 1/10 от массы раствора соляной кислоты. Вычислите массовую долю хлорида алюминия в растворе. Пусть
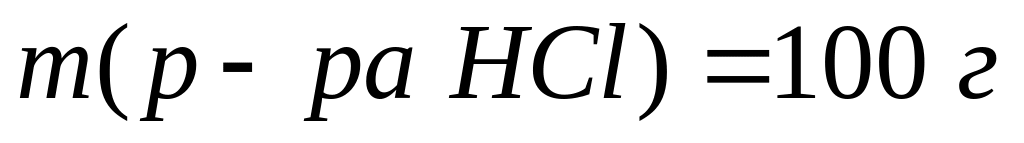
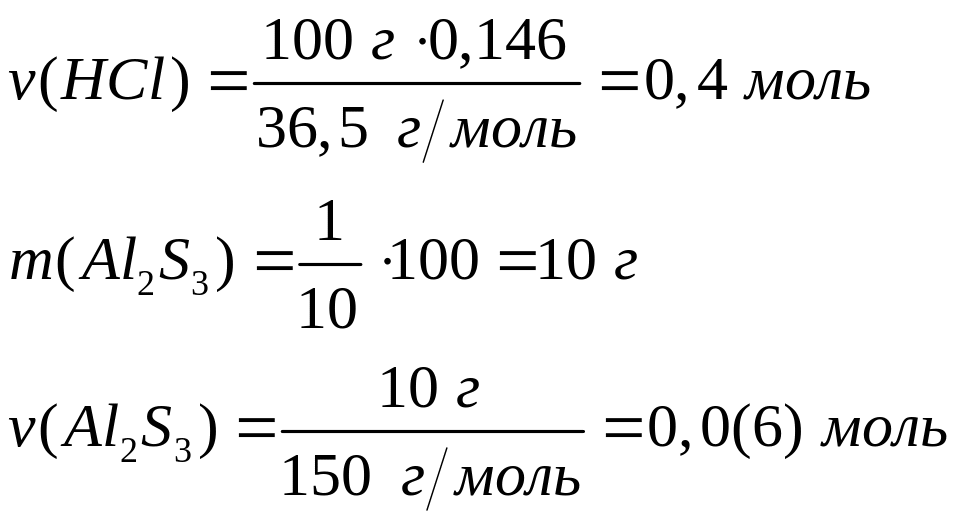
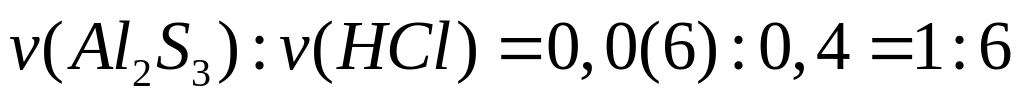 ,
вещества реагируют полностью.
0,0(6)
моль 0,4 моль 0,1(3) моль 0,1(9) моль
,
вещества реагируют полностью.
0,0(6)
моль 0,4 моль 0,1(3) моль 0,1(9) моль
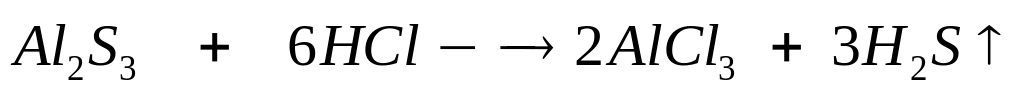 1
моль 6 моль 2 моль 3 моль
133,5 г/моль 34 г/моль
1
моль 6 моль 2 моль 3 моль
133,5 г/моль 34 г/моль
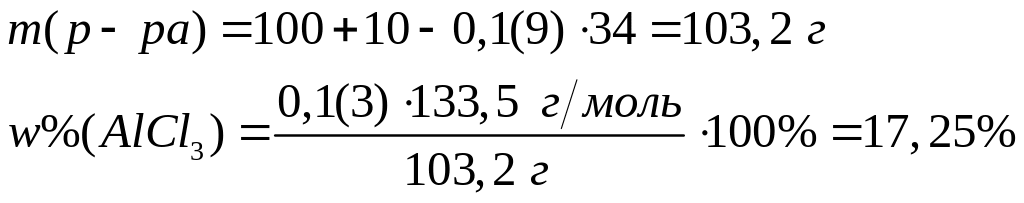 Решите:
К
18,9%-ному раствору азотной кислоты
добавили карбид алюминия, масса которого
составила 1/27,(7) от массы раствора азотной
кислоты. Вычислите массовую долю нитрата
алюминия в растворе.
Решите:
К
18,9%-ному раствору азотной кислоты
добавили карбид алюминия, масса которого
составила 1/27,(7) от массы раствора азотной
кислоты. Вычислите массовую долю нитрата
алюминия в растворе.Смесь, содержащая соляную кислоту и хлорид алюминия, объемом 10,0 мл полностью реагирует с 5 мл раствора аммиака концентрацией 5 моль/л. В результате реакции образуется 0,39 г осадка. Вычислите молярные концентрации веществ в исходном растворе.
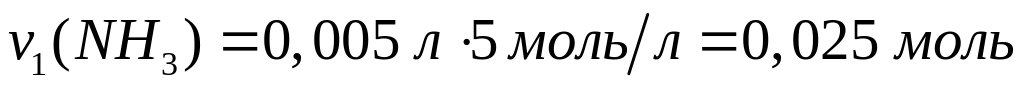
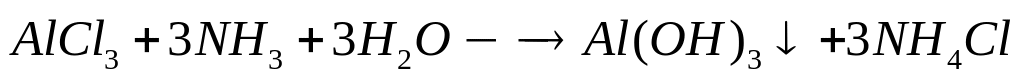 1
моль 3 моль 1 моль
78 г/моль
1
моль 3 моль 1 моль
78 г/моль
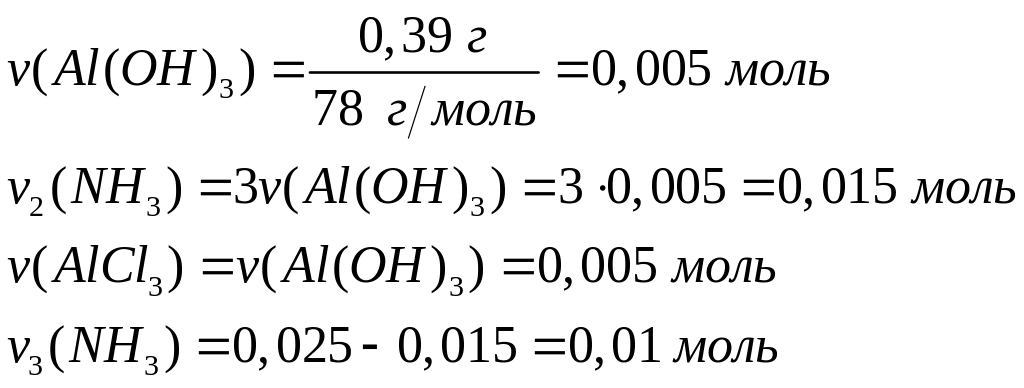
 1
моль 1 моль
1
моль 1 моль

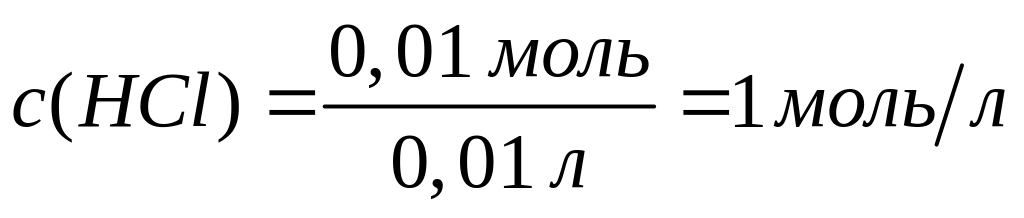
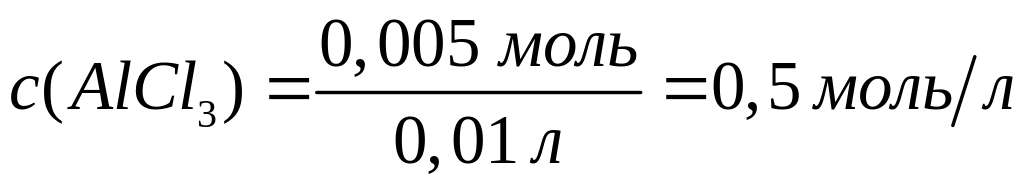 Решите:
Смесь,
содержащая азотную кислоту и нитрат
алюминия, объемом 20,0 мл полностью
реагирует с 27,5 мл раствора аммиака
концентрацией 10 моль/л. В результате
реакции образуется 5,85 г осадка. Вычислите
молярные концентрации веществ в исходном
растворе.
Решите:
Смесь,
содержащая азотную кислоту и нитрат
алюминия, объемом 20,0 мл полностью
реагирует с 27,5 мл раствора аммиака
концентрацией 10 моль/л. В результате
реакции образуется 5,85 г осадка. Вычислите
молярные концентрации веществ в исходном
растворе.При полном окислении смеси формиата, ацетата и оксалата алюминия образуется 10,08 л углекислого газа (н.у.). Исходная смесь полностью реагирует с 153,4 мл 10%-го раствора гидроксида калия (=1,096 г/мл) с образованием гидроксида алюминия и соответствующих солей. Вычислите массу ацетата алюминия в смеси. х моль 3х моль
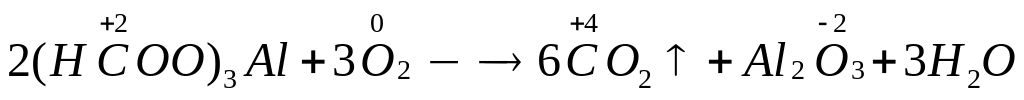
 6 моль
2 моль
у моль
6у моль
6 моль
2 моль
у моль
6у моль
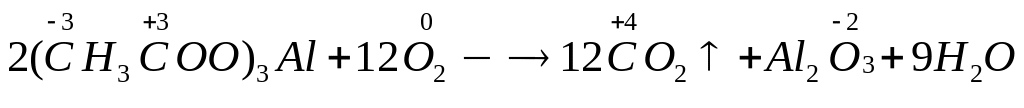
 12 моль
2 моль
z
моль 6z
моль
12 моль
2 моль
z
моль 6z
моль
 2 моль
2 моль
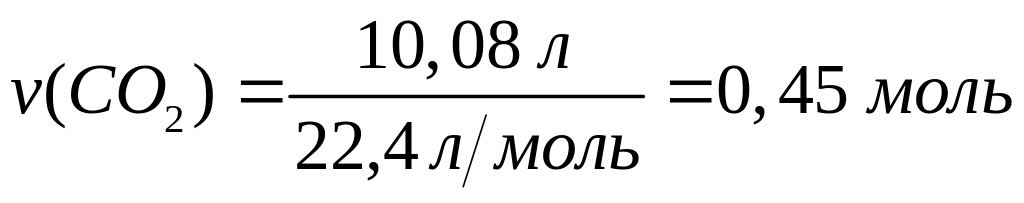 х моль 3х моль
х моль 3х моль
 1 моль 3 моль
56 г/моль
у моль 3у моль
1 моль 3 моль
56 г/моль
у моль 3у моль
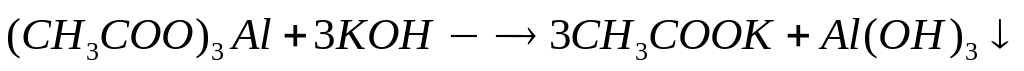 1 моль 3 моль
204 г/моль
z моль 6z
моль
1 моль 3 моль
204 г/моль
z моль 6z
моль
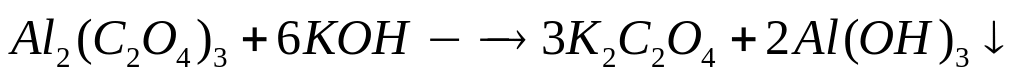 1 моль 6 моль
1 моль 6 моль
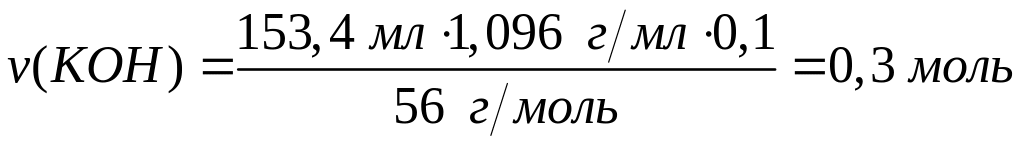
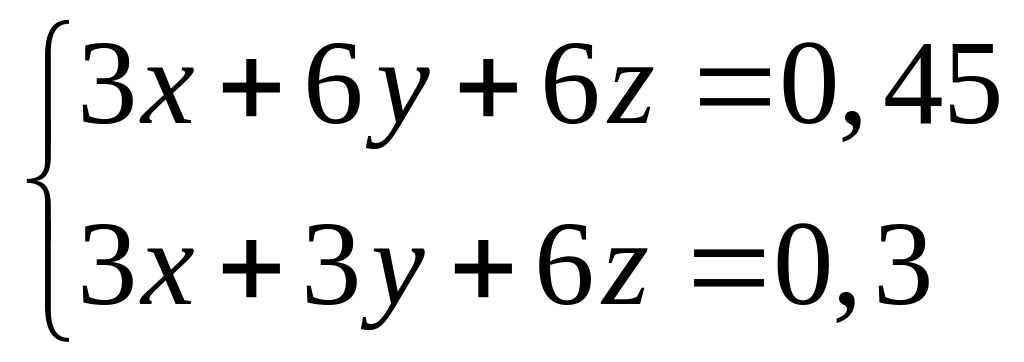

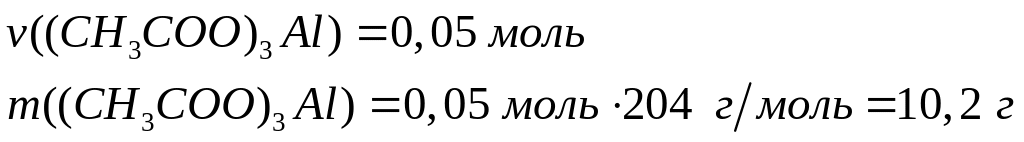 Решите:
При
полном окислении смеси формиата, ацетата
и оксалата железа (III)
образуется 8,064 л углекислого газа
(н.у.). Исходная смесь полностью реагирует
с 70,8 мл 12%-го раствора гидроксида натрия
(=1,13 г/мл) с образованием
гидроксида железа (III) и
соответствующих солей. Вычислите массу
ацетата железа (III) в
смеси.
Решите:
При
полном окислении смеси формиата, ацетата
и оксалата железа (III)
образуется 8,064 л углекислого газа
(н.у.). Исходная смесь полностью реагирует
с 70,8 мл 12%-го раствора гидроксида натрия
(=1,13 г/мл) с образованием
гидроксида железа (III) и
соответствующих солей. Вычислите массу
ацетата железа (III) в
смеси.Смесь алюминия и магния полностью прореагировала с хлором. Продукты реакции обработали 65,9 мл 20%-го раствора гидроксида калия (=1,19 г/мл). Осадок отфильтровали и прокалили, масса твердого остатка составила 2,4 г. Определите массовые доли металлов в смеси. 2 моль 2 моль 1 моль 1 моль
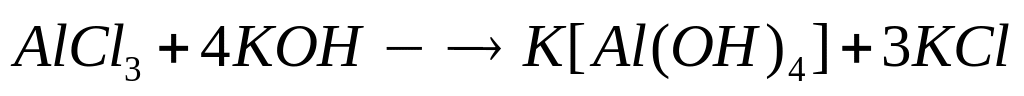 1
моль 4 моль
1
моль 4 моль
 1
моль 2 моль 1 моль
1
моль 2 моль 1 моль
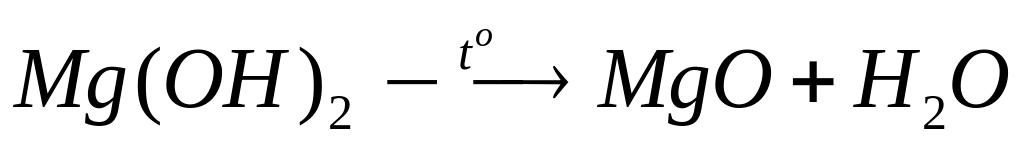 1 моль 1 моль
40 г/моль
1 моль 1 моль
40 г/моль
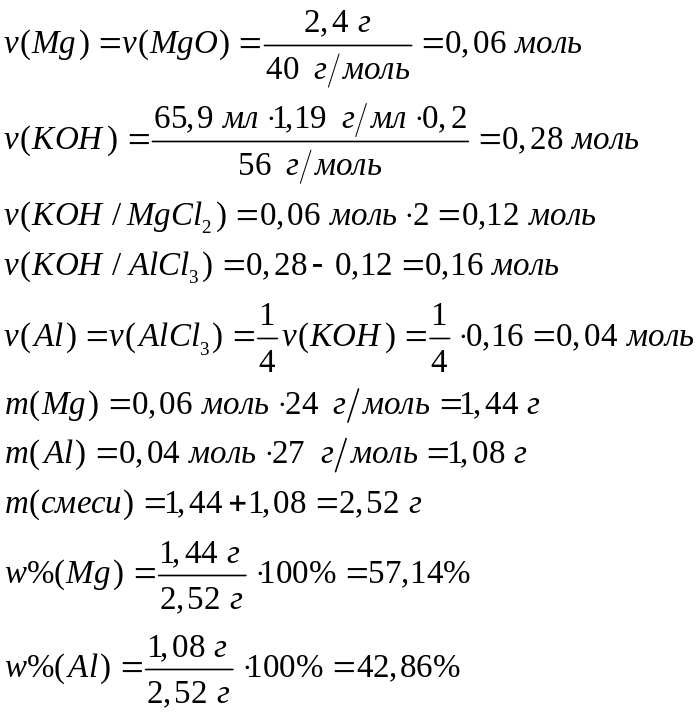 Решите:
Смесь
алюминия и железа полностью прореагировала
с хлором. Продукты реакции обработали
75 мл 25%-го раствора гидроксида натрия
(=1,28 г/мл). Осадок
отфильтровали и прокалили, масса
твердого остатка составила 3,2 г.
Определите массовые доли металлов в
смеси.
Решите:
Смесь
алюминия и железа полностью прореагировала
с хлором. Продукты реакции обработали
75 мл 25%-го раствора гидроксида натрия
(=1,28 г/мл). Осадок
отфильтровали и прокалили, масса
твердого остатка составила 3,2 г.
Определите массовые доли металлов в
смеси.Смесь порошков металлов алюминия, цинка и меди массой 7,98 г обработали концентрированным раствором гидроксида натрия, при этом выделилось 4,032 л газа. Такую же смесь обработали концентрированной азотной кислотой при нагревании и получили 9,408 л газа. Определите массовые доли металлов в смеси. Какой объем 60%-го раствора азотной кислоты (=1,365 г/мл) вступит в реакцию? х моль 1,5х моль
 2
моль 3 моль
27 г/моль 22,4
л/моль.
у моль у моль
2
моль 3 моль
27 г/моль 22,4
л/моль.
у моль у моль
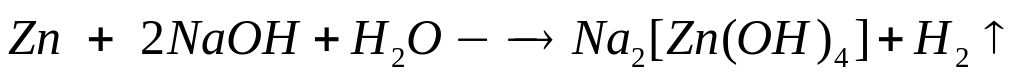 1
моль 1 моль
65 г/моль
1
моль 1 моль
65 г/моль
 х
моль 6х моль 3х моль
х
моль 6х моль 3х моль
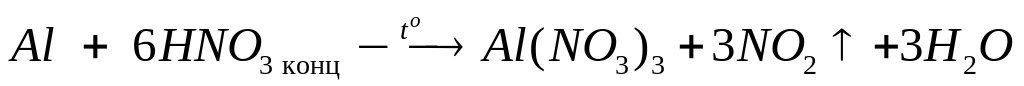 1
моль 6 моль 3 моль
у
моль 4у моль 2у моль
1
моль 6 моль 3 моль
у
моль 4у моль 2у моль
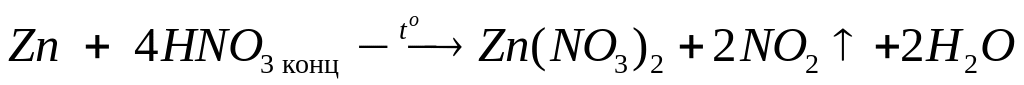 1
моль 4 моль 2 моль
z
моль 4z моль 2z
моль
1
моль 4 моль 2 моль
z
моль 4z моль 2z
моль
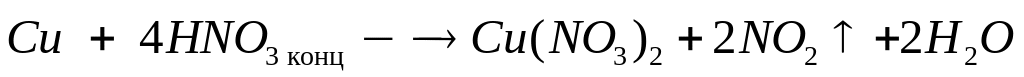 1
моль 4 моль 2 моль
64
г/моль
1
моль 4 моль 2 моль
64
г/моль
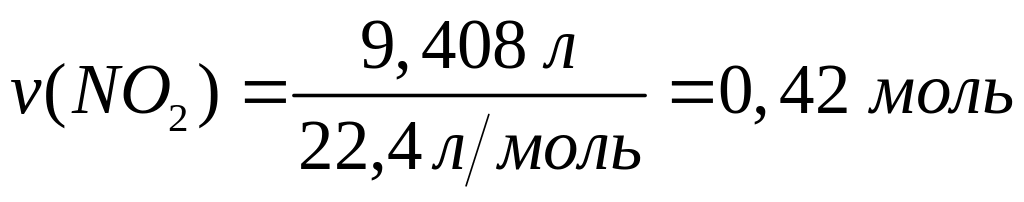
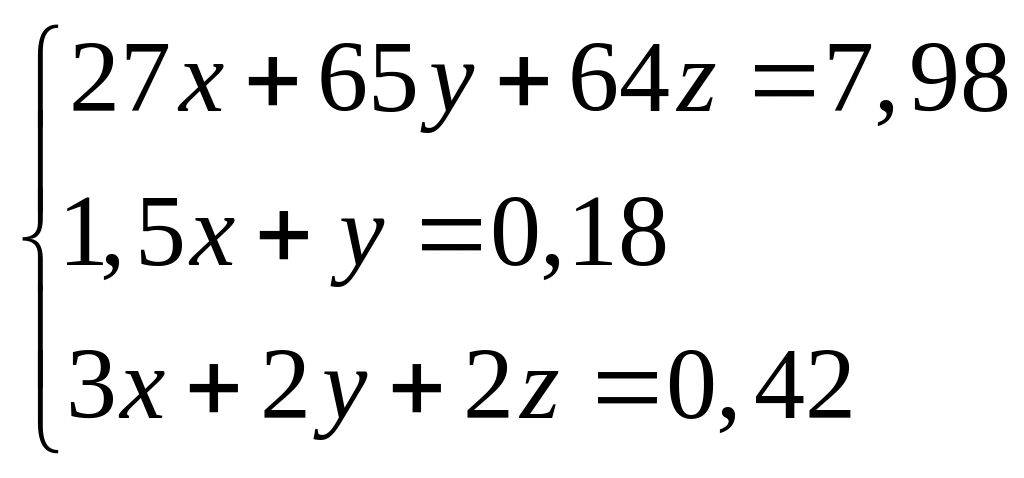
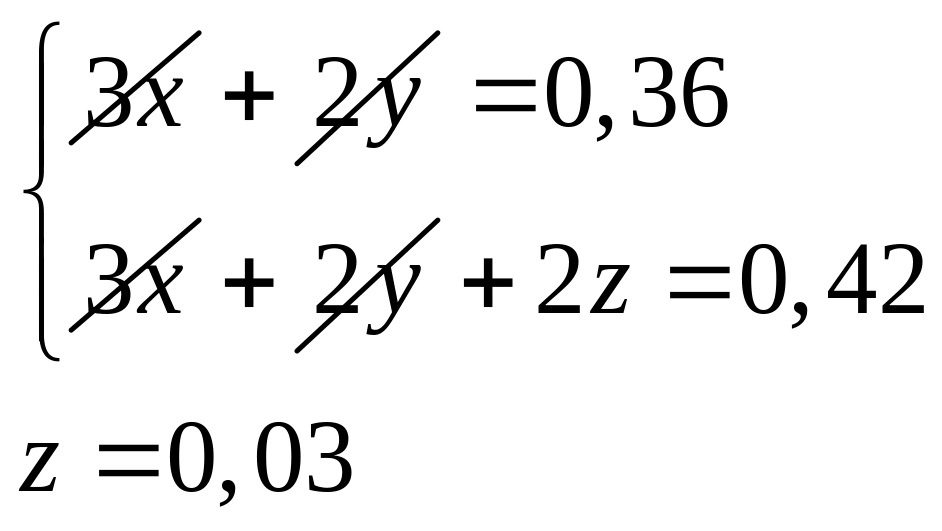
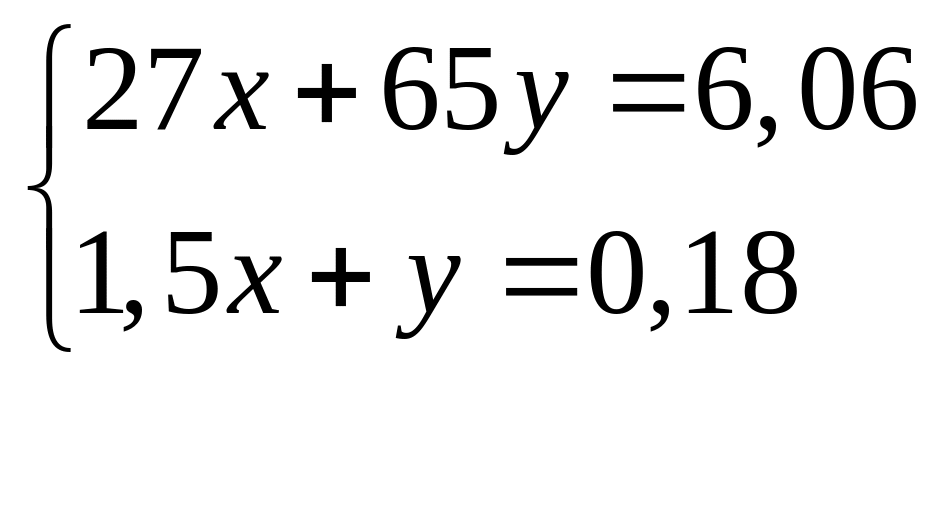
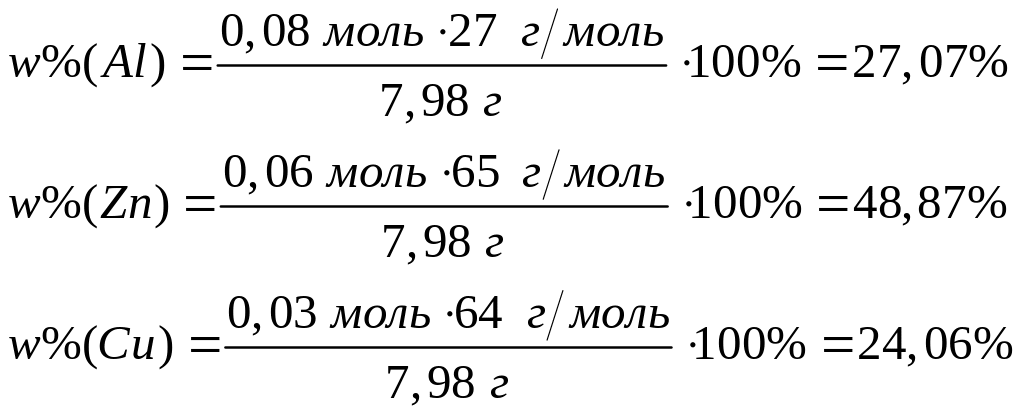
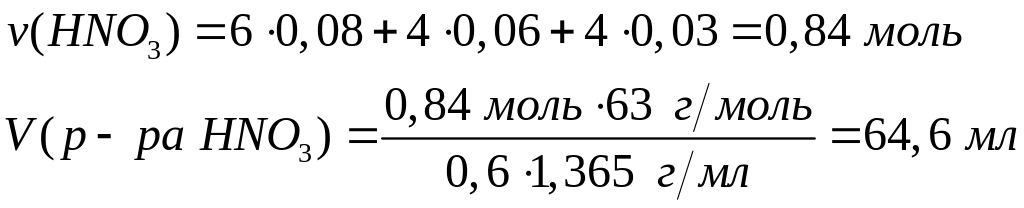 Решите:
Смесь
порошков металлов алюминия, цинка и
марганца массой 9,14 г реагирует с 36,13 мл
25%-го раствора гидроксида калия (=1,24
г/мл). Такая же смесь реагирует при
нагревании с 71,24 мл 70%-го раствора азотной
кислоты (=1,415 г/мл).
Определите массовые доли металлов в
смеси, объем водорода и объем оксида
углерода (IV), выделившихся
соответственно в ходе реакций.
Решите:
Смесь
порошков металлов алюминия, цинка и
марганца массой 9,14 г реагирует с 36,13 мл
25%-го раствора гидроксида калия (=1,24
г/мл). Такая же смесь реагирует при
нагревании с 71,24 мл 70%-го раствора азотной
кислоты (=1,415 г/мл).
Определите массовые доли металлов в
смеси, объем водорода и объем оксида
углерода (IV), выделившихся
соответственно в ходе реакций.Алюминий растворили в необходимом объеме 20%-го раствора серной кислоты. Вычислите массовую долю сульфата алюминия в растворе. х моль 1,5х моль 0,5х моль 1,5х моль
 2
моль 3 моль 1 моль 3 моль
27
г/моль 98 г/моль 342 г/моль 2
г/моль
2
моль 3 моль 1 моль 3 моль
27
г/моль 98 г/моль 342 г/моль 2
г/моль
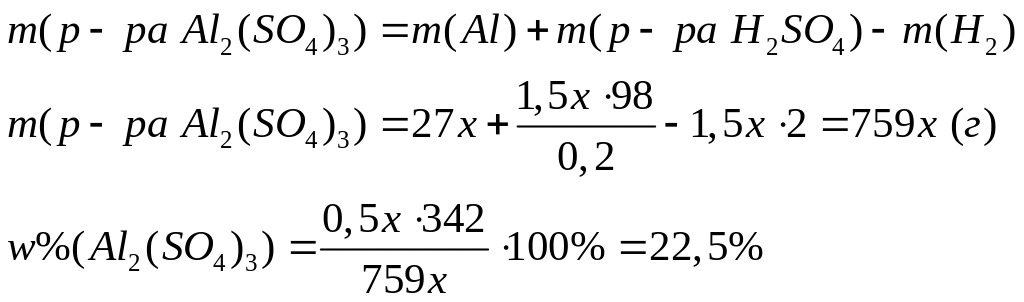 Решите:
Карбид алюминия растворили в
необходимом объеме 19,6%-го раствора
серной кислоты. Вычислите массовую
долю сульфата алюминия в растворе.
Решите:
Карбид алюминия растворили в
необходимом объеме 19,6%-го раствора
серной кислоты. Вычислите массовую
долю сульфата алюминия в растворе.При полном окислении смеси сульфида и карбида алюминия выделяется 6,72 л смеси газов (н.у.). Такая же навеска смеси полностью реагирует с 70 мл 25%-го раствора гидроксида натрия (=1,28 г/мл). Определите массовые доли сульфида и карбида алюминия в смеси. х моль 3х моль
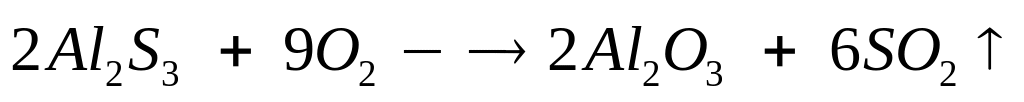 2
моль 6 моль
150
г/моль 22,4 л/моль
у моль
3у моль
2
моль 6 моль
150
г/моль 22,4 л/моль
у моль
3у моль
 1
моль 3моль
144 г/моль
1
моль 3моль
144 г/моль
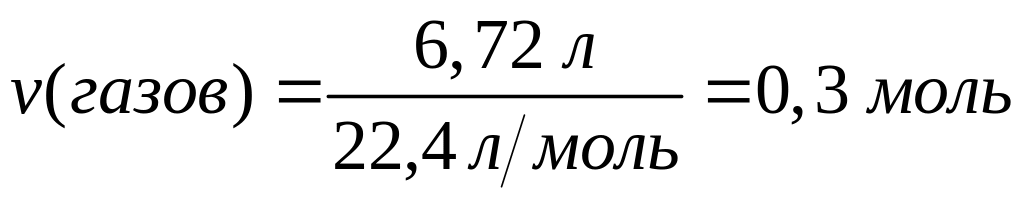 х
моль 8х моль
х
моль 8х моль
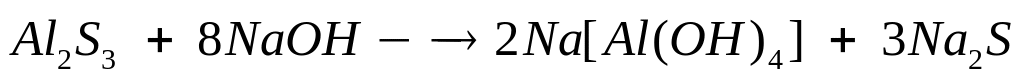 1
моль 8 моль
40 г/моль
у
моль 4у моль
1
моль 4 моль
1
моль 8 моль
40 г/моль
у
моль 4у моль
1
моль 4 моль
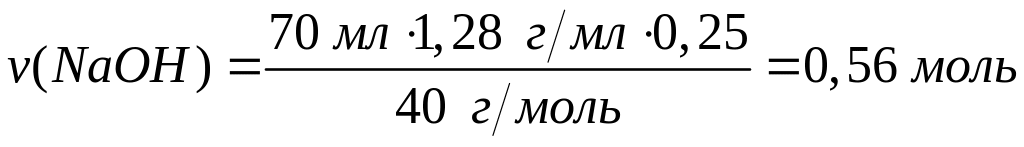
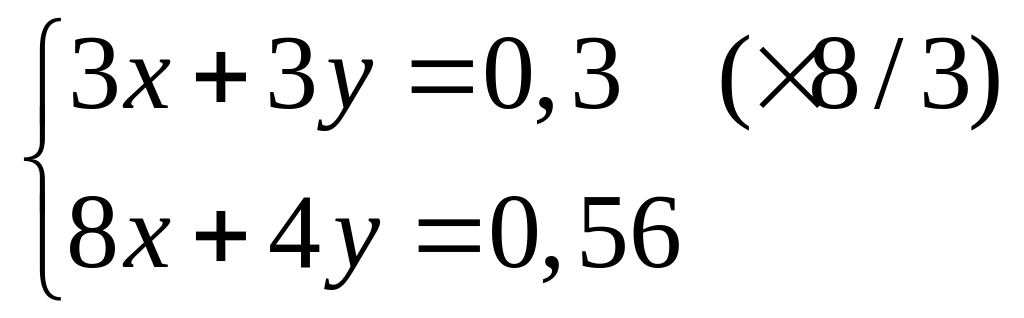
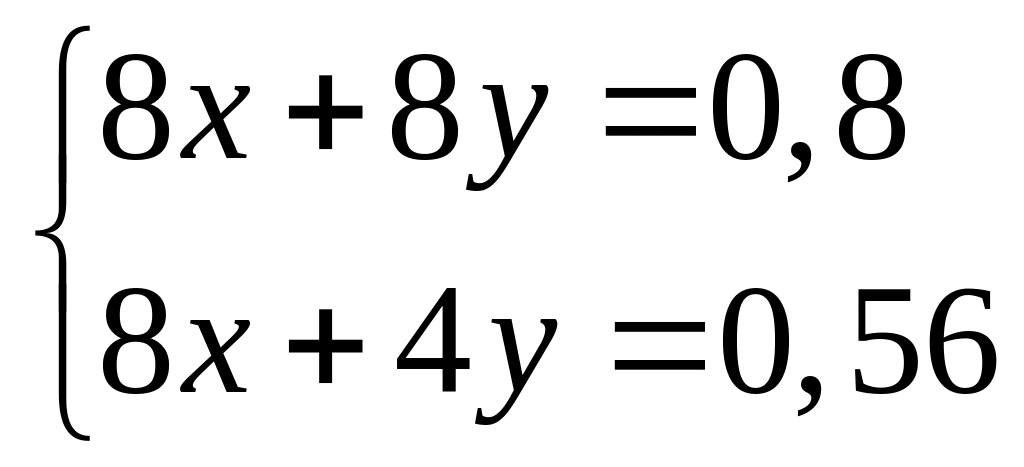
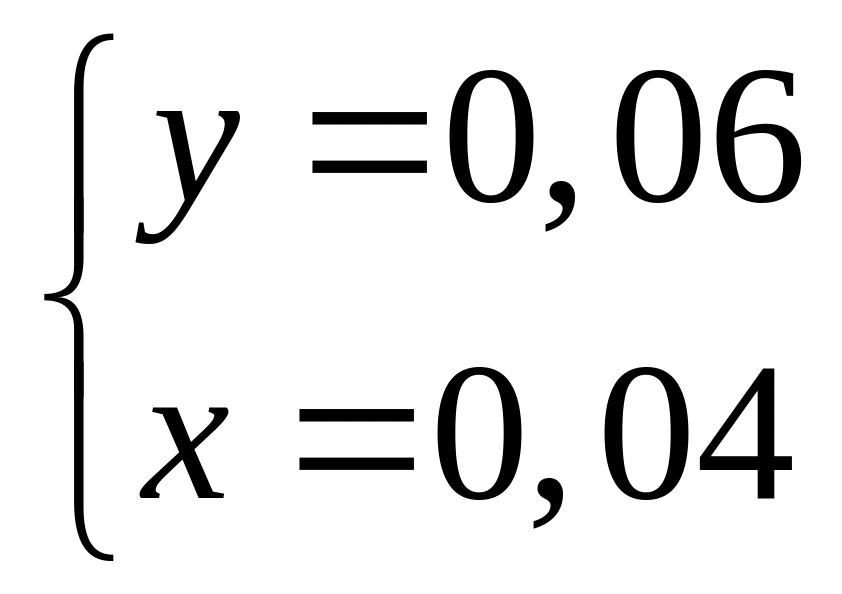
 Решите:
Смесь
сульфида и карбида алюминия полностью
реагирует с 82,53 мл 30%-го раствора соляной
кислоты (=1,15 г/мл).
Такая же навеска смеси полностью
реагирует с 55 мл 25%-го раствора гидроксида
натрия (=1,28 г/мл).
Определите массовые доли сульфида и
карбида алюминия в смеси.
Решите:
Смесь
сульфида и карбида алюминия полностью
реагирует с 82,53 мл 30%-го раствора соляной
кислоты (=1,15 г/мл).
Такая же навеска смеси полностью
реагирует с 55 мл 25%-го раствора гидроксида
натрия (=1,28 г/мл).
Определите массовые доли сульфида и
карбида алюминия в смеси.Массовая доля алюминия в водном растворе сульфата алюминия равна 4%. Вычислите массовую долю (в процентах) сульфата алюминия в растворе. I способ Пусть в растворе
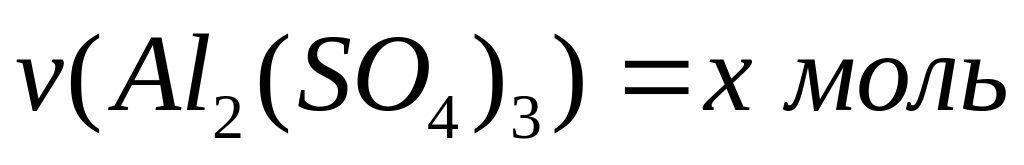 ,
,
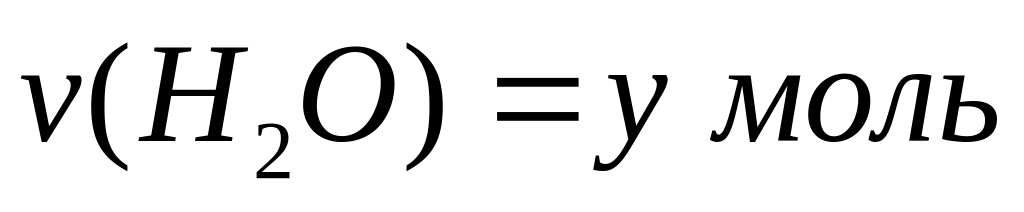
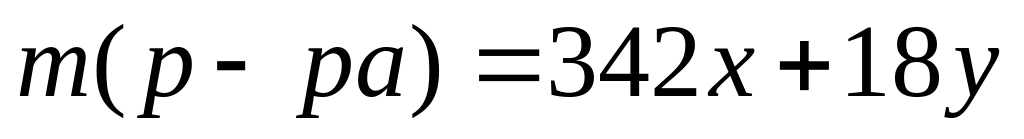
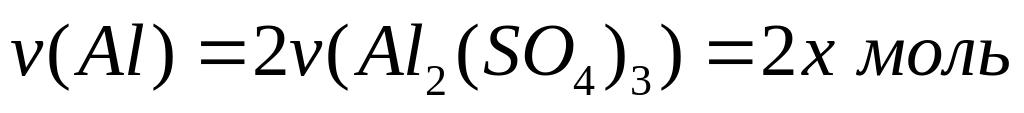
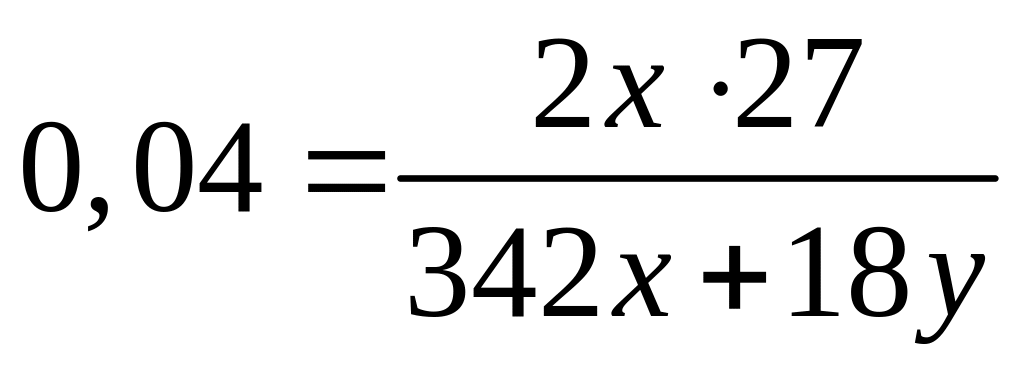
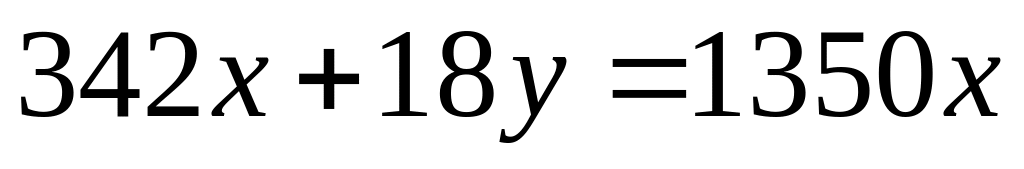
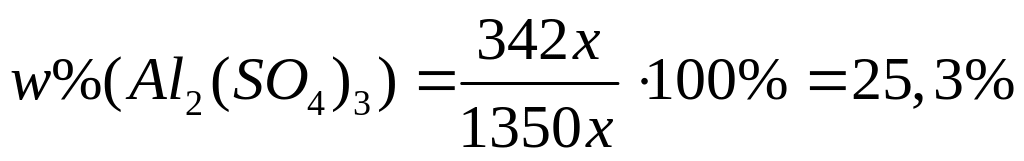 II
способ
х моль 2х моль
1 моль 2 моль
342 г/моль 27
г/моль
II
способ
х моль 2х моль
1 моль 2 моль
342 г/моль 27
г/моль
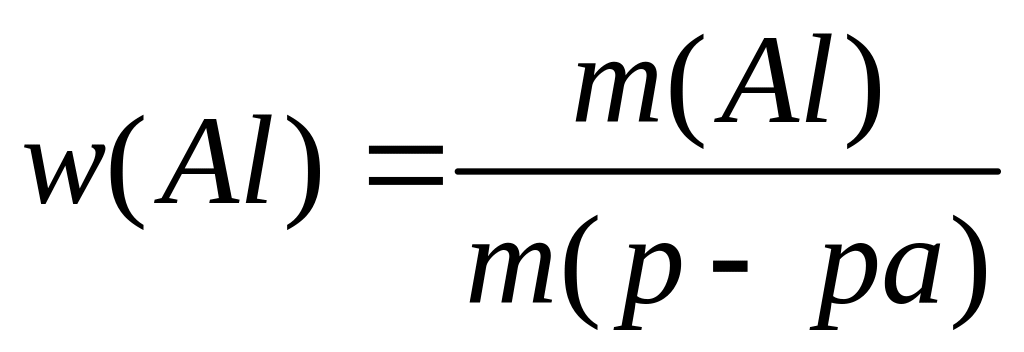
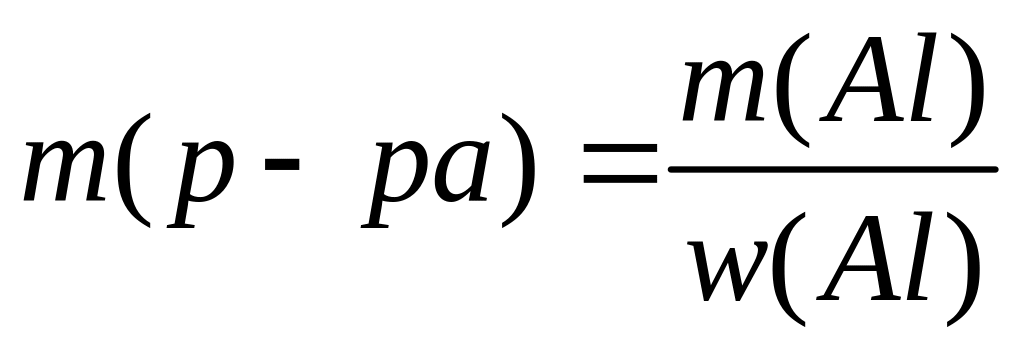
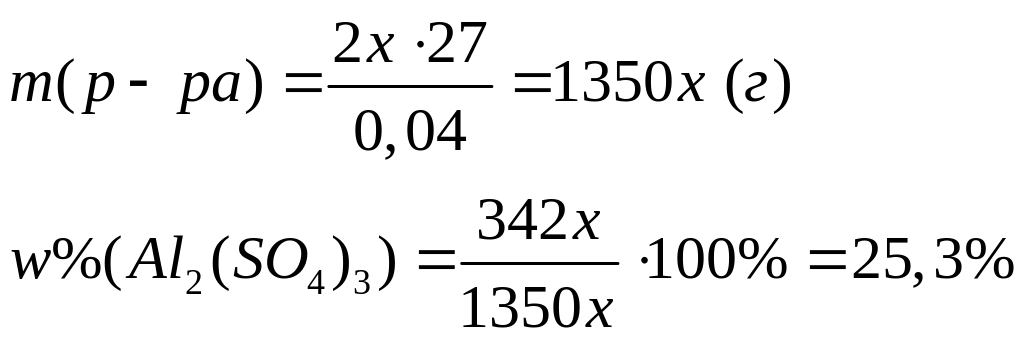 III
способ
III
способ
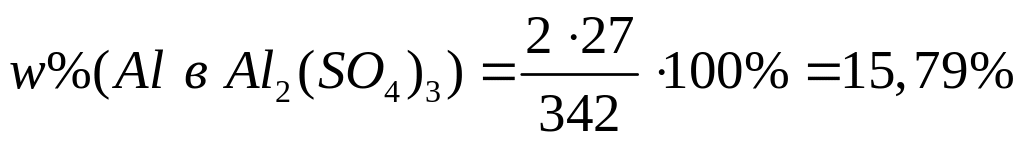
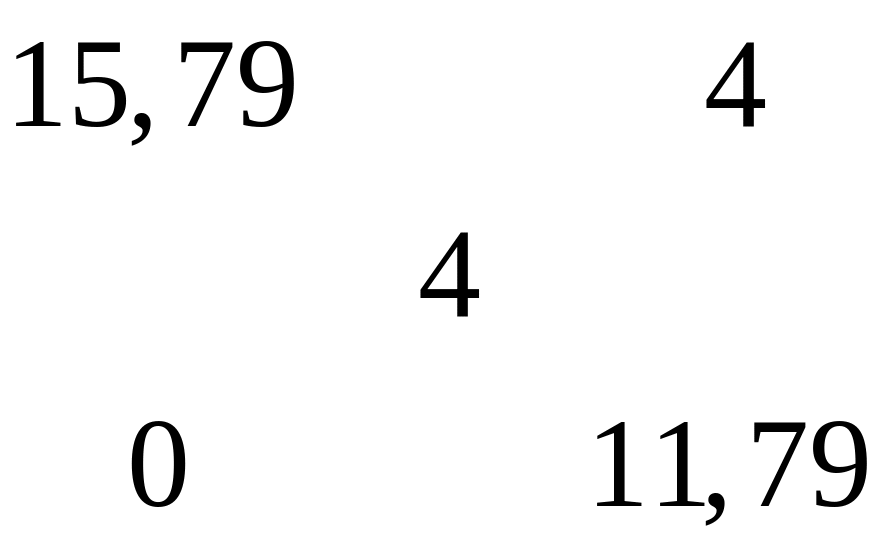
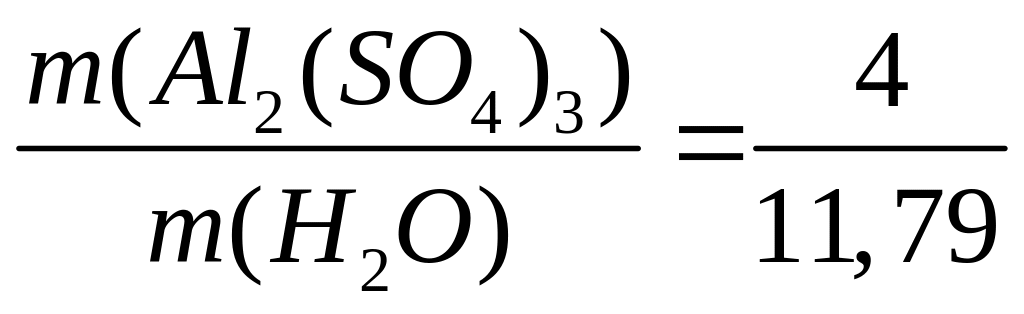
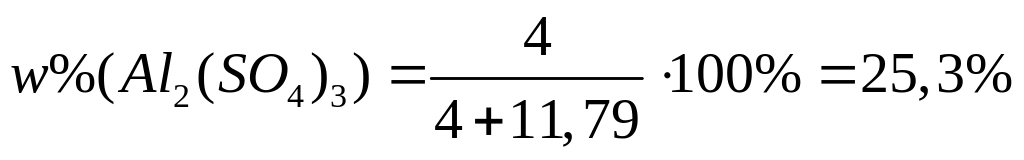 Решите:
Массовая
доля алюминия в водном растворе хлорида
алюминия равна 3,5%. Вычислите массовую
долю (в процентах) хлорида алюминия в
растворе.
Решите:
Массовая
доля алюминия в водном растворе хлорида
алюминия равна 3,5%. Вычислите массовую
долю (в процентах) хлорида алюминия в
растворе.М ассовая доля атомарного водорода в водном растворе сульфата алюминия равна 8%. Вычислите массовую долю сульфата алюминия в растворе. I способ Пусть в растворе ,
 ,
,

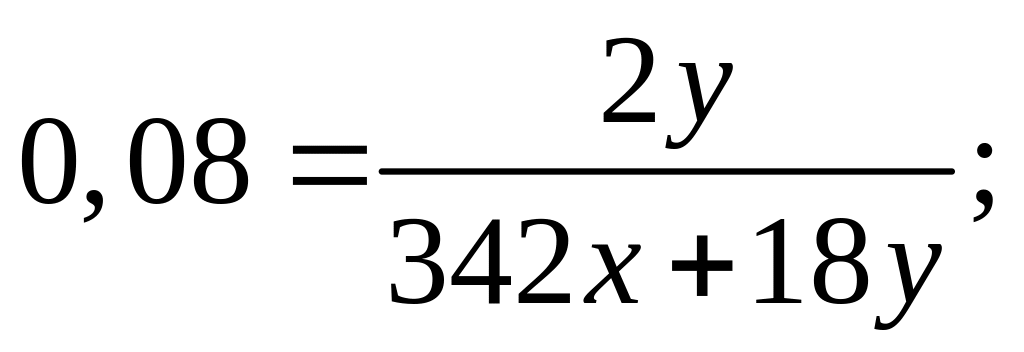
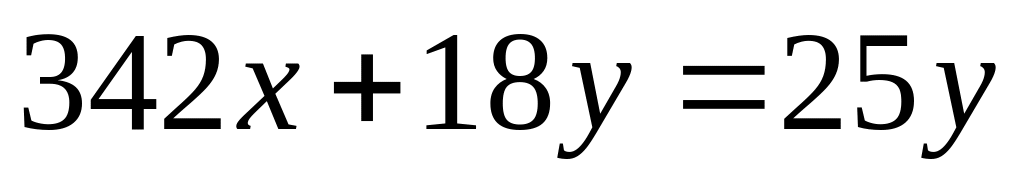

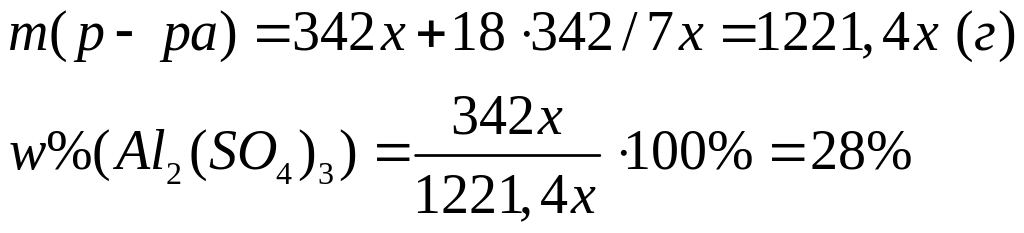 II
способ
II
способ
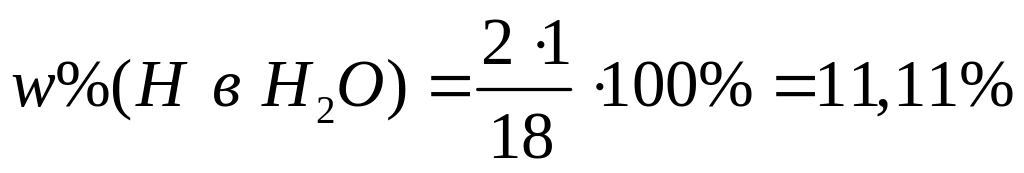
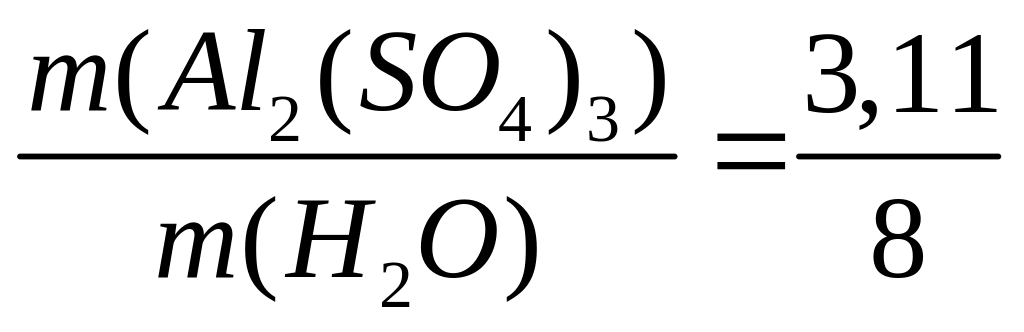
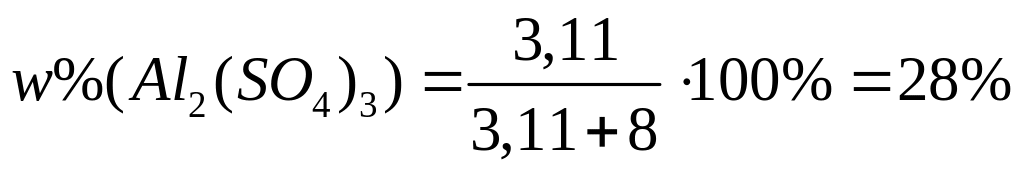 Решите:
Массовая
доля атомарного водорода в водном
растворе хлорида алюминия равна 9%.
Вычислите массовую долю хлорида алюминия
в растворе.
Решите:
Массовая
доля атомарного водорода в водном
растворе хлорида алюминия равна 9%.
Вычислите массовую долю хлорида алюминия
в растворе.Массовая доля атомарного кислорода в водном растворе сульфата алюминия равна 80%. Вычислите массовую долю сульфата алюминия в растворе. I способ х моль 12х моль у моль у моль
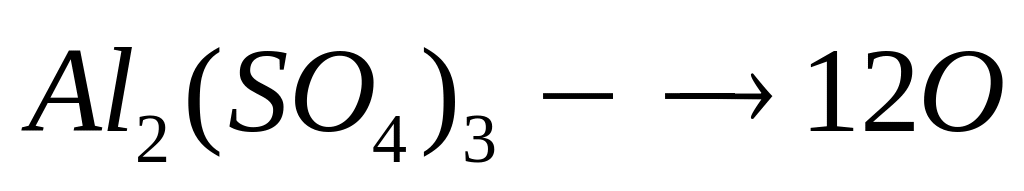
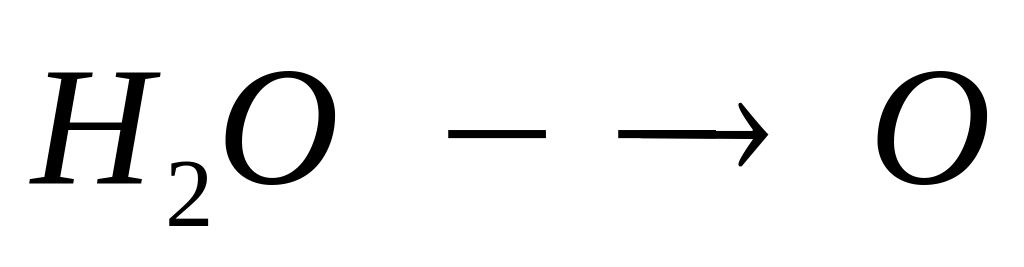 1 моль 12 моль 1 моль 1 моль
342
г/моль 16 г/моль 18 г/моль 16 г/моль
1 моль 12 моль 1 моль 1 моль
342
г/моль 16 г/моль 18 г/моль 16 г/моль
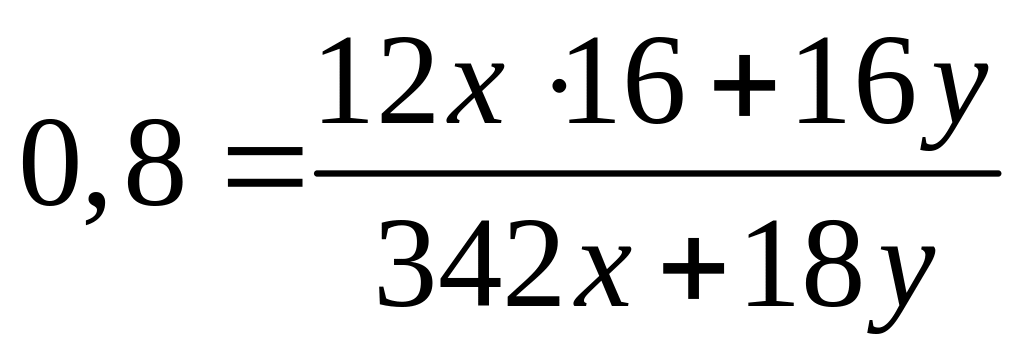
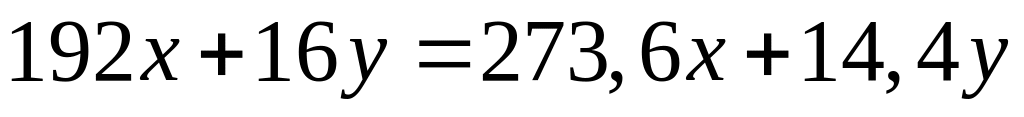
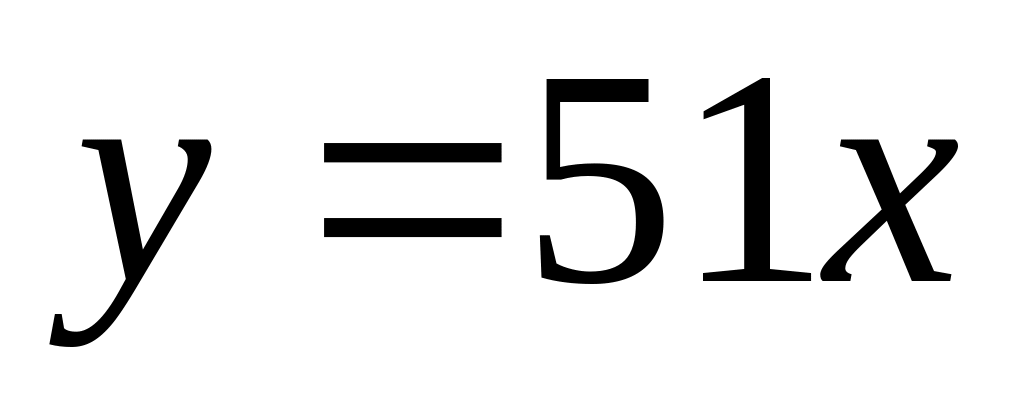
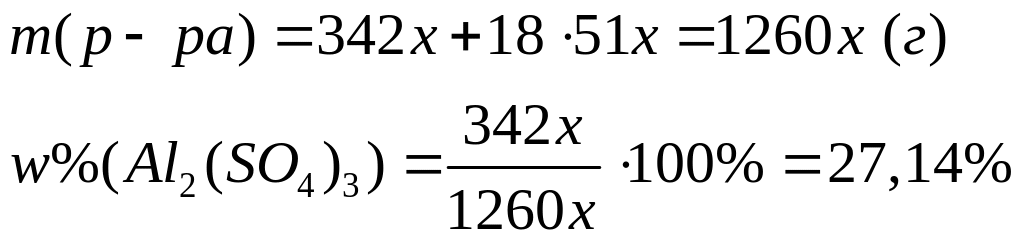 II
способ
II
способ
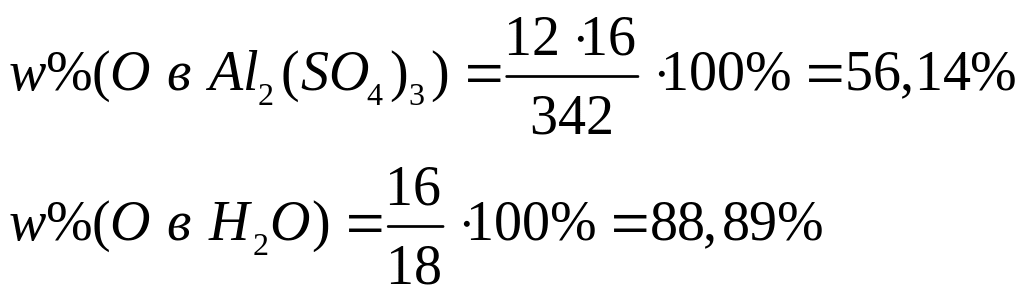

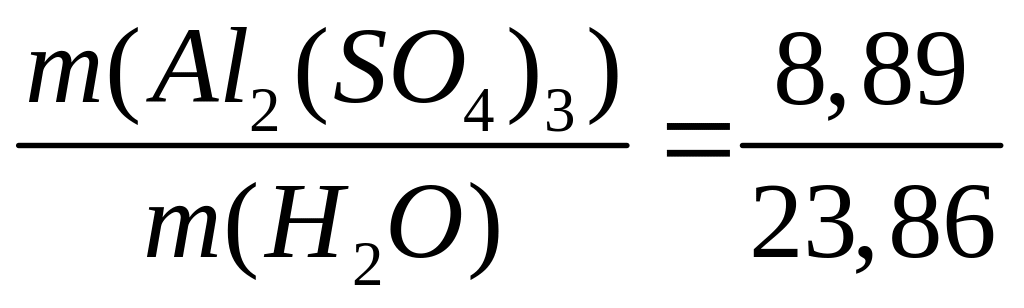
 Решите:
Массовая
доля атомарного кислорода в водном
растворе нитрата алюминия равна 85%.
Вычислите массовую долю нитрата алюминия
в растворе.
Решите:
Массовая
доля атомарного кислорода в водном
растворе нитрата алюминия равна 85%.
Вычислите массовую долю нитрата алюминия
в растворе.М ассовая доля кислорода в оксиде металла Ме2Оn равна 47,06%. Выведите формулу оксида. I способ
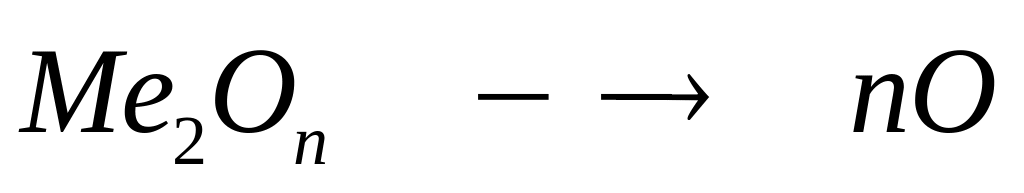
 1
моль n моль
(2х+16n)
г/моль 16 г/моль
1
моль n моль
(2х+16n)
г/моль 16 г/моль

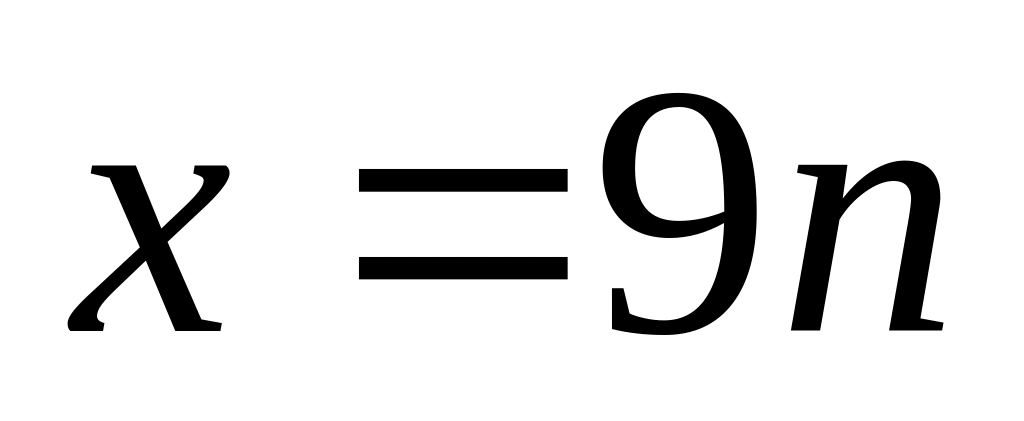
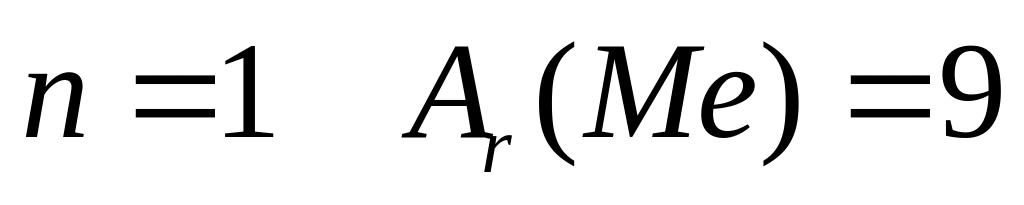 ,
бериллий не удовлетворяет условию
задачи , т.к. в соединениях двухвалентен.
,
бериллий не удовлетворяет условию
задачи , т.к. в соединениях двухвалентен.
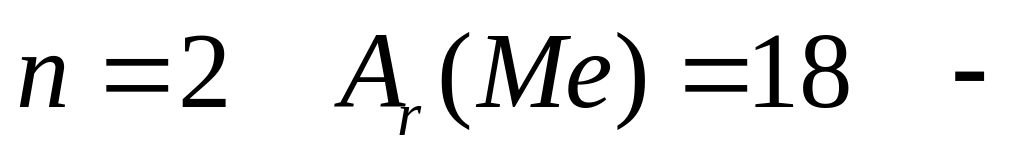
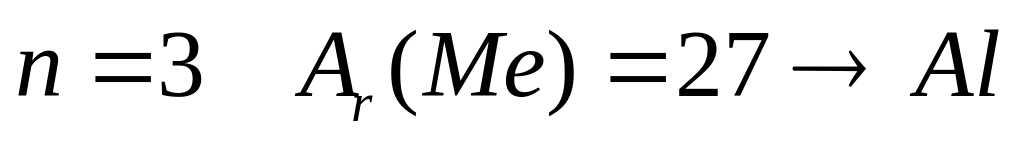 ,
,
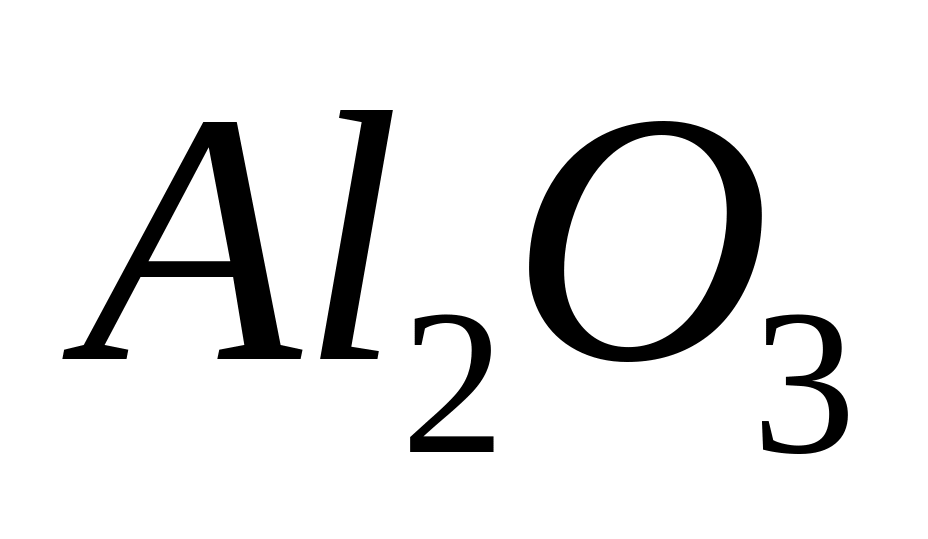 II
способ
II
способ
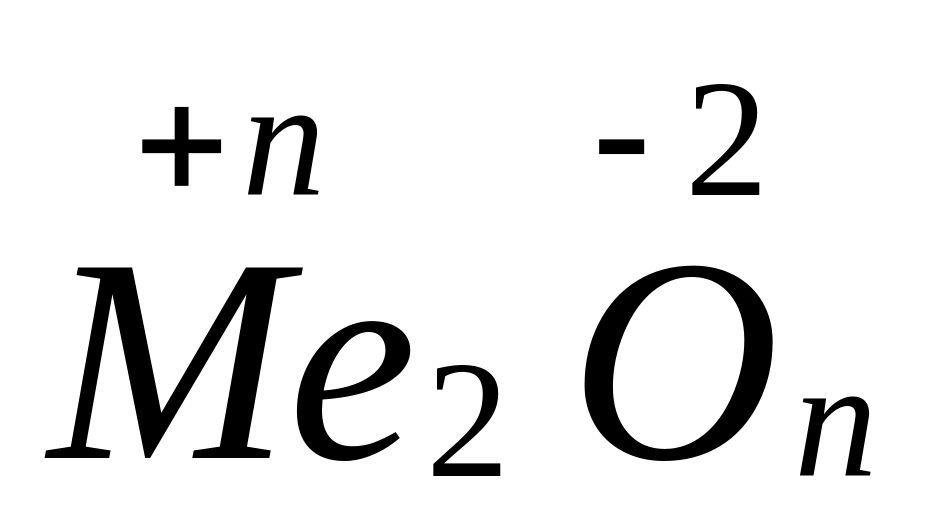
 алгебраическая сумма степеней окисления
атомов в молекуле равна нулю.
алгебраическая сумма степеней окисления
атомов в молекуле равна нулю.
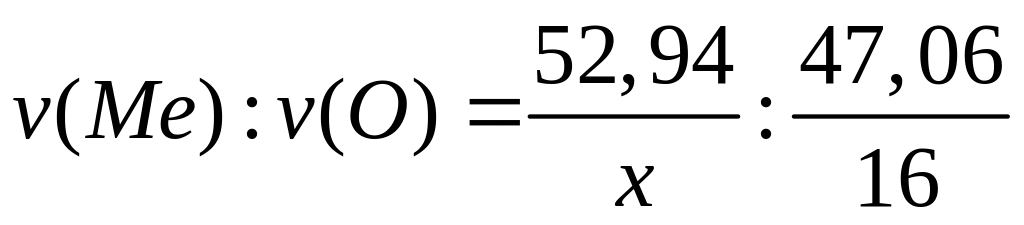
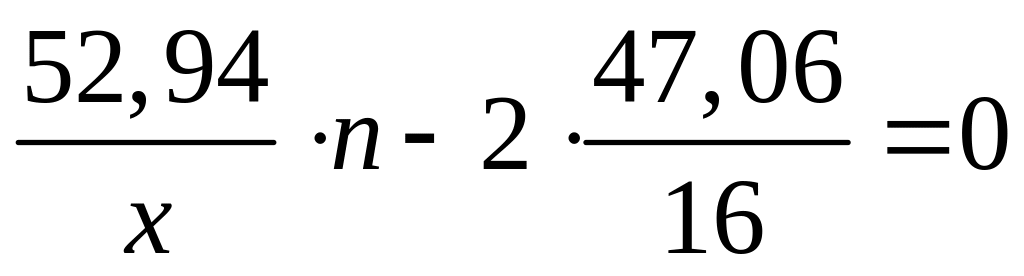 (см. I способ)
.
Решите:
а.
Массовая доля кислорода в оксиде металла
Ме2Оn равна
25,532%. Выведите формулу оксида.
б.
Массовая доля металла в оксиде металла
Ме2Оn равна
82,734%. Выведите формулу оксида.
в.
Массовая доля кислорода в гидроксиде
металла Ме(ОН)n
равна 61,538%. Выведите формулу оксида.
(см. I способ)
.
Решите:
а.
Массовая доля кислорода в оксиде металла
Ме2Оn равна
25,532%. Выведите формулу оксида.
б.
Массовая доля металла в оксиде металла
Ме2Оn равна
82,734%. Выведите формулу оксида.
в.
Массовая доля кислорода в гидроксиде
металла Ме(ОН)n
равна 61,538%. Выведите формулу оксида.Определите формулу соединения, содержащего 75% алюминия и 25% углерода. Назовите его.

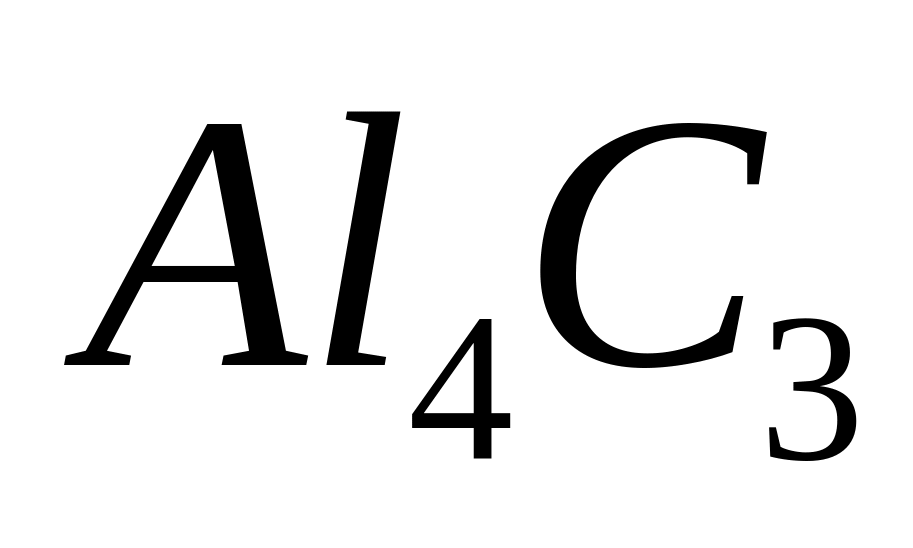 - метанид алюминия, карбид алюминия.
Решите:
Определите формулу
соединения, содержащего 70,552% индия и
29,448% серы. Назовите его.
- метанид алюминия, карбид алюминия.
Решите:
Определите формулу
соединения, содержащего 70,552% индия и
29,448% серы. Назовите его.Определите формулу соединения, имеющего состав: 16,98% алюминия, 22,64% углерода и 60,38% кислорода. Молярная масса соединения равна 318. I способ
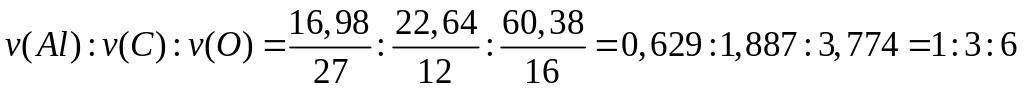
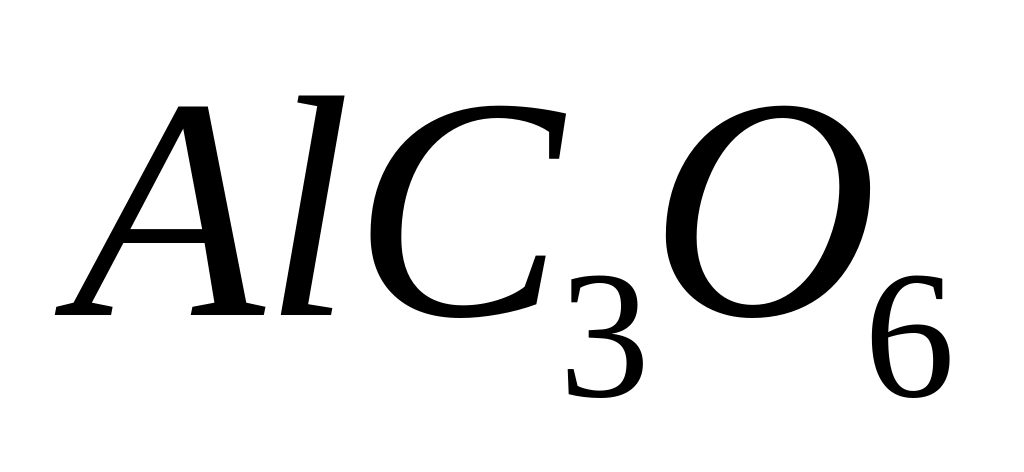
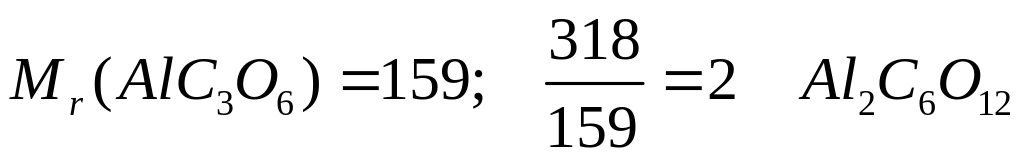
 - оксалат алюминия.
II
способ
- оксалат алюминия.
II
способ
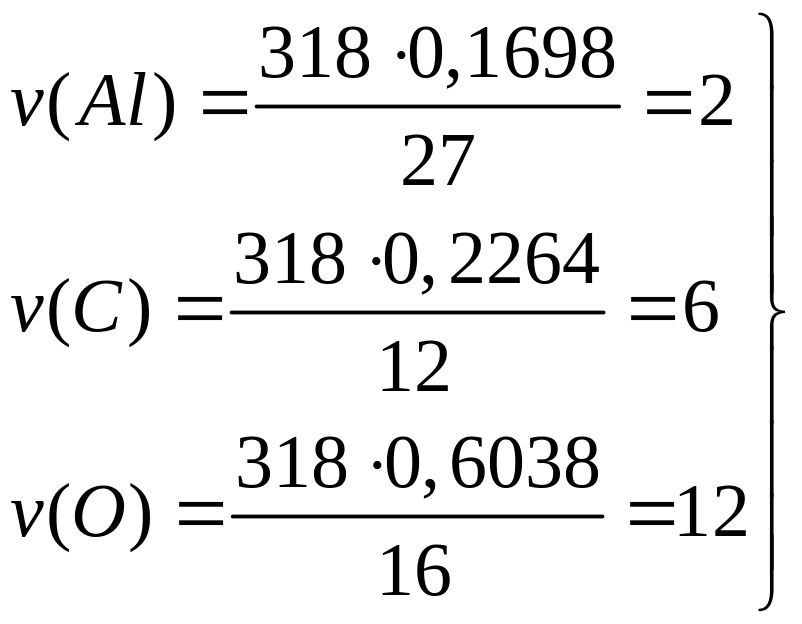
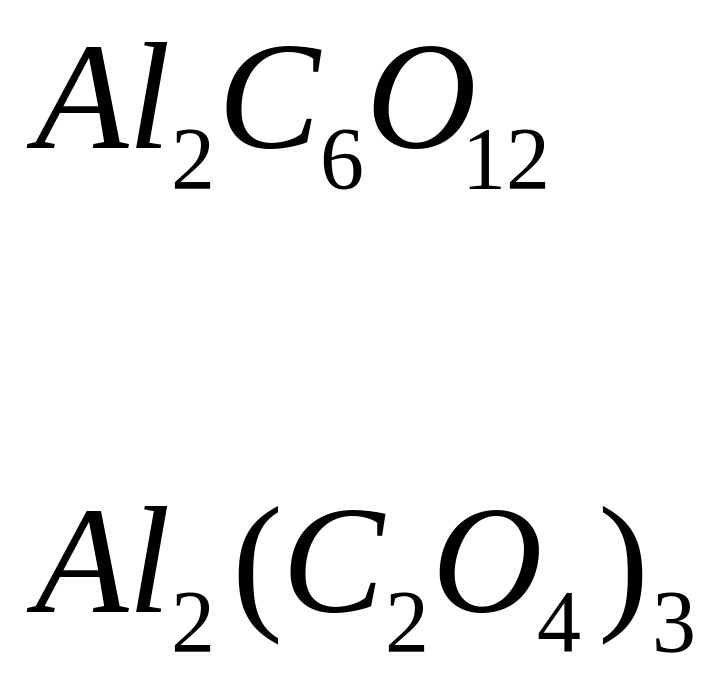 Решите:
Определите
формулу соединения, имеющего состав:
8,295% алюминия, 32,719% хлора и 58,986% кислорода.
Решите:
Определите
формулу соединения, имеющего состав:
8,295% алюминия, 32,719% хлора и 58,986% кислорода.Определите формулу соединения, имеющего состав: 8,491% алюминия, 1,887% водорода, 29,245% фосфора и 60,377% кислорода. Назовите соединение.
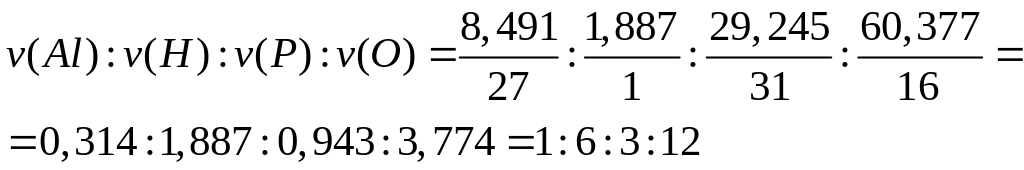
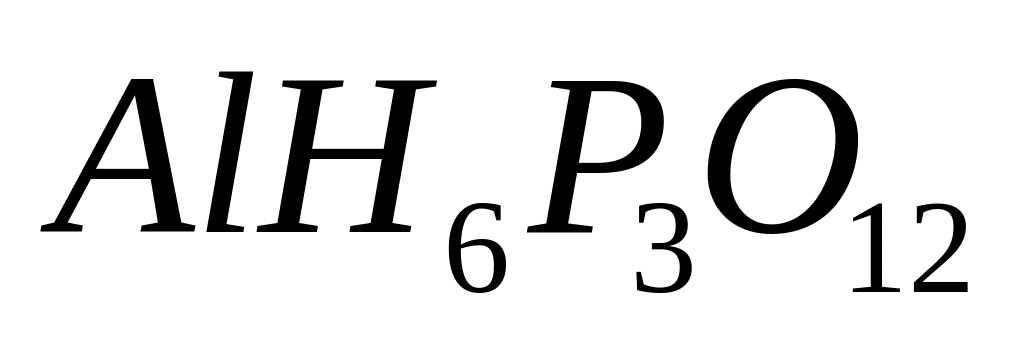
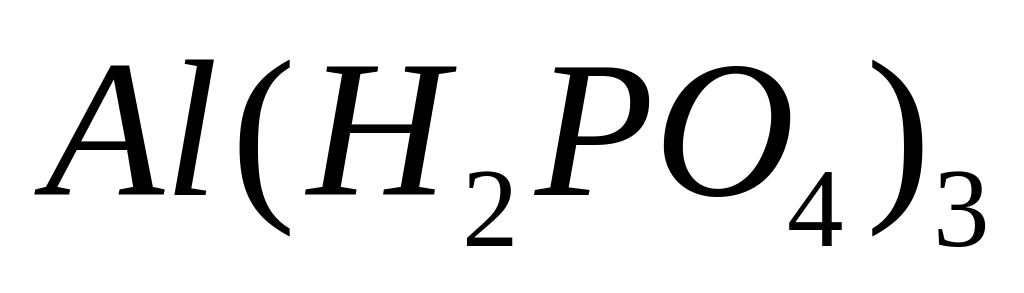 - дигидроортофосфат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
16,25% калия, 11,25% алюминия, 25,8(3)% фосфора
и 46,(6)% кислорода. Назовите соединение.
- дигидроортофосфат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
16,25% калия, 11,25% алюминия, 25,8(3)% фосфора
и 46,(6)% кислорода. Назовите соединение.Определите формулу соединения, имеющего состав: 4,712% алюминия, 41,885% брома, 3,141% водорода, 50,262% кислорода. Назовите соединение.
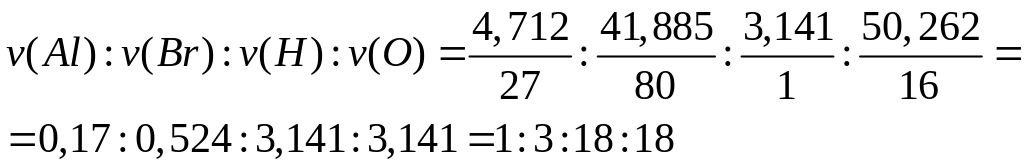
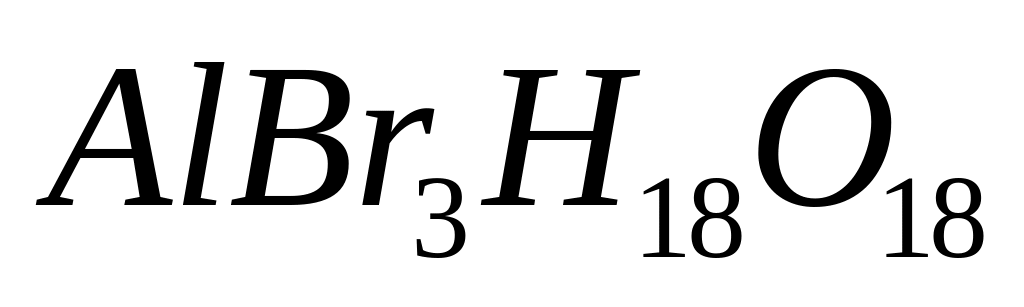
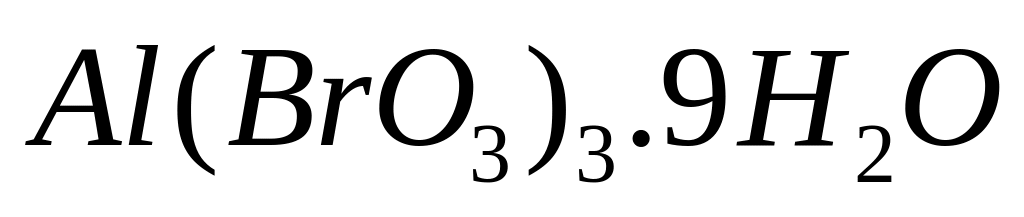 - нонагидрат бромата алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
19,014% алюминия, 35,915% ванадия, 45,070% кислорода.
Назовите соединение.
- нонагидрат бромата алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
19,014% алюминия, 35,915% ванадия, 45,070% кислорода.
Назовите соединение.Определите формулу соединения, имеющего состав: 16,265% алюминия, 45,181% неизвестного элемента и 38,554% кислорода. Назовите соединение.
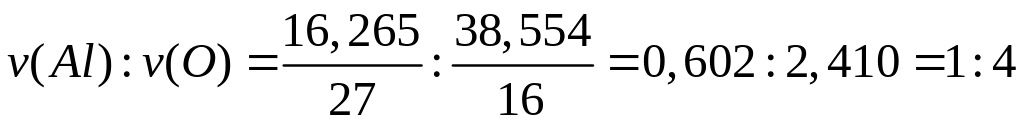
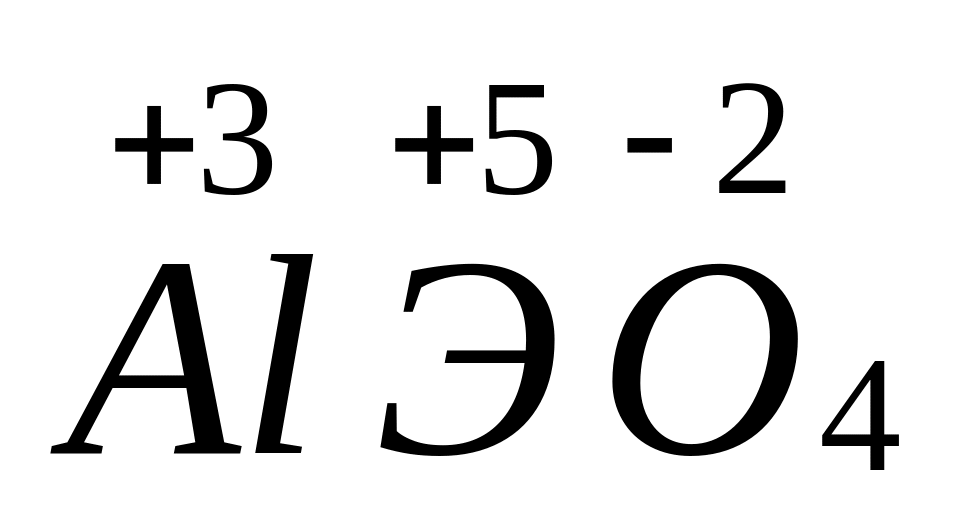
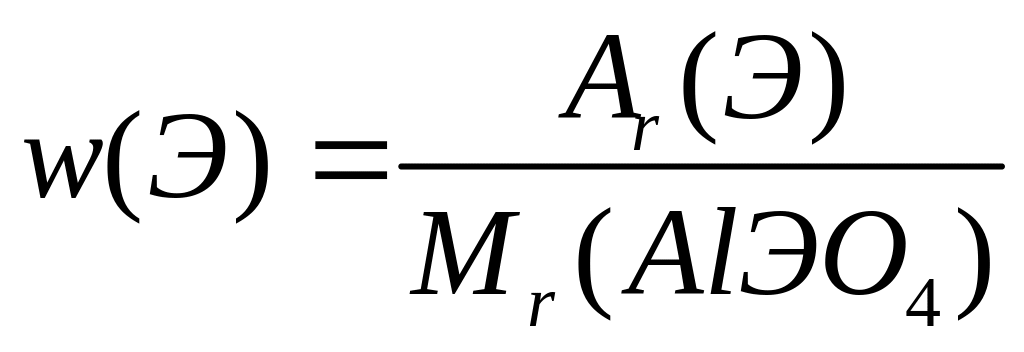
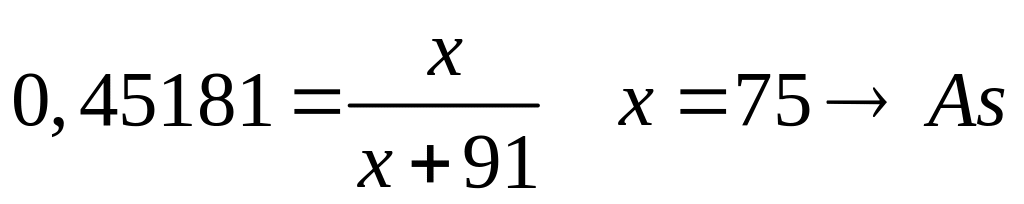
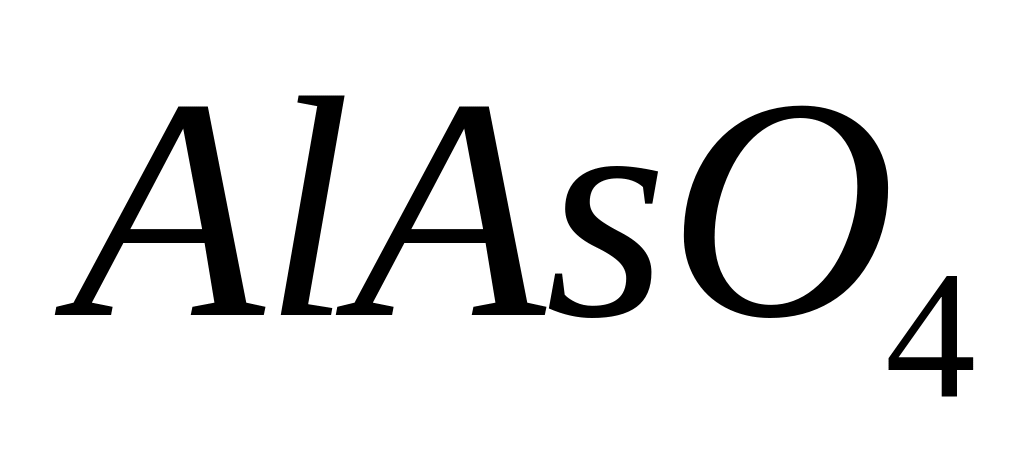 - ортоарсенат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
12,676% алюминия, 19,718% неизвестного элемента
и 67,606% кислорода. Назовите соединение.
- ортоарсенат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
12,676% алюминия, 19,718% неизвестного элемента
и 67,606% кислорода. Назовите соединение.Определите формулу соединения, имеющего состав: 9,730% алюминия, 38,378% неизвестного элемента и 51,892% кислорода. Назовите соединение.
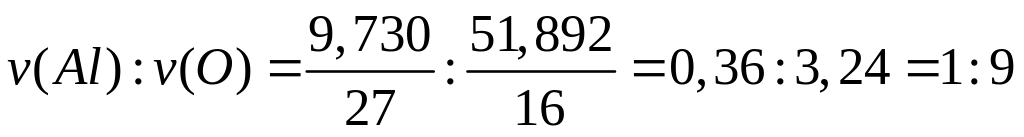
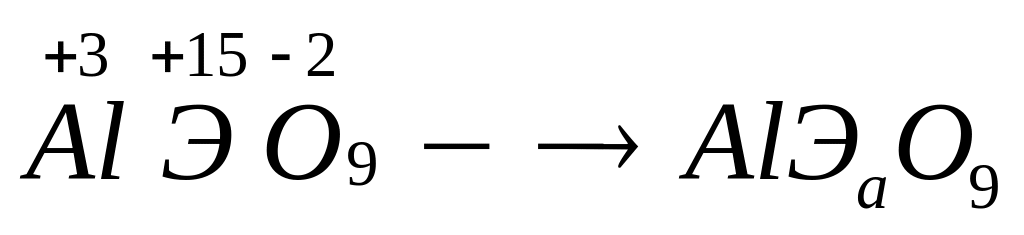
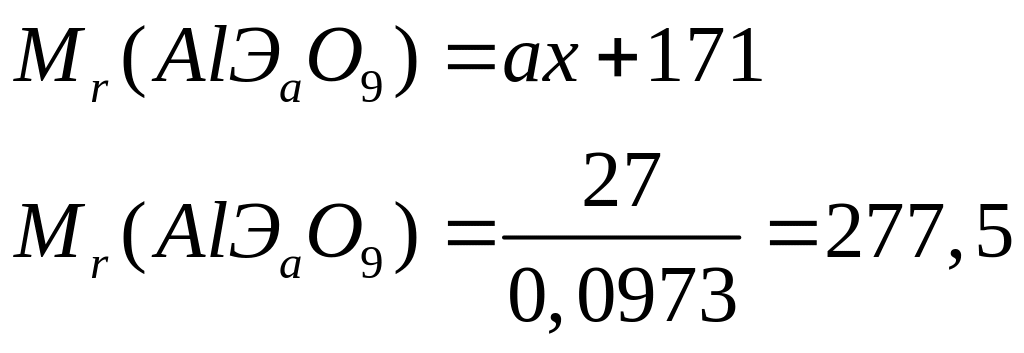
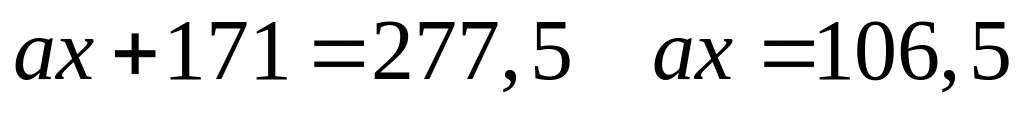
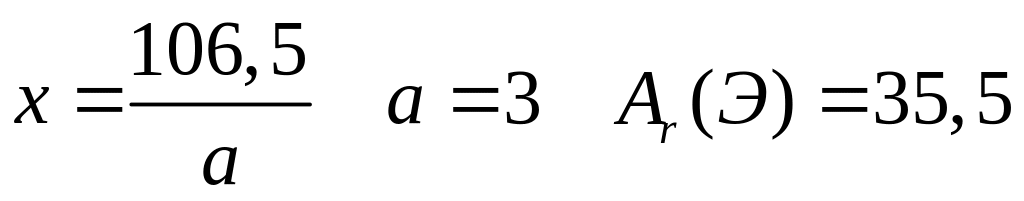
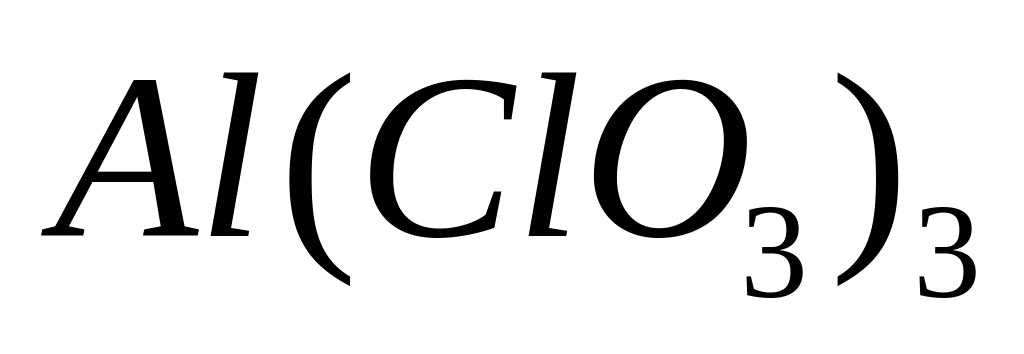 - хлорат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
13,366% алюминия, 39,109% неизвестного элемента
и 47,525% кислорода. Назовите соединение.
- хлорат алюминия.
Решите:
Определите
формулу соединения, имеющего состав:
13,366% алюминия, 39,109% неизвестного элемента
и 47,525% кислорода. Назовите соединение.Массовая доля кислорода в соединении
 равна 36,364%. Выведите формулу соединения.
равна 36,364%. Выведите формулу соединения.
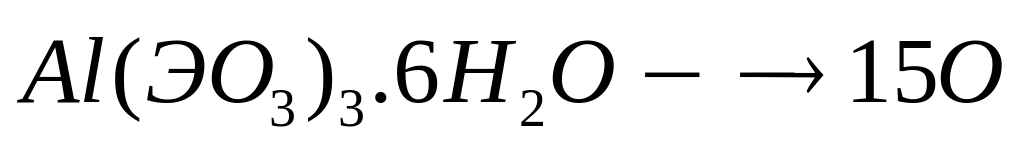 1 моль 15 моль
(3х+279) г/моль
16 г/моль
1 моль 15 моль
(3х+279) г/моль
16 г/моль
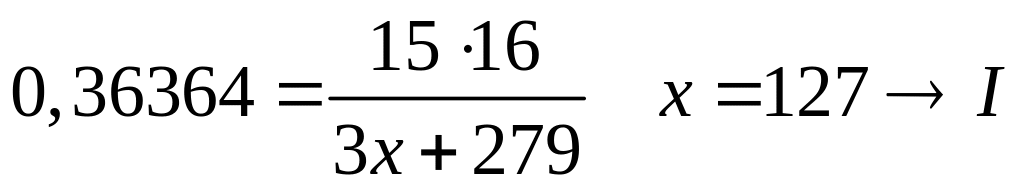
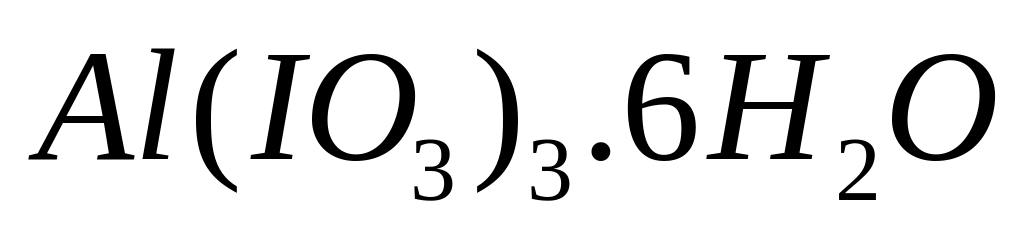 - гексагидрат иодата алюминия.
Решите:
Массовая
доля кислорода в соединении
- гексагидрат иодата алюминия.
Решите:
Массовая
доля кислорода в соединении
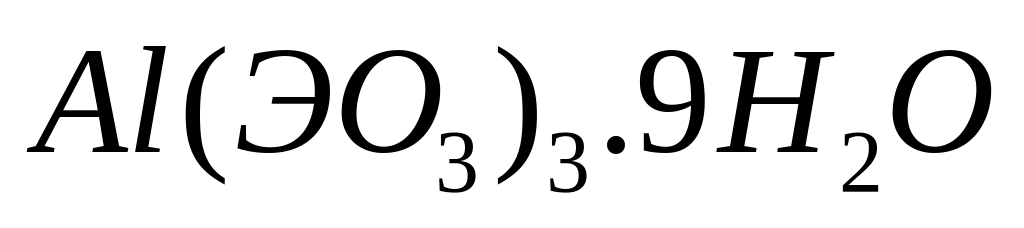 равна 76,8%. Выведите формулу соединения.
равна 76,8%. Выведите формулу соединения.Массовая доля элемента в соединении
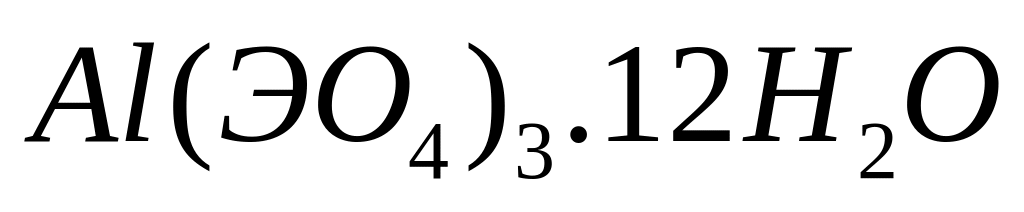 равна 19,6676%. Выведите формулу соединения.
равна 19,6676%. Выведите формулу соединения.
 1 моль 3 моль
(435+3х)
г/моль х г/моль
1 моль 3 моль
(435+3х)
г/моль х г/моль
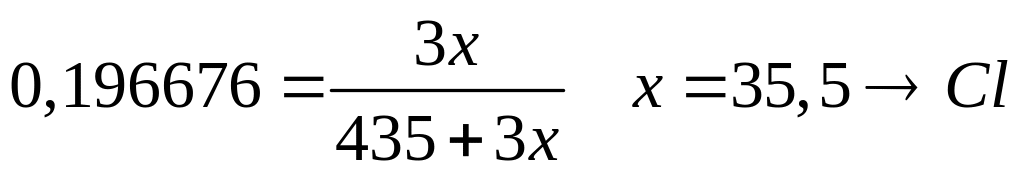
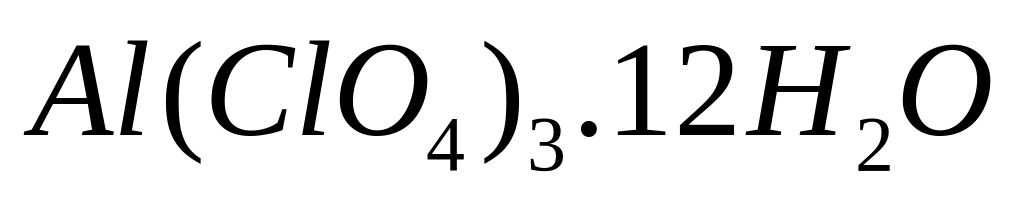 - додекагидрат перхлората
алюминия.
Решите:
Массовая
доля элемента в соединении
равна 27,626%. Выведите формулу соединения.
- додекагидрат перхлората
алюминия.
Решите:
Массовая
доля элемента в соединении
равна 27,626%. Выведите формулу соединения.Массовая доля кислорода в соединении
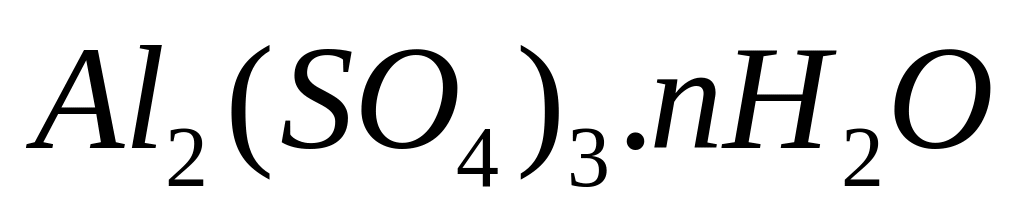 равна 72,072%. Выведите формулу соединения.
равна 72,072%. Выведите формулу соединения.
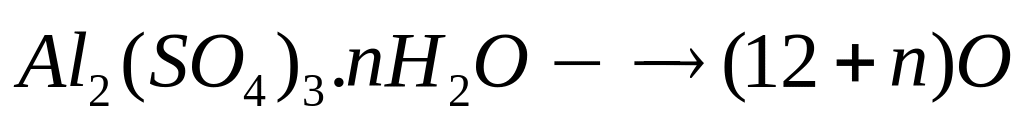 1 моль (12+n)
моль
(342+18n) г/моль
16 г/моль
1 моль (12+n)
моль
(342+18n) г/моль
16 г/моль
 - восемнадцативодный сульфат
алюминия.
Решите:
Массовая
доля кислорода в соединении
- восемнадцативодный сульфат
алюминия.
Решите:
Массовая
доля кислорода в соединении
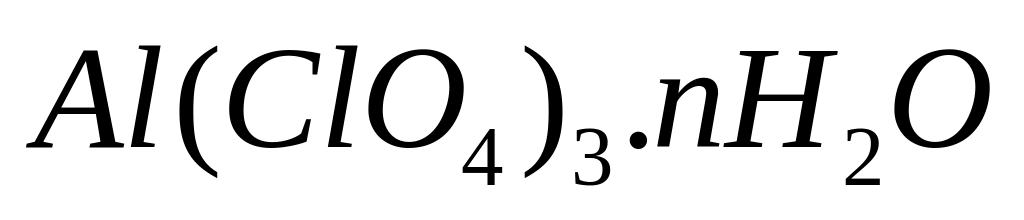 равна 68,923%. Выведите формулу соединения.
равна 68,923%. Выведите формулу соединения.Массовая доля металла в соединении
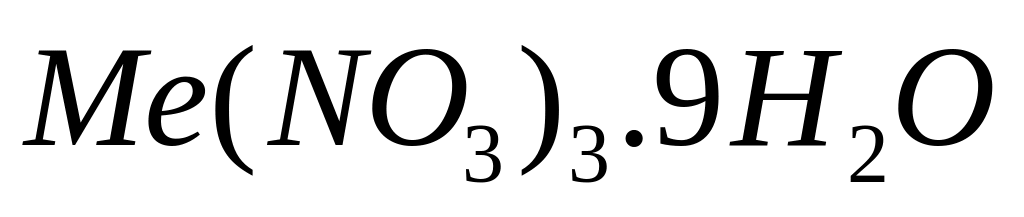 равна 7,2%. Выведите формулу соединения.
равна 7,2%. Выведите формулу соединения.
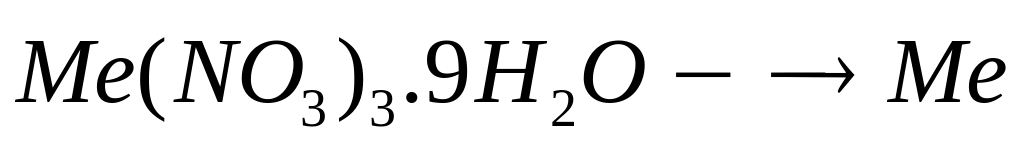 1 моль 1 моль
(х+348) г/моль
х г/моль
1 моль 1 моль
(х+348) г/моль
х г/моль
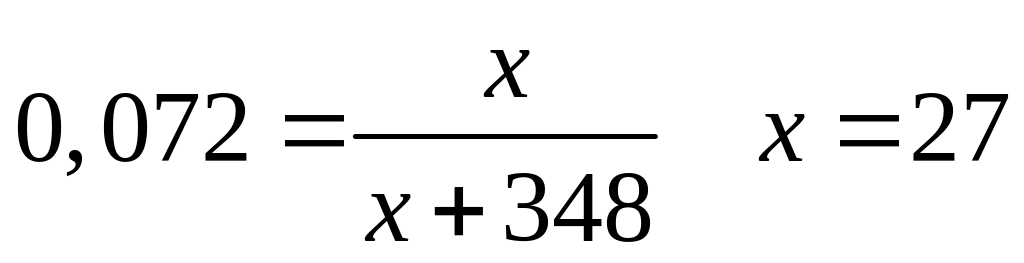 - нонагидрат нитрата алюминия.
Решите:
Массовая
доля металла в соединении
- нонагидрат нитрата алюминия.
Решите:
Массовая
доля металла в соединении
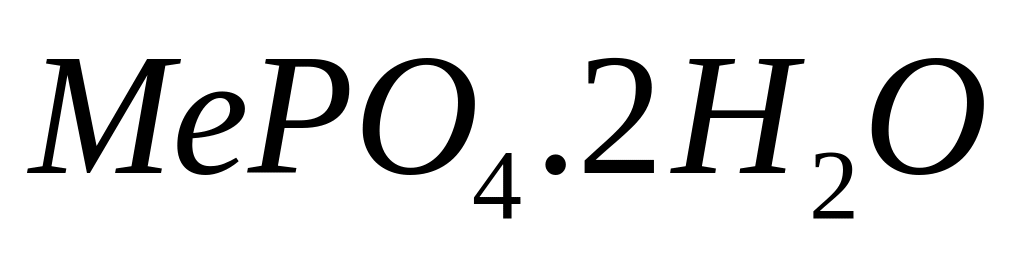 равна 46,748%. Выведите формулу соединения.
равна 46,748%. Выведите формулу соединения.При обезвоживании 6,3 г выделяется 2,025 г воды. Определите формулу кристаллогидрата. I способ
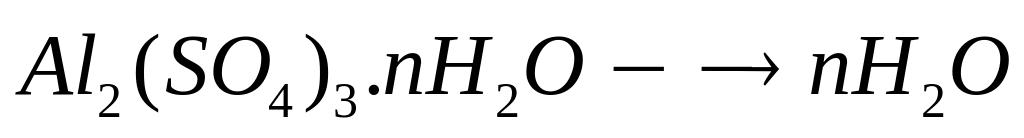 1 моль n моль
(342+18n) г/моль 18 г/моль
1 моль n моль
(342+18n) г/моль 18 г/моль
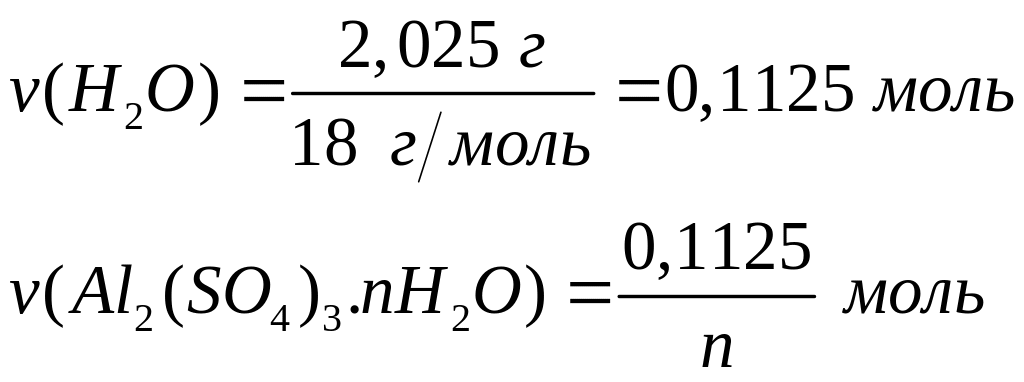
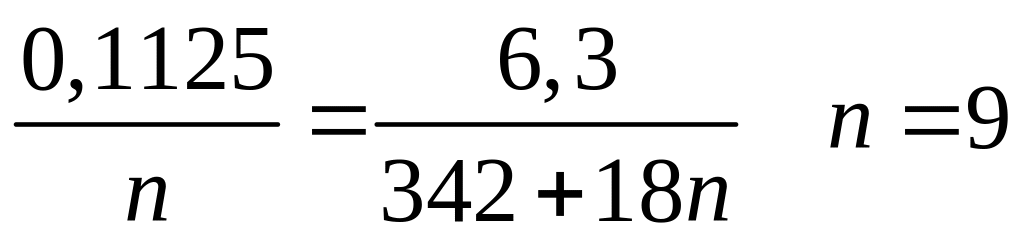
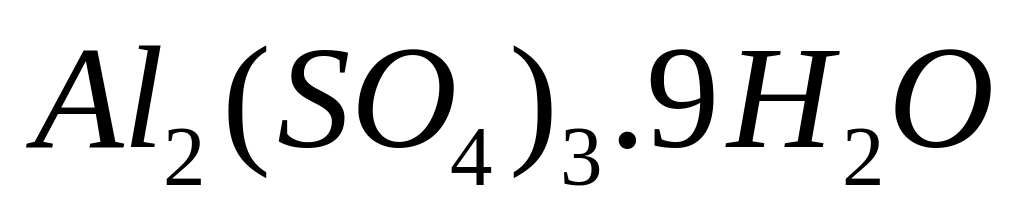 - нонагидрат сульфата алюминия.
II
способ
- нонагидрат сульфата алюминия.
II
способ
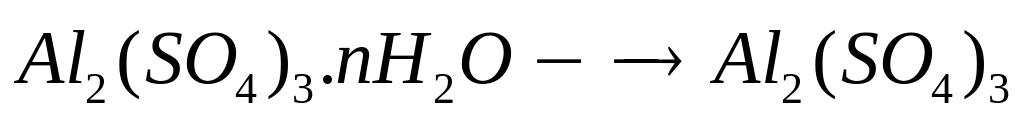 1 моль 1 моль
(342+18n)
г/моль 342 г/моль
1 моль 1 моль
(342+18n)
г/моль 342 г/моль
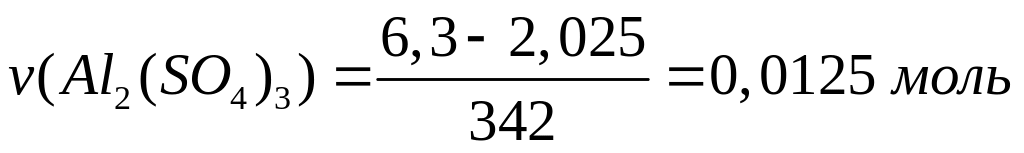
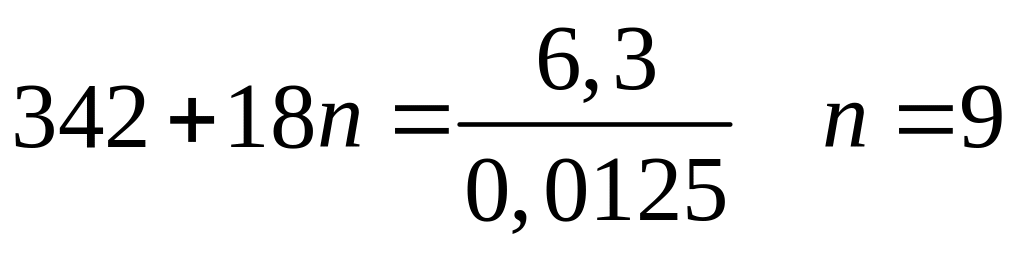 III
способ
III
способ
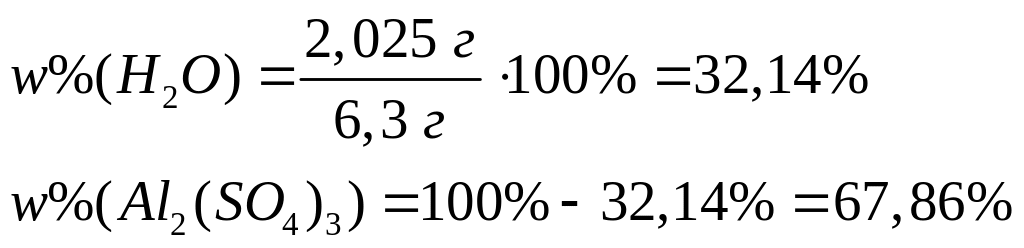
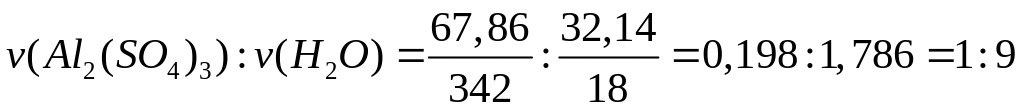 Решите:
При
обезвоживании 8,67 г
выделяется 2,16 г воды. Определите формулу
кристаллогидрата.
Решите:
При
обезвоживании 8,67 г
выделяется 2,16 г воды. Определите формулу
кристаллогидрата.При термическом разложении 8,52 г нитрата металла (III) образовалось 2,04 г твердого остатка. Определите формулу нитрата.
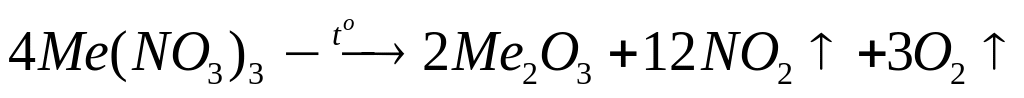 4 моль 2 моль
(х+186) г/моль
(2х+48) г/моль
4 моль 2 моль
(х+186) г/моль
(2х+48) г/моль
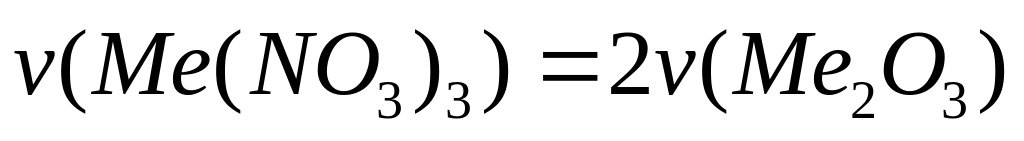
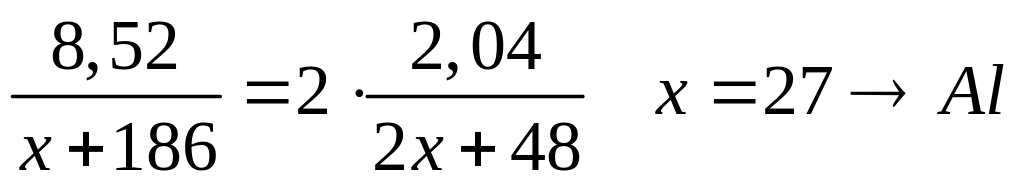
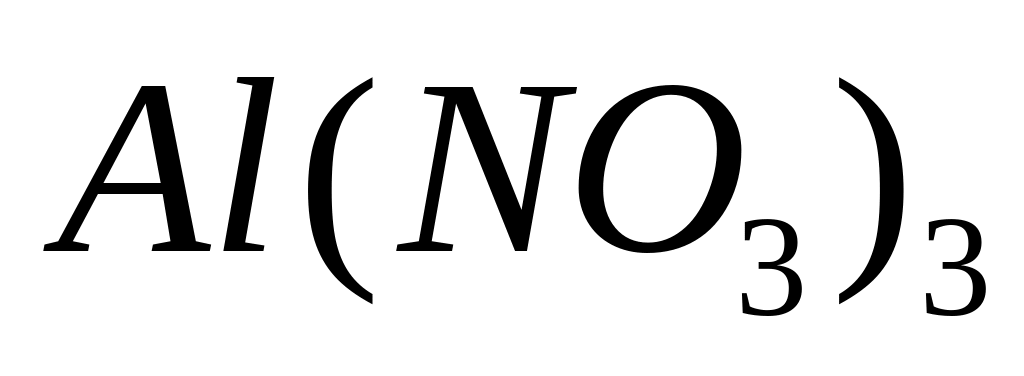 - нитрат алюминия.
Решите:
При
термическом разложении 8,96 г нитрата
металла (III) образовалось
3,29 г твердого остатка. Определите
формулу нитрата.
- нитрат алюминия.
Решите:
При
термическом разложении 8,96 г нитрата
металла (III) образовалось
3,29 г твердого остатка. Определите
формулу нитрата.При полном окислении 1,350 г вещества кислородом образуется 2,050 г метаалюмината натрия и 0,900 г воды. Выведите формулу вещества.
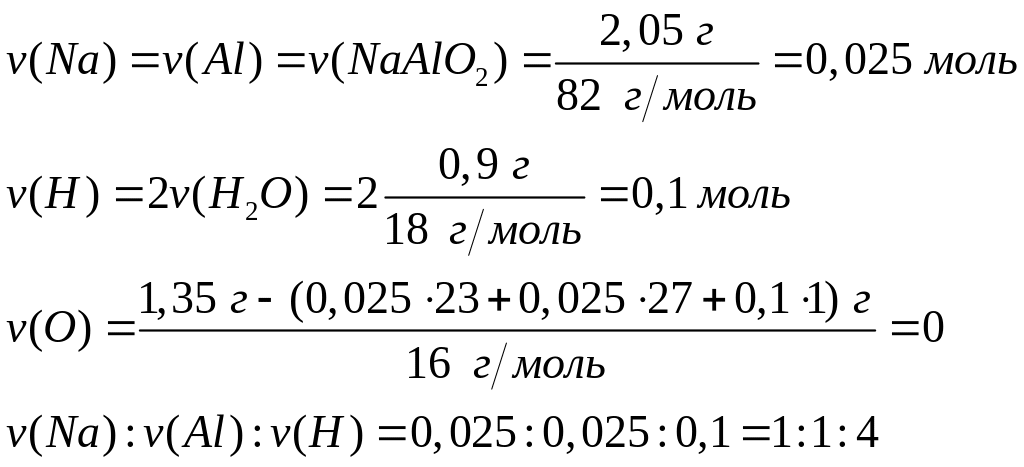

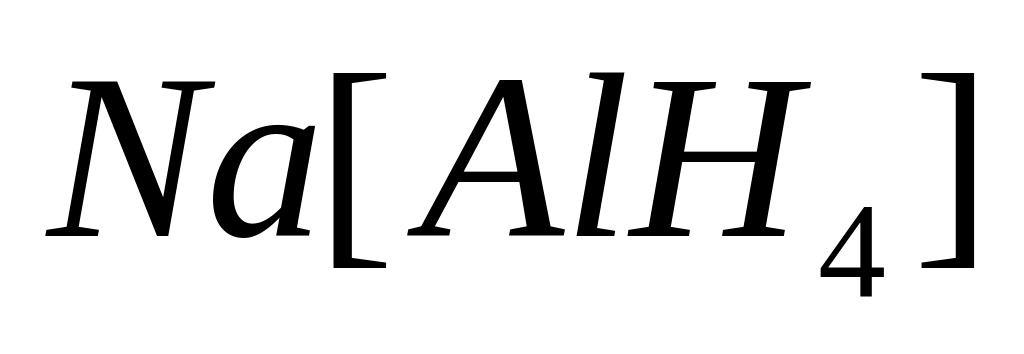 тетрагидридоалюминат натрия, алюмогидрид
натрия.
Решите:
При полном
окислении 3,04 г вещества кислородом
образуется 5,28 г метабората натрия и
2,88 г воды. Выведите формулу вещества.
тетрагидридоалюминат натрия, алюмогидрид
натрия.
Решите:
При полном
окислении 3,04 г вещества кислородом
образуется 5,28 г метабората натрия и
2,88 г воды. Выведите формулу вещества.При полном окислении 1,368 г вещества кислородом образуется 0,612 г оксида алюминия, 1,6128 л оксида углерода (IV) и 1,62 г воды. Выведите формулу вещества.
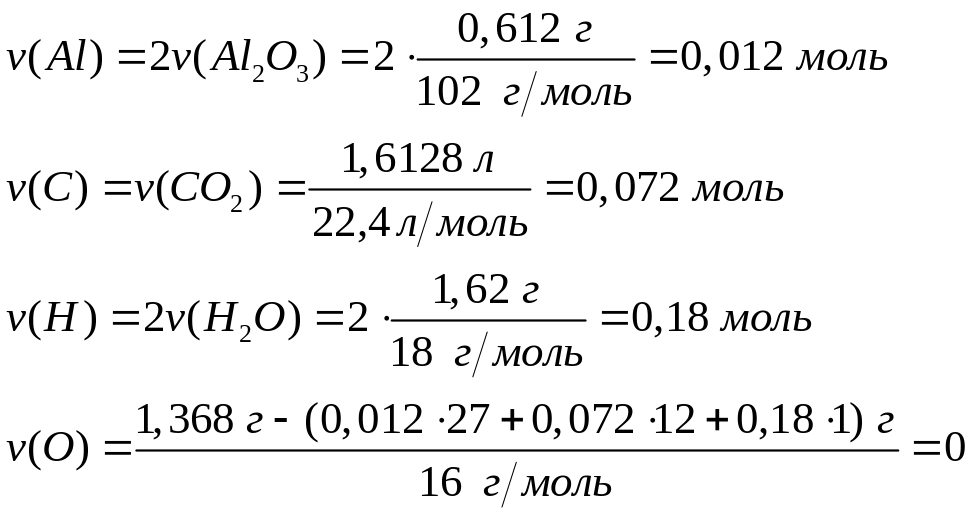

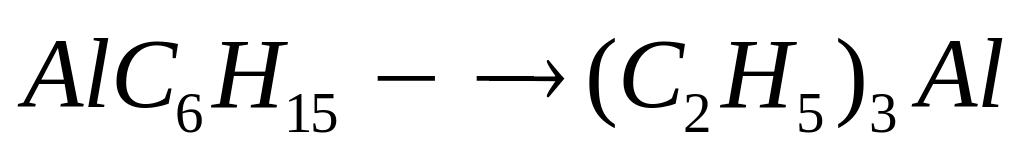 триэтилалюминий
Решите:
При
полном окислении 2,88 г вещества кислородом
образуется 2,04 г оксида алюминия, 2,688 л
оксида углерода (IV) и 3,24
г воды. Выведите формулу вещества.
триэтилалюминий
Решите:
При
полном окислении 2,88 г вещества кислородом
образуется 2,04 г оксида алюминия, 2,688 л
оксида углерода (IV) и 3,24
г воды. Выведите формулу вещества.При полном окислении 1,8 г вещества кислородом образуется 0,765 г оксида алюминия, 1,0080 л оксида углерода (IV) и 1,2150 г воды. Выведите формулу вещества.

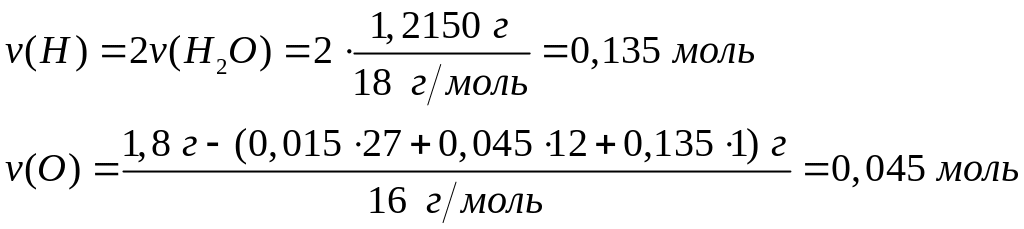
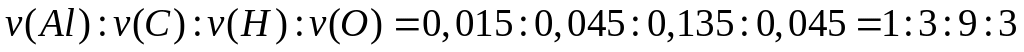
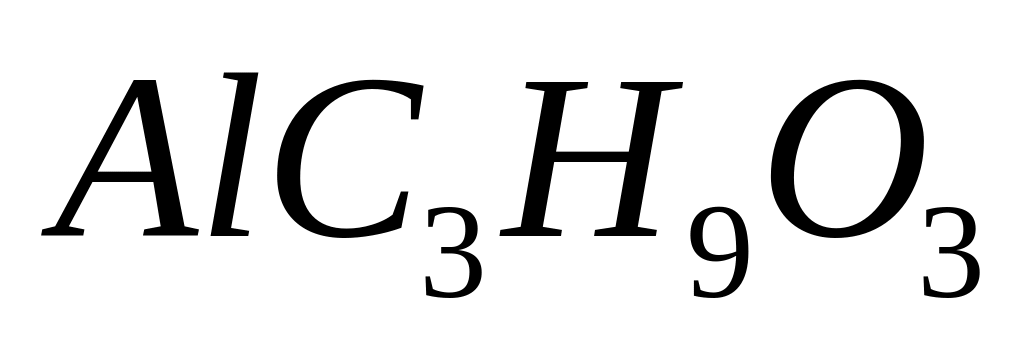
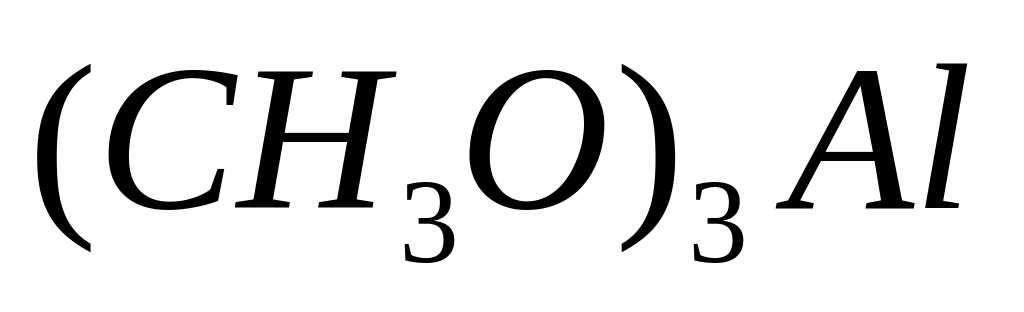 - метилат алюминия.
Решите:
При
полном окислении 1,944 г вещества кислородом
образуется 0,612 г оксида алюминия, 1,6128
л оксида углерода (IV) и
1,62 г воды. Выведите формулу вещества.
- метилат алюминия.
Решите:
При
полном окислении 1,944 г вещества кислородом
образуется 0,612 г оксида алюминия, 1,6128
л оксида углерода (IV) и
1,62 г воды. Выведите формулу вещества.При полном окислении 1,296 г вещества кислородом образуется 0,408 г оксида алюминия, 537,6 мл оксида углерода (IV) и 0,216 г воды. Выведите формулу вещества.
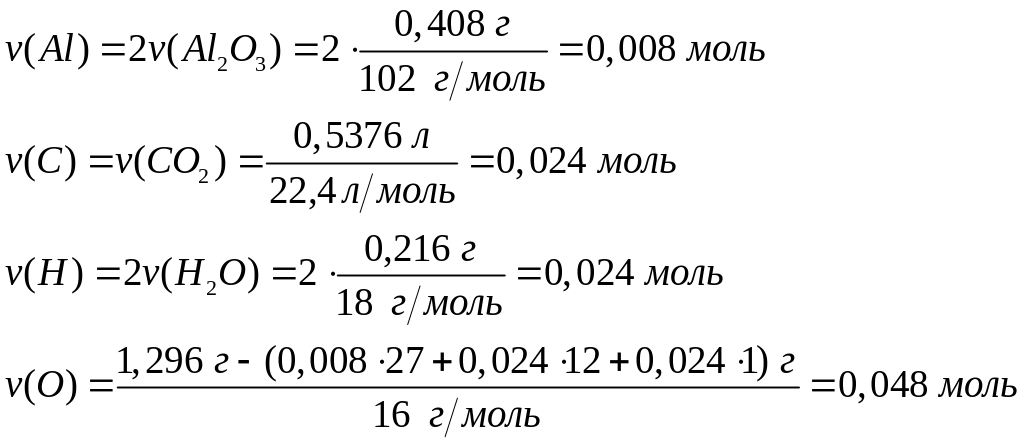
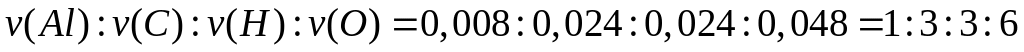
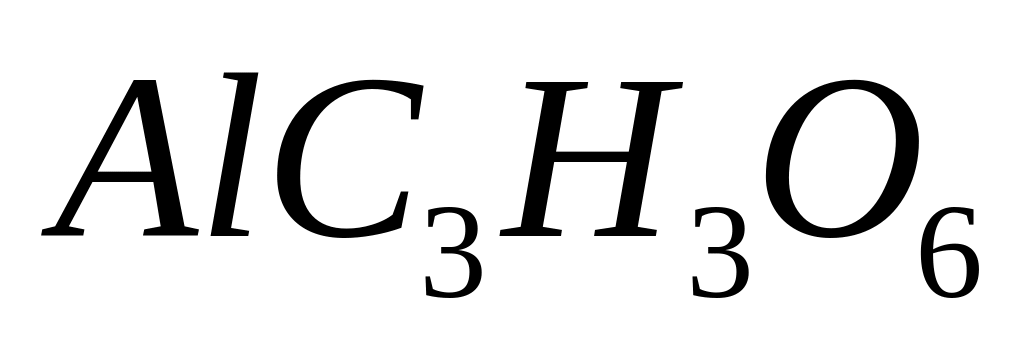
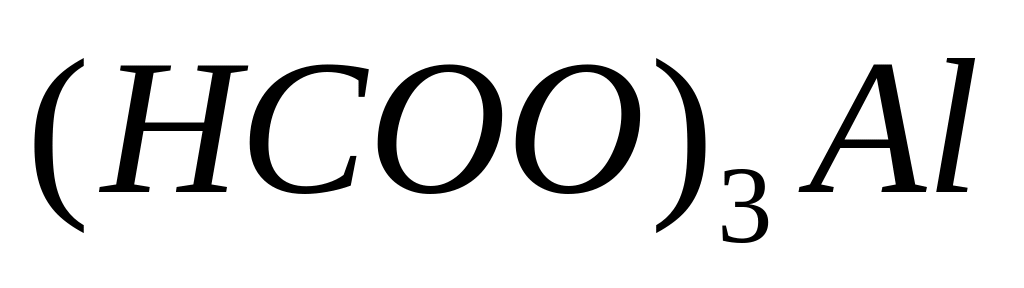 - формиат алюминия.
Решите:
При
полном окислении 1,632 г вещества кислородом
образуется 0,408 г оксида алюминия, 1,0752
л оксида углерода (IV) и
0,648 г воды. Выведите формулу вещества.
- формиат алюминия.
Решите:
При
полном окислении 1,632 г вещества кислородом
образуется 0,408 г оксида алюминия, 1,0752
л оксида углерода (IV) и
0,648 г воды. Выведите формулу вещества.Для полного окисления 0,06 моль алкоголята алюминия
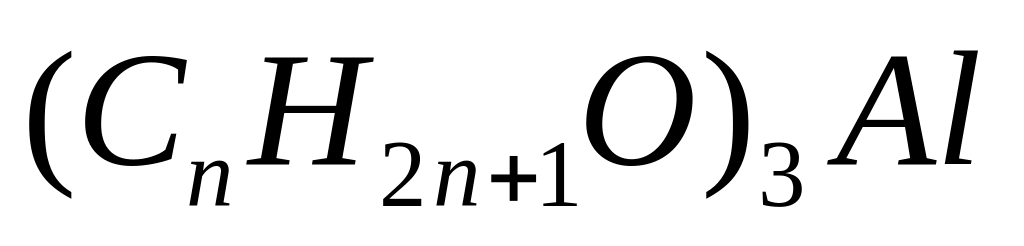 потребовалось 12,096 л кислорода. Определите
молекулярную формулу алкоголята
алюминия.
потребовалось 12,096 л кислорода. Определите
молекулярную формулу алкоголята
алюминия.
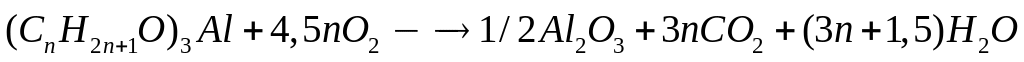 1 моль 4,5n моль
1 моль 4,5n моль
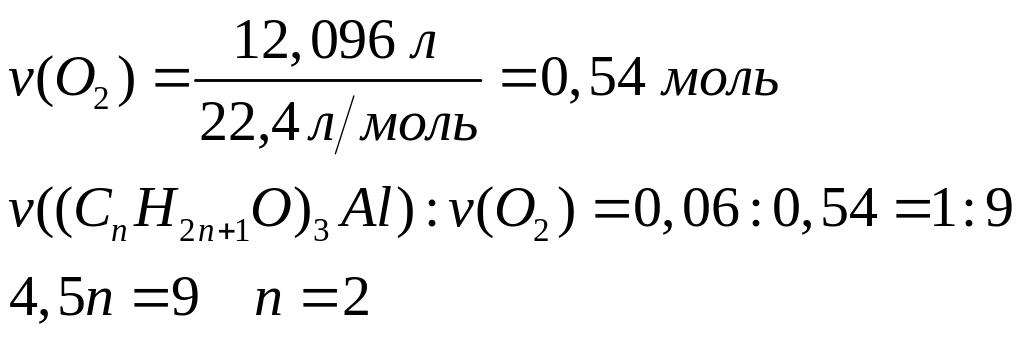
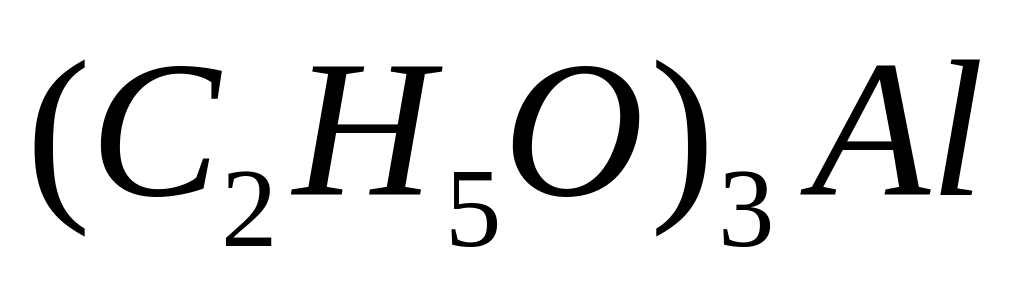 - этилат алюминия.
Решите:
Для
полного окисления 0,04 моль алкоголята
алюминия
потребовалось 4,032 л кислорода. Определите
молекулярную формулу алкоголята
алюминия.
- этилат алюминия.
Решите:
Для
полного окисления 0,04 моль алкоголята
алюминия
потребовалось 4,032 л кислорода. Определите
молекулярную формулу алкоголята
алюминия.Раствор галогенида алюминия объемом 98,89 мл с массовой долей 10% (=1,08 г/мл) полностью реагирует с 82,55 мл 20%-го раствора нитрата свинца (=1,203 г/мл). Определите формулу галогенида алюминия. 0,04 моль 0,06 моль
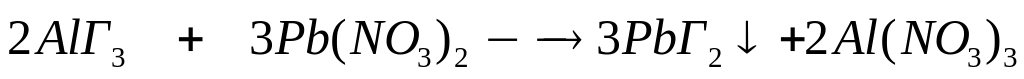 2
моль 3 моль
(27+3х)г/моль 331 г/моль
2
моль 3 моль
(27+3х)г/моль 331 г/моль
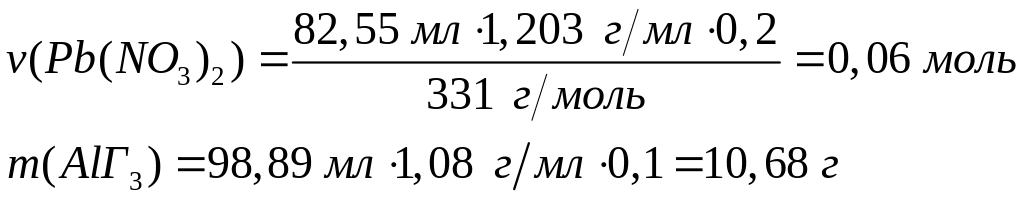
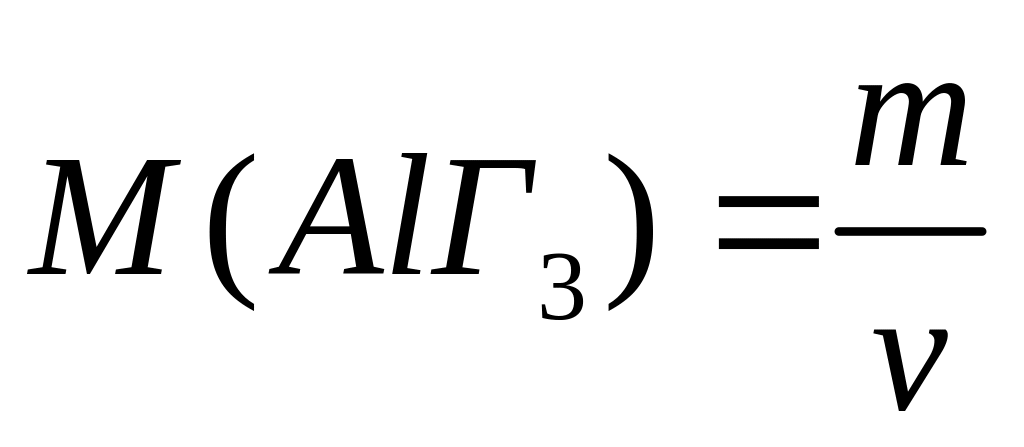
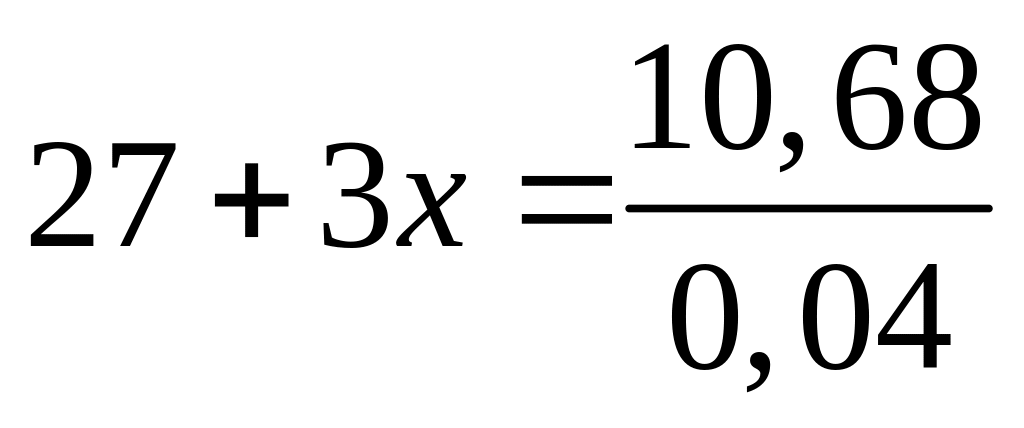
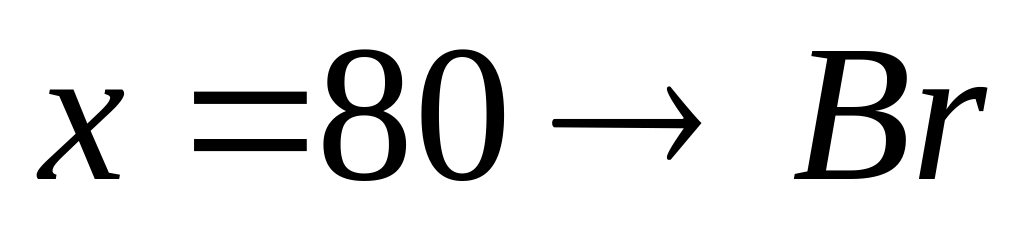
 - бромид алюминия.
Решите:
Раствор
галогенида алюминия объемом 50,68 мл с
массовой долей 14% (=1,129
г/мл) полностью реагирует с 94 мл 25%-го
раствора нитрата свинца (=1,268
г/мл). Определите формулу галогенида
алюминия.
- бромид алюминия.
Решите:
Раствор
галогенида алюминия объемом 50,68 мл с
массовой долей 14% (=1,129
г/мл) полностью реагирует с 94 мл 25%-го
раствора нитрата свинца (=1,268
г/мл). Определите формулу галогенида
алюминия.При взаимодействии 97,9 мл 15%-го раствора сульфата алюминия (=1,164 г/мл) с 91,4 мл раствора карбоната щелочного металла (=1,16 г/мл) образовался 10,36%-ный раствор сульфата щелочного металла. Определите металл. 0,05 моль 0,15 моль 0,1 моль 0,15 моль 0,15 моль
 1 моль 3 моль 2 моль
3 моль 3 моль
342 г/моль
(2х+60) г/моль 78 г/моль 44 г/моль
(2х+96) г/моль
1 моль 3 моль 2 моль
3 моль 3 моль
342 г/моль
(2х+60) г/моль 78 г/моль 44 г/моль
(2х+96) г/моль
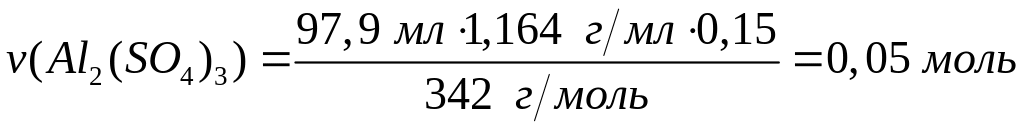
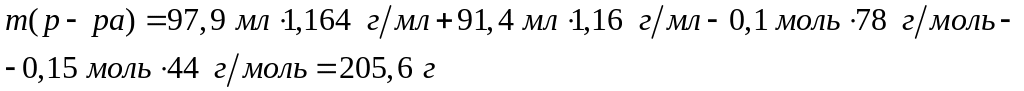
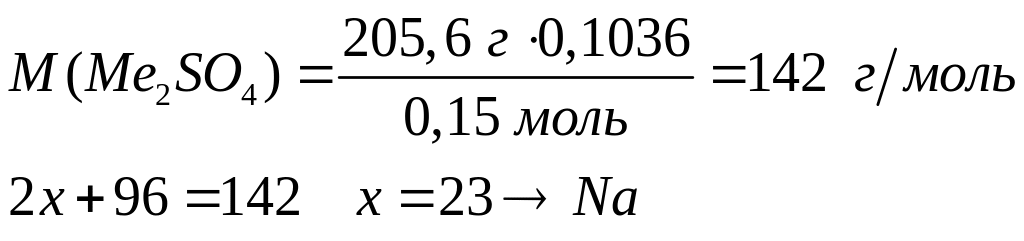
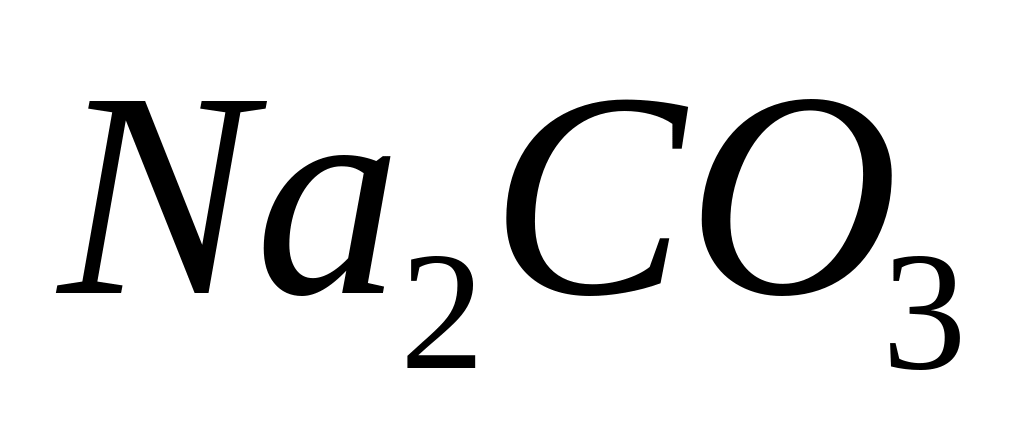 - карбонат натрия.
Решите:
При
взаимодействии 70,32 мл 16%-го раствора
нитрата алюминия (=1,136
г/мл) с 52,2 мл раствора карбоната щелочного
металла (=1,19 г/мл)
образовался 13,632%-ный раствор нитрата
щелочного металла. Определите металл.
- карбонат натрия.
Решите:
При
взаимодействии 70,32 мл 16%-го раствора
нитрата алюминия (=1,136
г/мл) с 52,2 мл раствора карбоната щелочного
металла (=1,19 г/мл)
образовался 13,632%-ный раствор нитрата
щелочного металла. Определите металл.Соединение
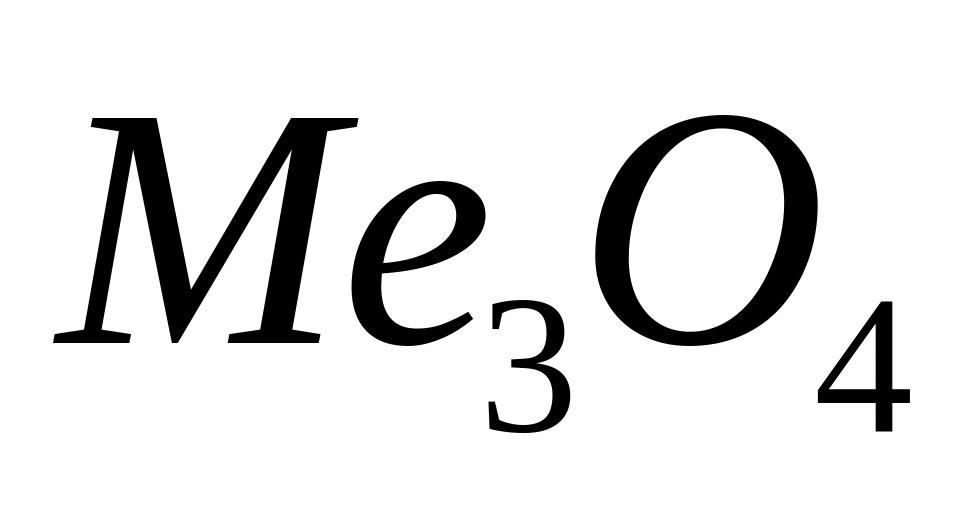 массой 13,92 г полностью реагирует с 4,32
г алюминия. Определите соединение,
назовите его.
массой 13,92 г полностью реагирует с 4,32
г алюминия. Определите соединение,
назовите его.
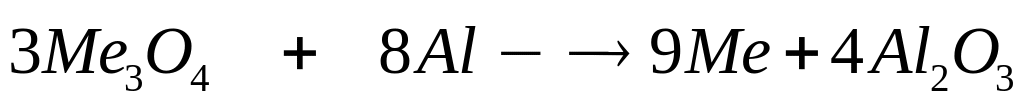 3
моль 8 моль
(3х+64) г/моль 27
г/моль
3
моль 8 моль
(3х+64) г/моль 27
г/моль

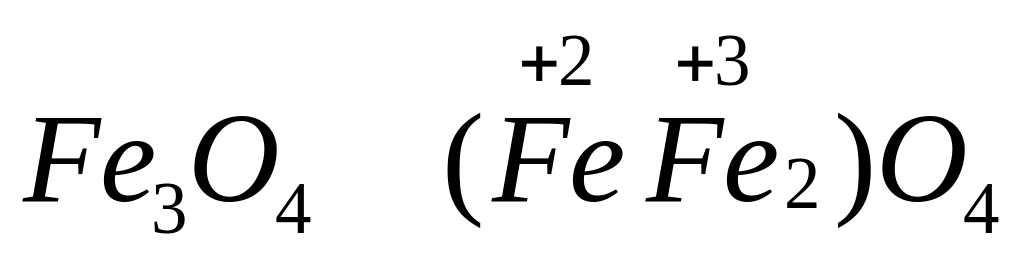 - оксид дижелеза (III)-железа
(II), магнетит, магнитный
железняк,
закись-окись
железа.
Решите:
Соединение
массой 17,175 г полностью реагирует с 5,4
г алюминия. Определите соединение,
назовите его.
- оксид дижелеза (III)-железа
(II), магнетит, магнитный
железняк,
закись-окись
железа.
Решите:
Соединение
массой 17,175 г полностью реагирует с 5,4
г алюминия. Определите соединение,
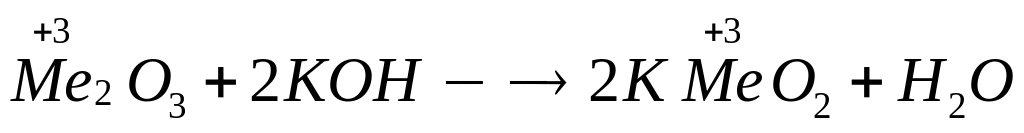
назовите его.Оксид металла (III) массой 7,65 г при сплавлении с гидроксидом калия образует 14,7 г
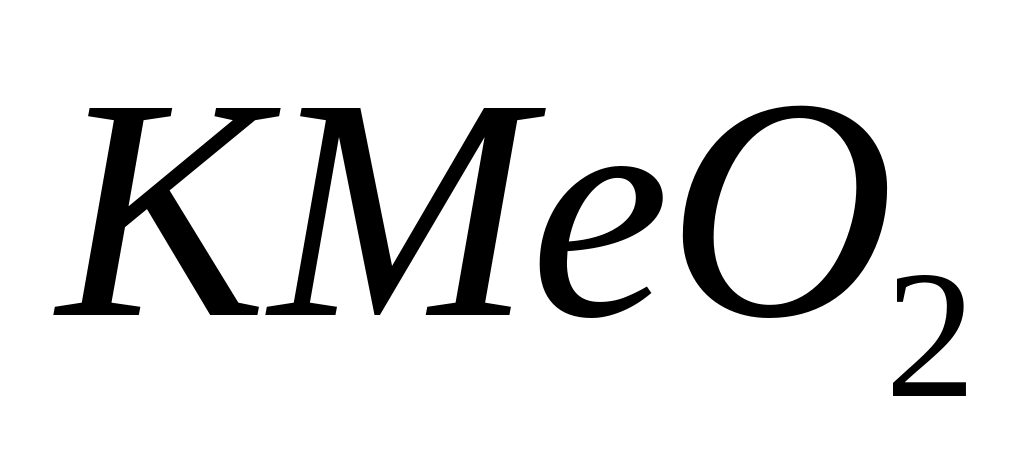 .
Определите металл, назовите соединение
металла.
.
Определите металл, назовите соединение
металла.
 1
моль 2 моль
(2х+48) г/моль
(х+71) г/моль
1
моль 2 моль
(2х+48) г/моль
(х+71) г/моль
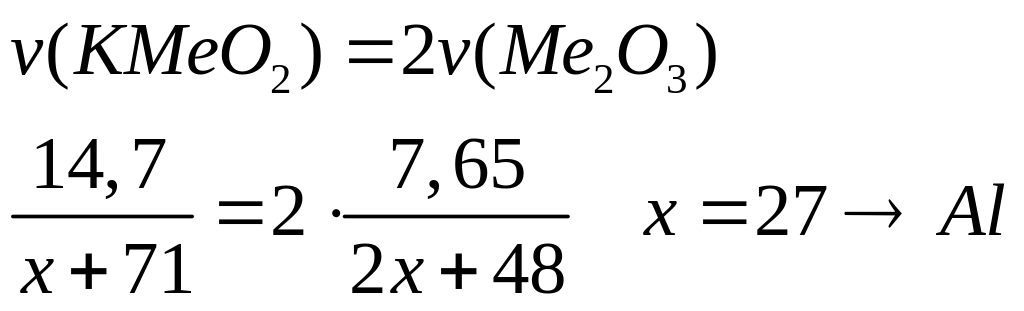 - оксид алюминия.
- оксид алюминия.
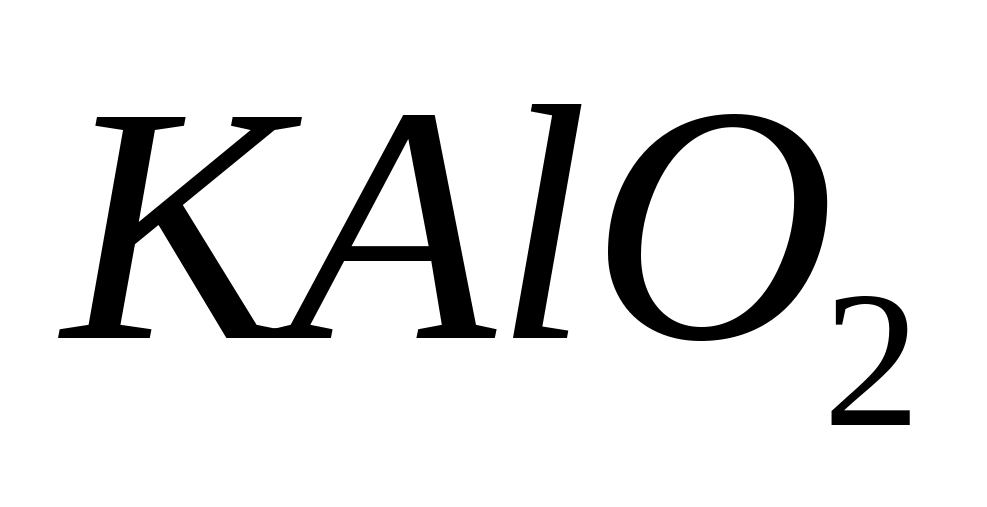 - алюминат калия.
Решите:
Оксид
металла (III) массой 5,61 г
при сплавлении с гидроксидом натрия
образует 9,02 г NaMeO2.
Определите металл, назовите соединение
металла.
- алюминат калия.
Решите:
Оксид
металла (III) массой 5,61 г
при сплавлении с гидроксидом натрия
образует 9,02 г NaMeO2.
Определите металл, назовите соединение
металла.Гидроксид металла массой 6,24 г полностью реагирует с 51,6 мл 20%-го раствора серной кислоты (=1,1 г/мл). Определите гидроксид металла.
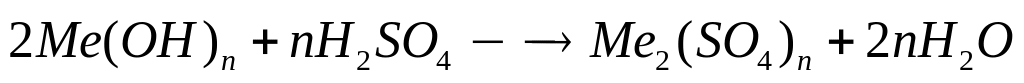 2 моль n моль
(х+17n)
г/моль 98 г/моль
2 моль n моль
(х+17n)
г/моль 98 г/моль
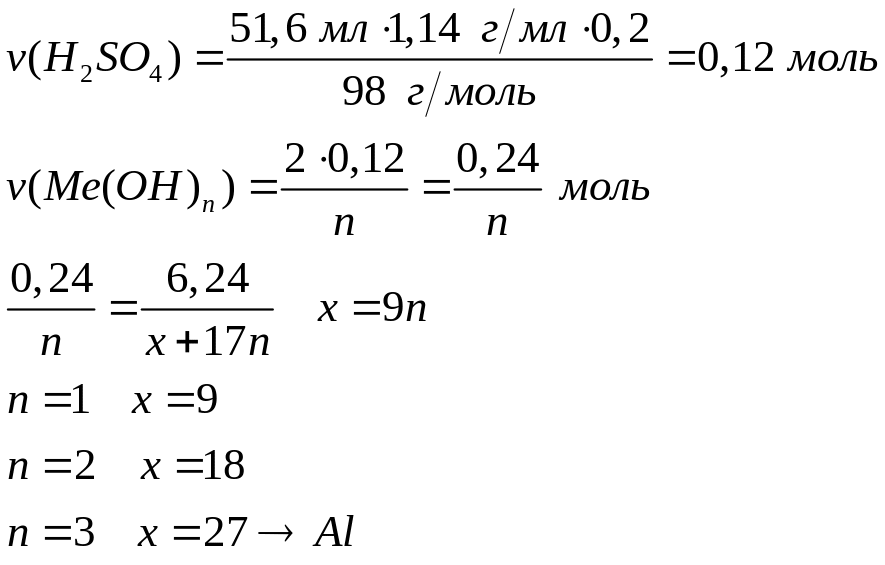
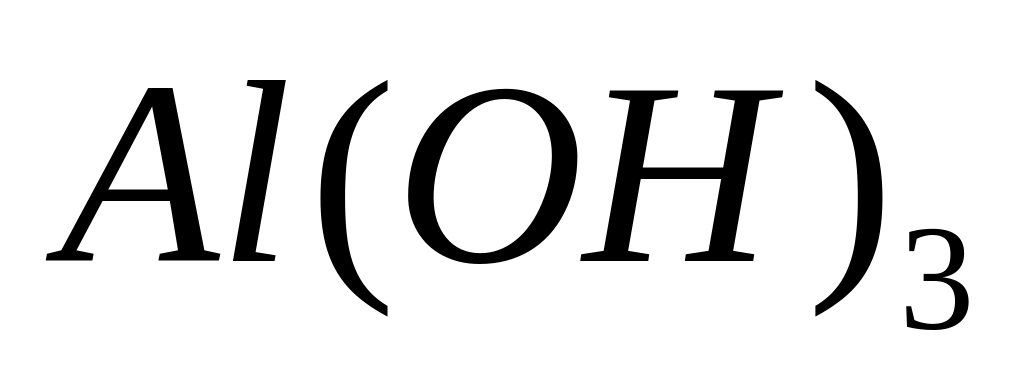 - гидроксид алюминия.
Решите:
Гидроксид
металла массой 12,45 г полностью реагирует
с 63,6 мл 20%-го раствора азотной кислоты
(=1,115 г/мл). Определите
гидроксид металла.
- гидроксид алюминия.
Решите:
Гидроксид
металла массой 12,45 г полностью реагирует
с 63,6 мл 20%-го раствора азотной кислоты
(=1,115 г/мл). Определите
гидроксид металла.Алюминий массой 4,86 г полностью реагирует с 115,9 мл 30%-го раствора галогенводородной кислоты (=1,258 г/мл). Определите формулу кислоты.
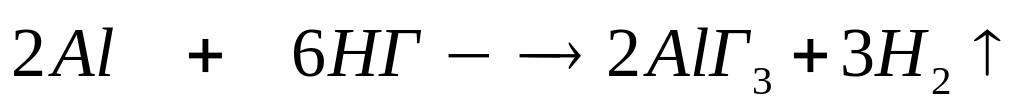 2
моль 6 моль
27 г/моль (х+1) г/моль
2
моль 6 моль
27 г/моль (х+1) г/моль
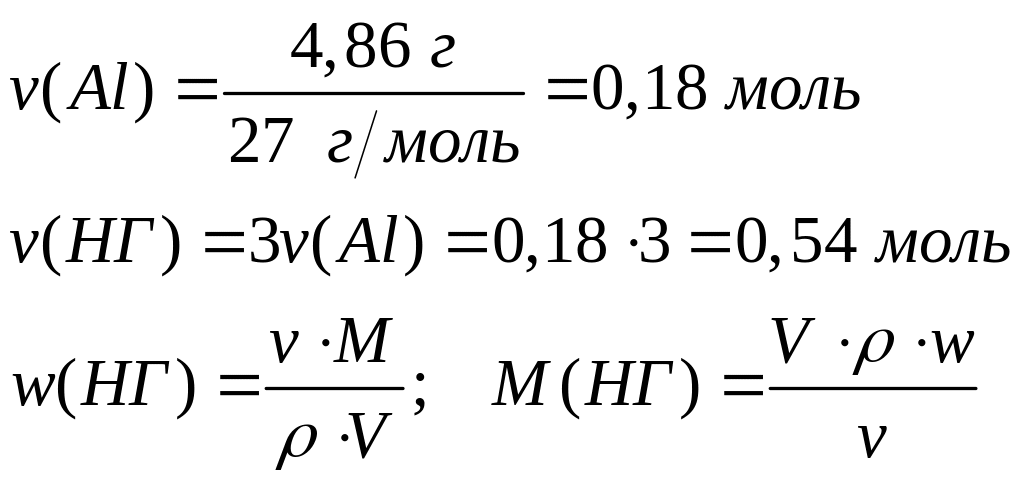

 - бромоводородная кислота.
Решите:
Гидроксид
алюминия массой 6,24 г полностью реагирует
с 39,82 мл 20%-го раствора галогенводородной
кислоты (=1,1 г/мл).
Определите формулу кислоты.
- бромоводородная кислота.
Решите:
Гидроксид
алюминия массой 6,24 г полностью реагирует
с 39,82 мл 20%-го раствора галогенводородной
кислоты (=1,1 г/мл).
Определите формулу кислоты.Оксид алюминия массой 5,61 г полностью реагирует при нагревании с 39,6 г гидросульфата щелочного металла с образованием сульфатов и воды. Определите металл.
 1
моль 6 моль
102 г/моль (х+97) г/моль
1
моль 6 моль
102 г/моль (х+97) г/моль
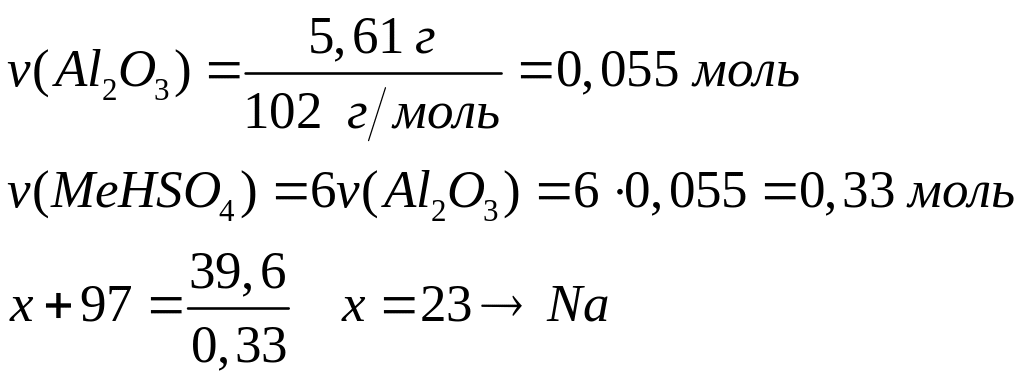
 - гидросульфат натрия.
Решите:
Гидроксид
алюминия массой 5,85 г полностью реагирует
при нагревании с 132,92 мл 20%-го раствора
гидросульфата щелочного металла
(=1,151 г/мл) с
образованием сульфатов и воды. Определите
металл.
- гидросульфат натрия.
Решите:
Гидроксид
алюминия массой 5,85 г полностью реагирует
при нагревании с 132,92 мл 20%-го раствора
гидросульфата щелочного металла
(=1,151 г/мл) с
образованием сульфатов и воды. Определите
металл.При нагревании 3,24 г порошка алюминия полностью реагирует с 14,04 г пероксида щелочного металла с образованием алюмината натрия и оксида натрия. Определите металл.
 3 моль 2 моль
(2х+32) г/моль 27
г/моль
3 моль 2 моль
(2х+32) г/моль 27
г/моль

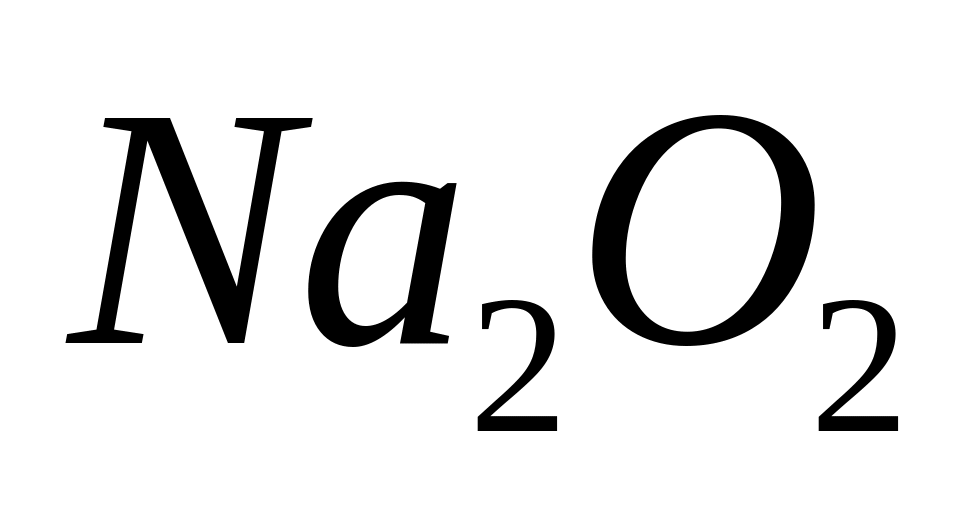 - пероксид натрия.
Решите:
Порошок
алюминия массой 4,32 г при нагревании
полностью реагирует с 26,4г пероксида
щелочного металла с образованием
алюмината натрия и оксида натрия.
Определите металл.
- пероксид натрия.
Решите:
Порошок
алюминия массой 4,32 г при нагревании
полностью реагирует с 26,4г пероксида
щелочного металла с образованием
алюмината натрия и оксида натрия.
Определите металл.Порошок алюминия массой 4,05 г полностью реагирует при нагревании с 10,65 г надпероксида щелочного металла с образованием алюмината щелочного металла. Определите металл.
 1
моль 1 моль
(х+32) г/моль 27 г/моль
1
моль 1 моль
(х+32) г/моль 27 г/моль
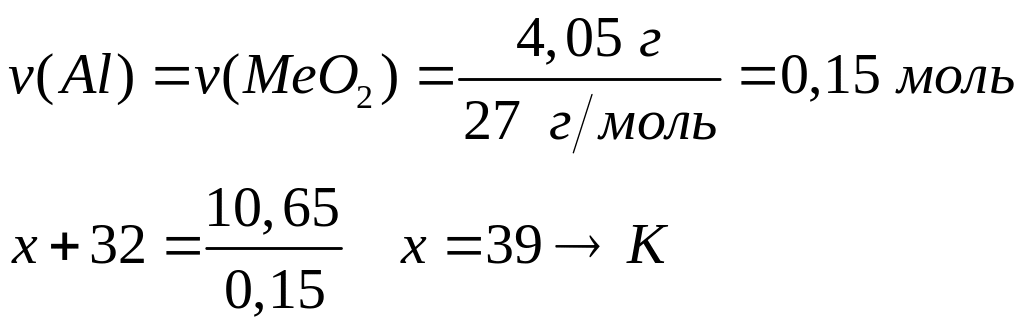
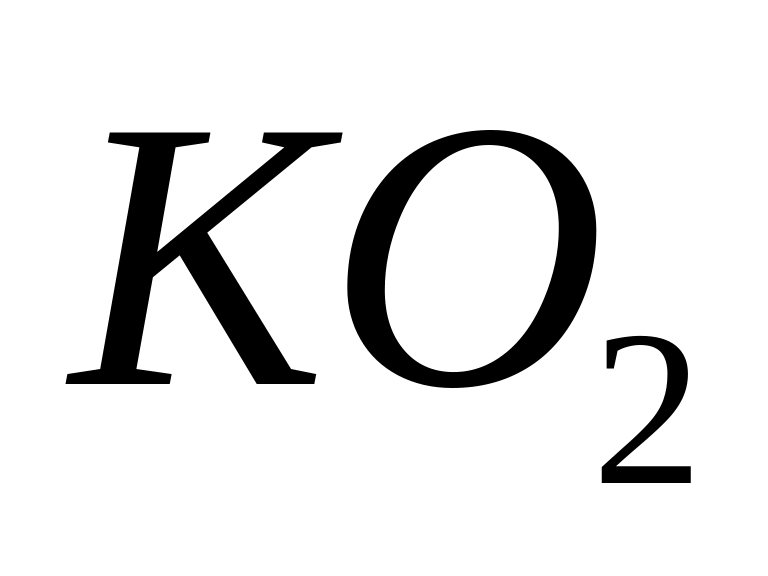 - надпероксид калия.
Решите:
Порошок
алюминия массой 4,86 г полностью реагирует
при нагревании с 9,9 г надпероксида
щелочного металла с образованием
алюмината щелочного металла. Определите
металл.
- надпероксид калия.
Решите:
Порошок
алюминия массой 4,86 г полностью реагирует
при нагревании с 9,9 г надпероксида
щелочного металла с образованием
алюмината щелочного металла. Определите
металл.Соединение
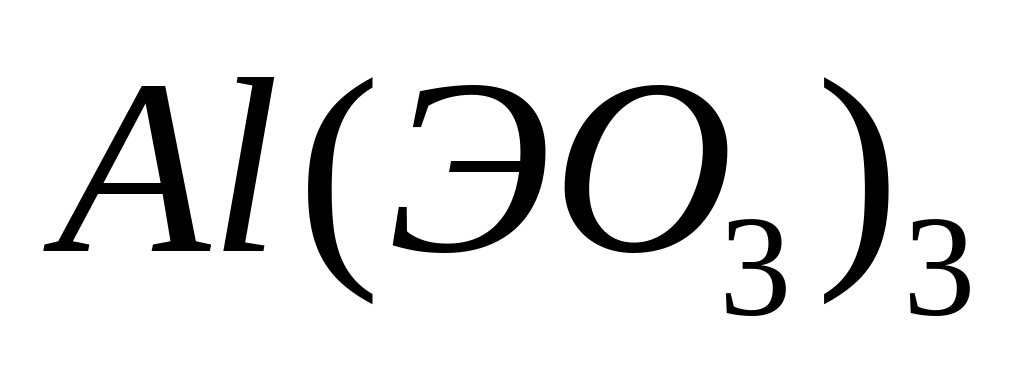 массой 8,22 г растворили в воде и получили
раствор объемом 50 мл. Полученный раствор
объемом 25 мл полностью реагирует с 21,4
мл 20%-го раствора нитрата серебра
(=1,194 г/мл) с
образованием осадка. Определите формулу
соединения, назовите его, вычислите
молярную концентрацию в исходном
растворе.
массой 8,22 г растворили в воде и получили
раствор объемом 50 мл. Полученный раствор
объемом 25 мл полностью реагирует с 21,4
мл 20%-го раствора нитрата серебра
(=1,194 г/мл) с
образованием осадка. Определите формулу
соединения, назовите его, вычислите
молярную концентрацию в исходном
растворе.
 1 моль 3 моль
(3х+171) г/моль 170
г/моль
1 моль 3 моль
(3х+171) г/моль 170
г/моль
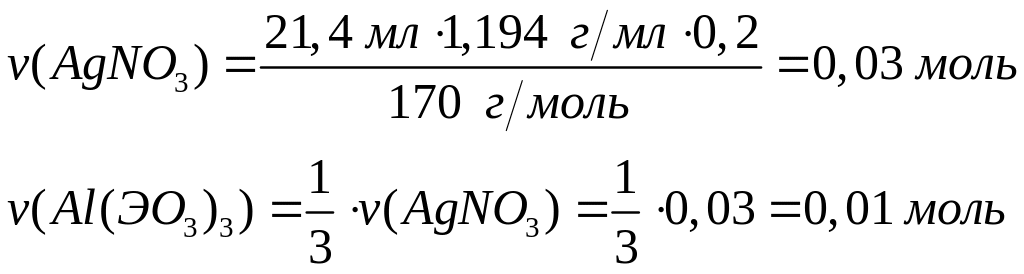 В
50 мл
В
50 мл
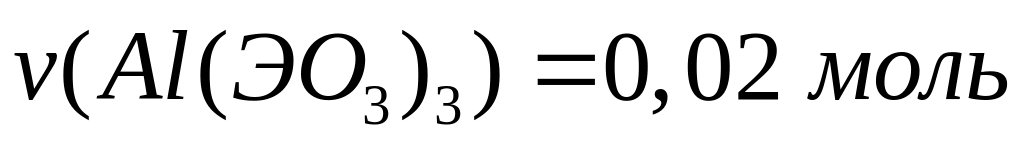
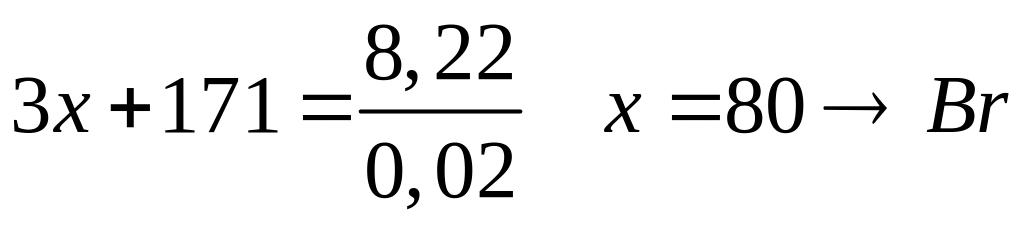
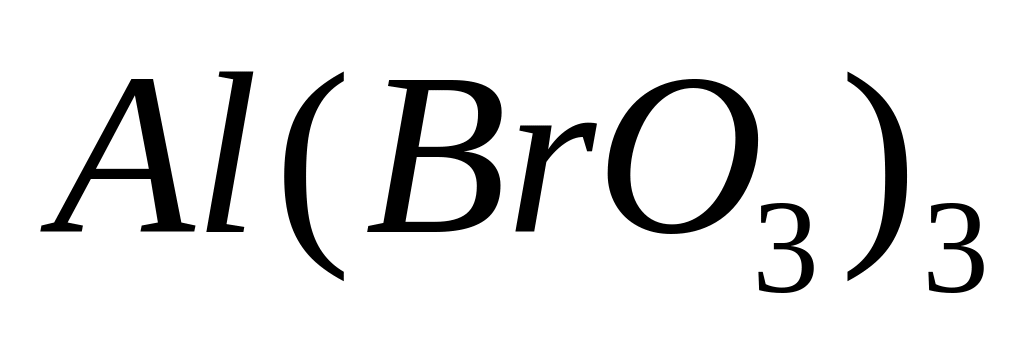 - бромат алюминия.
- бромат алюминия.
 Решите:
Соединение
массой 17,04 г растворили в воде и получили
раствор объемом 50 мл. Полученный раствор
объемом 25 мл полностью реагирует с 11,1
мл 20%-го раствора аммиака (=0,922
г/мл) с образованием осадка. Определите
формулу соединения, назовите его,
вычислите молярную концентрацию в
исходном растворе.
Решите:
Соединение
массой 17,04 г растворили в воде и получили
раствор объемом 50 мл. Полученный раствор
объемом 25 мл полностью реагирует с 11,1
мл 20%-го раствора аммиака (=0,922
г/мл) с образованием осадка. Определите
формулу соединения, назовите его,
вычислите молярную концентрацию в
исходном растворе.Сульфид трехвалентного металла растворили в необходимом объеме 12%-го раствора серной кислоты и получили 13,7%-ный раствор сульфата металла. Установите формулу сульфида металла. 1 моль 3 моль 1 моль 3 моль
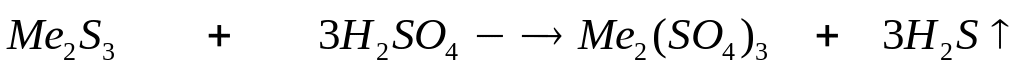 1
моль 3 моль 1 моль
3 моль
(2х+96) г/моль 98 г/моль
(2х+288) г/моль 34 г/моль
1
моль 3 моль 1 моль
3 моль
(2х+96) г/моль 98 г/моль
(2х+288) г/моль 34 г/моль
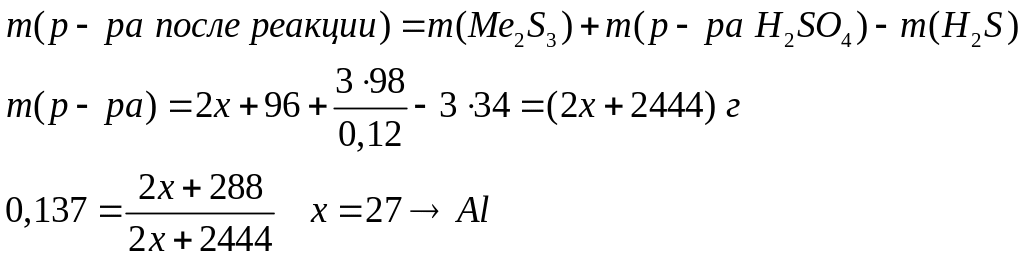
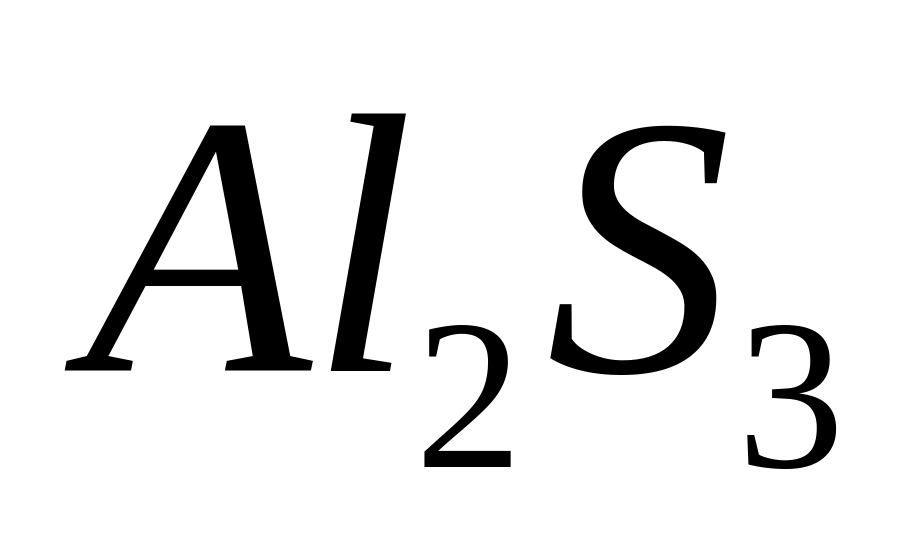 - сульфид алюминия.
Решите:
Сульфид
трехвалентного металла растворили в
необходимом объеме 15%-го раствора
соляной кислоты и получили 17,706%-ный
раствор хлорида металла. Установите
формулу сульфида металла.
- сульфид алюминия.
Решите:
Сульфид
трехвалентного металла растворили в
необходимом объеме 15%-го раствора
соляной кислоты и получили 17,706%-ный
раствор хлорида металла. Установите
формулу сульфида металла.Тетрагидридоалюминат щелочного металла массой 1,14 г полностью реагирует с 34,5 мл 12%-го раствора соляной кислоты (=1,06 г/мл). Определите металл, вычислите массовые доли веществ в растворе после реакции.
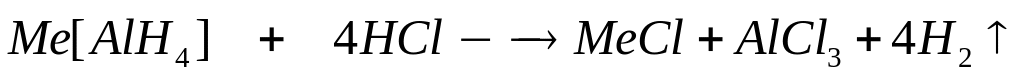 1 моль 4 моль
(х+31) г/моль 36,5
г/моль
1 моль 4 моль
(х+31) г/моль 36,5
г/моль
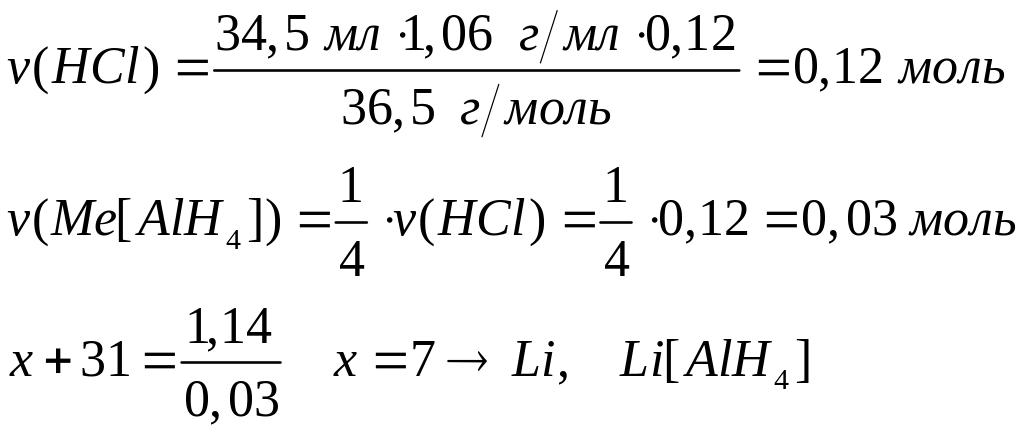 0,03 моль 0,12 моль 0,03 моль 0,03 моль
0,12 моль
0,03 моль 0,12 моль 0,03 моль 0,03 моль
0,12 моль
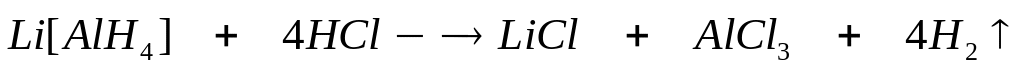 1 моль 4 моль 1 моль 1 моль
4 моль
42,5 г/моль 133,5 г/моль
2 г/моль
1 моль 4 моль 1 моль 1 моль
4 моль
42,5 г/моль 133,5 г/моль
2 г/моль
 Решите:
Тетрагидридоалюминат
щелочного металла массой 2,16 г полностью
реагирует с 47,4 мл 15%-го раствора серной
кислоты (=1,103 г/мл).
Определите металл, вычислите массовые
доли веществ в растворе после реакции.
Решите:
Тетрагидридоалюминат
щелочного металла массой 2,16 г полностью
реагирует с 47,4 мл 15%-го раствора серной
кислоты (=1,103 г/мл).
Определите металл, вычислите массовые
доли веществ в растворе после реакции.Алюминий массой 2,16 г полностью реагирует при нагревании с 2,688 л этилена с образованием твердого продукта и 5,376 л водорода. Установите формулу твердого продукта, назовите его.
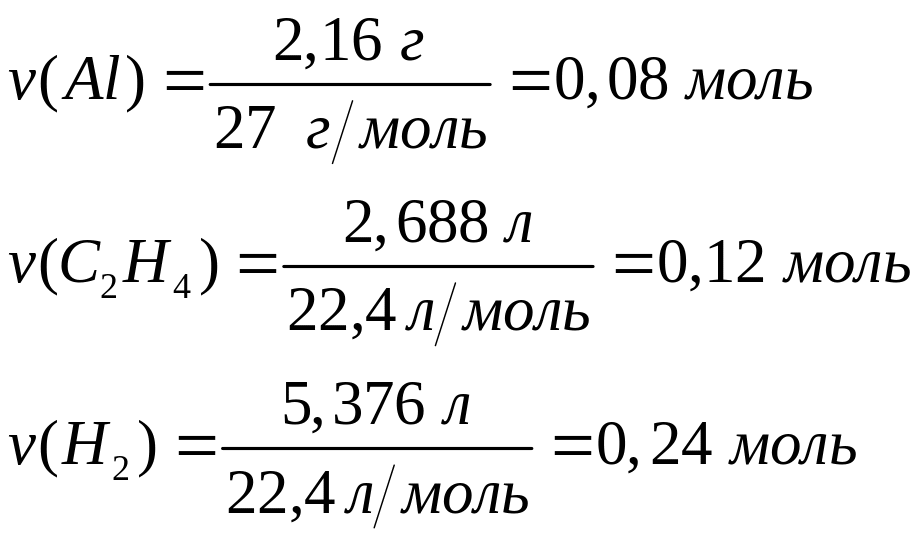
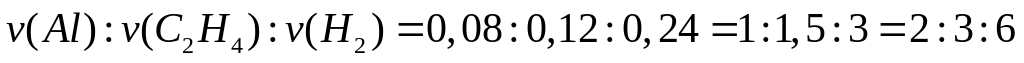
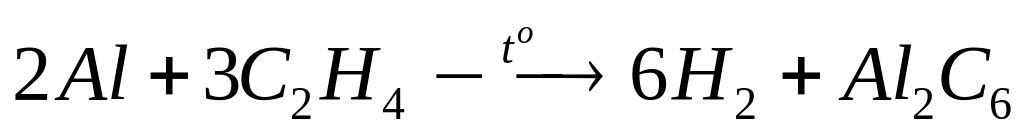
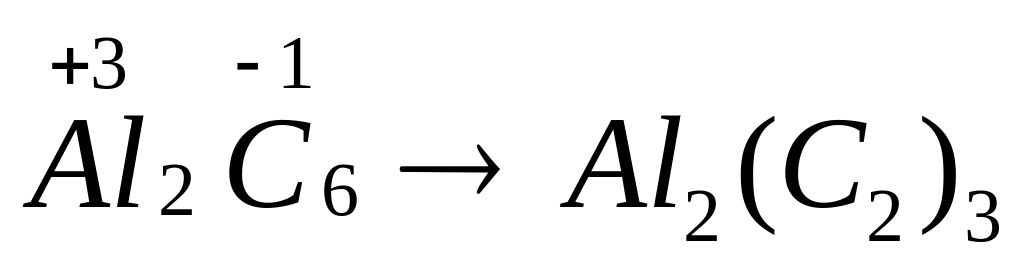 - ацетиленид алюминия.
Решите:
Алюминий
массой 3,24 г полностью реагирует при
нагревании с 4,032 л этана с образованием
твердого продукта и 12,096 л водорода.
Установите формулу твердого продукта,
назовите его.
- ацетиленид алюминия.
Решите:
Алюминий
массой 3,24 г полностью реагирует при
нагревании с 4,032 л этана с образованием
твердого продукта и 12,096 л водорода.
Установите формулу твердого продукта,
назовите его.
