
- •Задача 1а
- •Задача 2а
- •Задача 3а
- •Задача 4а
- •Задача 5а
- •Задача 6а
- •Задача 7а
- •Задача 8а
- •Задача 1б
- •Задача 2б
- •Задача 3б
- •Задача 4б
- •Задача 5б
- •Задача 6б
- •Задача 7б
- •Задача 8б
- •Решения Задача 1а
- •Задача 1 б
- •Задача 2а (2б).
- •Задача 3а.
- •Задача 4а.
- •Задача 5а (она же 5б)
- •Задача 6а.
- •Задача 6б.
- •Задача 7а (она же 7б)
Задача 5а (она же 5б)
1. Строение (2 балла)
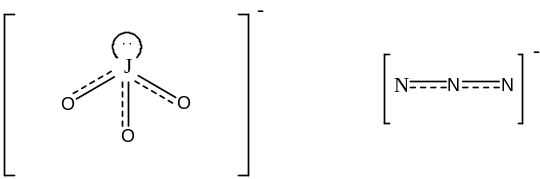
2. Насыщенными называют растворы, находящиеся в термодинамическом равновесии с осадком растворённого вещества (1 балл).
Уравнения равновесных реакций и константы равновесий:
AgN3 (тв.) Ag+ (р-р) + N3– (р-р); ПР = [Ag+] [N3–] = 10–8,54; (1 +1 = 2 балла)
AgIO3 (тв.) Ag+ (р-р) + IO3- (р-р); ПР = [Ag+] [IO3-] = 10–7,52. (1 +1 = 2 балла)
Протолиз анионов:
N3– + H2O HN3 + OH–; Kо = [HN3][OH–]/[N3–] = 10–14/Кк(HN3) = 10–4,72 = 5,25·10–10,
(1 +1 + 1= 3 балла)
IO3- + H2O HIO3 + OH–; Kо = [HIO3][OH–]/[IO3–] = 10–14/Кк(HIO3) 10–14/10–0,79 = 6,17·10–14
(1 +1 + 1 = 3 балла)
3. Оба аниона, проявляя оснóвные свойства, подвергаются в воде протолизу (см. п. 2). Уменьшение рН раствора (т.е. подкисление) приведет к увеличению степени протолиза (т.е. к смещению равновесия вправо по принципу Ле Шателье – Брауна) и к увеличению растворимости осадков. (2 балла)
4. Запишем ещё раз уравнения равновесных процессов и константы равновесий:
AgX(т) Ag+ + X-; ПР = [Ag+][X-].
X-+ H2O HX + OH–; Kо = [HX][OH–]/[X–]
Без учета протолиза растворимость s = [Ag+] = [X–]. С учетом протолиза:
s = [Ag+] = [X–] + [НX].
Выразим [НX] из выражения для Ko (или Kк):
[HX] = [X-] [H+]/Kк. Тогда:
s = [X–] + [НX] = [X–] + [X-] [H+]/Kк = [X–]*(1+[H+]/Kк) = ПР/s *(1+[H+]/Kк)
(так как [X–] = ПР/[Ag+] = ПР/s).
s2 = ПР *(1+[H+]/Kк).
Отсюда ПРAgN3 *(1+[H+]/KкHN3) = ПРAgIO3 *(1+[H+]/Kк HIO3)
Решая это уравнение относительно [H+], получим:
[H+] = {К1К2*(ПР1-ПР2) / (К1*ПР2 – K2*ПР1)}
Подставив значения констант из условия, найдём:
[H+] = 1,81·10–4, рН = 3,74 (5 баллов)
Растворимость при этом значении рН составит s1 = s2 = 1,74·10–4 моль/л. (2 балла)
5. СТРОГОЕ РЕШЕНИЕ. Без учета протолиза рН = 7 и растворимость равна
s = (ПР)1/2 = 5.37*10-5.
Протолиз увеличивает растворимость соли и повышает рН насыщенного раствора. Запишем ещё раз уравнения равновесных процессов и константы равновесий:
AgX(т) Ag+ + X-; ПР = [Ag+][X-].
X-+ H2O HX + OH–; Kо = [HX][OH–]/[X–] = [HX]2/[X–].
С учетом протолиза s = [Ag+] = [X–] + [НX]. Из выражения для Ko получим
[HX] = (Ko*[X–])1/2. Следовательно [Ag+] = [X–] + [НX] = [X–] + (Ko*[X–])1/2.
С учетом этого выражение для ПР запишем так:
ПР = {[X–] + (Ko*[X–])1/2}* [X–] = [X–]2 + Ko1/2*[X–]3/2,
что равносильно уравнению:
[X–]4 – Ko*[X–]2 – 2ПР*[X–]2 + ПР2 = 0. (4 балла)
Подстановка Kо = 5,25·10–10 и ПР = 2,88·10–9 и решение уравнения методом последовательных приближений (в качестве первого приближения взято [N3-] = ПР1/2) даст
[N3-] = 5.42*10-5, (0.5 балла)
[НN3] = (Ко*[N3-])1/2 = 1.69*10-7, (0.5 балла)
s = [Ag+] = [N3–] + [НN3] = 5,44·10–5 моль/л, (0.5 балла)
[OH–] = [НN3] = 1,69·10–7 моль/л(0.5 балла).
[H+] = 5,92·10–8 моль/л (0.5 балла)
рН = 7,23 моль/л (0.5 балла)
ПРИБЛИЖЕННОЕ РЕШЕНИЕ. (7 баллов при тех же результатах)
Kо = [HN3][OH–]/[N3–] = [ОН]2/[N3–]. Отсюда [ОН]2 = Ко*[N3–].
Предположим, что ввиду малой константы протолиза концентрация азид-ионов изменилась не сильно. Тогда [N3–]~(ПР)1/2 и [ОН]2 = Ко*(ПР)1/2
После подстановки констант ответы практически совпадают.
И, наконец, самое приблизительное решение.
Примем, что протолиз практически не изменяет величину рН раствора, а именно рН = 7. Тогда, используя формулу, связывающую растворимость и рН, выведенную в пункте 4, получим:
s = {ПР *(1+[H+]/Kк)}1/2 = 5,38·10–5 моль/л. (3 балла)
6. По правилу Полинга HIO3 – одноосновная кислота с двуия концевыми атомами кислорода (HO)IO2 – сильная кислота. Оценочное значение pKa ≈ -3. Экспериментальное значение pKa = -lg(10-0,79) = 0,79. Это значение можно объяснить, предполагая, что в водном растворе происходит дополнительная гидратация кислоты (образование ортоформы):
HIO3 + H2O H3IO4
В этой форме кислота является трехосновной кислотой с одним концевым атомом кислорода (HO)3IO – кислотой средней силы pKa ≈ 2. Возможны процессы конденсации орто-формы: n H3IO4 (HIO3)n + n H2O.
И в этом случае каждый атом иода связан только с одним концевым атомом кислорода (остальные – мостиковые). Равновесие между такими формами может давать промежуточное
значение pKa (2 > pKa > –3). (3 балла)
