
- •Задача 1а
- •Задача 2а
- •Задача 3а
- •Задача 4а
- •Задача 5а
- •Задача 6а
- •Задача 7а
- •Задача 8а
- •Задача 1б
- •Задача 2б
- •Задача 3б
- •Задача 4б
- •Задача 5б
- •Задача 6б
- •Задача 7б
- •Задача 8б
- •Решения Задача 1а
- •Задача 1 б
- •Задача 2а (2б).
- •Задача 3а.
- •Задача 4а.
- •Задача 5а (она же 5б)
- •Задача 6а.
- •Задача 6б.
- •Задача 7а (она же 7б)
Задача 2а (2б).
Количество воды и СО2 равны: n(CO2) = n(H2O) = 11.325 л /22.4 л/моль = 9.11 г /18 г/моль = = 0.1011 моль. (2 балла)
Первое предположение – оксид металла:
Me2On + nH2 (nCO) = 2 Me + n H2O (nCO2).
Ar(Me) = 4.285 / (2 * 0.1011 / n) = 21.2n. Перебирая n, не находим приемлемых вариантов Me. (3 балла)
Рассмотрим другие варианты. Вещество может представлять собой гидроксид, карбонат или основной карбонат металла. Возможно только последнее, так как количества CO2 и H2O одинаковы. Общий вид реакций:
Mea(OH)2b(CO3)b + 2bH2 = aMe + 3bH2O + bCO2,
Mea(OH)2b(CO3)b +2bCO = aMe + 3bCO2 + bН2О,
Откуда получаем M(Me) = 4.285 / (0.1011a / 3b) = 127 (b/a). При b = 1 и а = 2 получаем М(Ме) = 63.5, Me – Cu, вещество - Cu(OH)2(CO3) – малахит. (10 баллов)
Cu(OH)2(CO3) + 2H2 = Cu + 3H2O + CO2, (5 баллов)
Mea(OH)2b(CO3)b +2bCO = aMe + 3bCO2 + bН2О, (5 баллов)
Аналогично решается задача 2б.
Задача 3а.
Приведём объём сероводорода к данной температуре с помощью уравнения Менделеева – Клапейрона: n = PV/RT = 101 325 Па * 0.258 *10-3 м3 / 8.31 Дж/моль*К/293 К = 0.011 моль. Концентрация сероводорода в насыщенном растворе тогда составит: [H2S] = 0.011 моль / 0.1 л = 0.11 моль/л.
(5 баллов, расчёт [H2S] без приведения к заданной температуре – 1 балл)
Запишем равновесие между осадком и раствором:
FeS(т) Fe2+ + S2-; ПР = [Fe2+] [S2-]. Условие выпадения осадка: C(Fe2+) * C(S2-) = ПР.
Отсюда [S2-] = ПР/[Fe2+] (1). (2.5 баллов)
Концентрация сульфид – ионов определяется протолизом сероводорода:
H2S + H2O HS- + H3O+; Kк1 = [HS-] [H3O+] / [H2S] (2) (2.5 баллов) и
HS- + H2O S2- + H3O+; Kк2 = [HS-] [H3O+] / [H2S] (3) (2.5 баллов).
Решая систему уравнений (2) и (3) относительно [S2-] , получаем
[S2-] = Kк1 * Kк2 * [H2S] / [H3O+]2 или [S2-] = Kк1 * Kк2 * [H2S] / 10-2pH (4). (2.5 баллов)
Приравнивая (1) и (4), получаем
[H3O+] = (Kк1 * Kк2 * [H2S] * [Fe2+] / ПР)1/2 (5)
и pH = -1/2 lg (Kк1 * Kк2 * [H2S] * [Fe2+] / ПР) ~ 2.5
(5 баллов)
За предложенный графический способ решения – дополнительно 5 баллов.
Аналогично решается задача 3б относительно [Co2+].
Задача 4а.
Из описания опыта (цвет газов и жидкостей) следует, что речь идёт о разложении какого-либо нитрата металла. Так как выделяется смесь газов (один из которых NO2), возможны два варианта:
1. M(NO3)x = M + xNO2 + 2xO2.
Молярная масса нитрата равна Mr(нитр) = (Ar(M) + 52*x)
Из уравнения реакции имеем
Ar(M) * 18.75 = 7.95 * (Ar(M) + 52*x).
Отсюда 10.8* Ar(M) = 492,9x и Ar(M) = 45.6х. Перебор целочисленных значений х подходящих вариантов не даёт.
2. M(NO3)x = MOx/2 + xNO2 + (x – y)O2.
Молярная масса нитрата равна Mr(нитр) = (Ar(M) + 62*x), оксида – Mr(MOy) = Ar(M) + 8x.
Из уравнения реакции имеем (Ar(M) + 8x) * 18.75 = 7.95 * (Ar(M) + 62*x).
Отсюда 10.8* Ar(M) = 263.4x и Ar(M) = 31.75х. При x = 2 получаем Ar(M) = 63.5 – Cu.
(9 баллов)
Таким образом, вещество А – Cu(NO3)2 (нитрат меди (II)). (0.5+0.5 = 1 балл)
Следовательно, протекают следующие реакции:
2Cu(NO3)2 = 2CuO + 4NO2 + O2, (1 балл)
2NO2 N2O4(ж), (1 балл)
2N2O4(ж) + H2O = N2O3(ж) + 2HNO3, (1 балл)
3N2O3(ж) + H2O = 2HNO3 + 4NO. (1 балл)
Б – NO2 (диоксид азота или оксид азота (IV)), (0.5+0.5 = 1 балл)
В - O2 (дикислород), (0.5+0.5 = 1 балл)
Г - N2O4 (тетраоксид диазота), (0.5+0.5 = 1 балл)
Д - N2O3 (триоксид диазота или оксид азота (III)), (0.5+0.5 = 1 балл)
Е - HNO3 (азотная кислота), (0.5+0.5 = 1 балл)
Ж – NO (монооксид азота или оксид азота(I)) (0.5+0.5 = 1 балл)
З – CuO (оксид меди(II)). (0.5+0.5 = 1 балл)
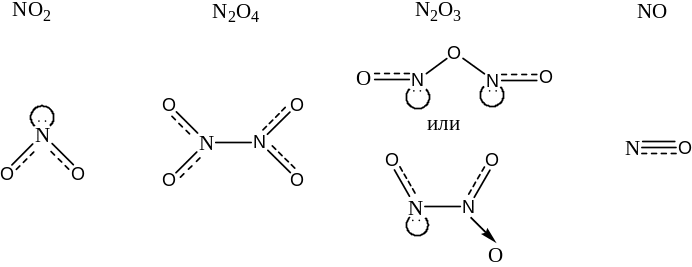
Строение молекул (4х1 = 4 балла)
Расчёт рН.
Суммируя все уравнения реакций, получаем, что из 1 моль нитрата по двум последним реакциям образуется 1 + 1/3 = 1.33 моль азотной кислоты. Тогда из 18.75 г нитрата образуется n(HNO3) = 18.75 г / 187.5г/моль * 1.33 = 0.133 моль. Концентрация кислоты в растворе, следовательно, равна С = 0.133 моль / 0.1 л = 1.33 моль/л. Так как азотная кислота – сильная, pH = -lg (C(HNO3)) = -0.12. (5 баллов)
Аналогично задача 4б, но там разлагается нитрат серебра (I) и вещество З – Ag. Соотношение нитрата к HNO3 – 1:7/12. n(HNO3) = 0.58*17/170 = 0.058 моль. С(HNO3) = 0.058 моль / 0.2 л = 0.29 моль/л. pH = 0.54.
