
- •Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
- •Следствия из закона Гесса
- •Межмолекулярные окислительно-восстановительные реакции
- •Уравнение в. Нернста
- •Таким образом, электрохимическая коррозия сводится к трём основным стадиям:
- •Различают следующие основные методы нанесения металлических защитных покрытий:
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами.
+4 -1 +2 0
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2Cl- - 2ē → Cl20 (восстановитель окисляется)
Mn+4 + 2ē → Mn+2 (окислитель восстанавливается)
Внутримолекулярные – реакции, в которых атомы окислителя и восстановителя, входят в состав молекулы одного и того же исходного вещества и являются атомами различных элементов или одного элемента, но с различной степенью окисления.
+5 -2 -1 0
2KClO3 = 2KCl + 3O2
Cl+5 + 6ē → Cl- │х 2 (окислитель восстанавливается)
2O-2 - 4ē → O20 │х 3 (восстановитель окисляется)
Самоокисления-самовосстановления (диспропорционирования) – реакции, в которых атомы окислителя и восстановителя входят в состав одного и того же исходного вещества, являются атомами одного и того же элемента и имеют одинаковую степень окисления.
+4 +6 -2
4K2SO3 = 3K2SO4 + K2S
S+4 -2ē → S+6 │x 3 (восстановитель окисляется)
S+4 + 6ē → S-2 │x 1 (окислитель восстанавливается)
19
Процесс окисления – процесс отдачи электронов
Процесс восстановления – процесс принятия электронов
Окислитель – принимает электроны, восстанавливается и понижает степень окисления
Восстановитель – отдаёт электроны, окисляется и повышает степень окисления
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
ОКИСЛИТЕЛЬ - вещество, способное отнимать электроны у другого вещества (восстановителя).
ВОССТАНОВИТЕЛЬ - вещество, способное отдавать электроны другому веществу (окислителю).
20
При погружении в раствор электролита или воды активного металла его поверхностные ионы, находящиеся в узлах кристаллической решетки, вступают в различные взаимодействия с компонентами электролита. В результате на границе металл – раствор возникает разность потенциалов, называемая электродным потенциалом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Электродные
потенциалы зависят от природы веществ,
участвующих в электродном процессе,
от соотношения между активностями этих
веществ и температуры. Для разбавленных
растворов, эта зависимость выражается
уравнением Нернста в следующей форме: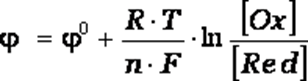
где![]() стандартный
электродный потенциал данного процесса,
стандартный
электродный потенциал данного процесса,
R = 8,31 Дж/(мольК) - универсальная газовая постоянная,
T - абсолютная температура раствора,
n - число молей электронов передаваемых в процессе,
F = 96500 Кл/моль - постоянная Фарадея.
21
Ряд напряжений (реже — ряд активностей), последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод.
В Ряд напряжений часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые металлы расположены в Ряд напряжений в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Важнейшие следствия, вытекающие из Ряд напряжений и широко используемые в химической практике: 1) каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие в Ряд напряжений правее данного металла; 2) все металлы, расположенные в Ряд напряжений левее водорода, способны вытеснять его из кислот; 3) чем дальше расположены друг от друга два металла в Ряд напряжений, тем большее напряжение может давать построенный из них гальванический элемент. Ряд напряжений составляется на основе термодинамических характеристик электрохимических процессов, поэтому он позволяет судить лишь о принципиальной возможности этих процессов; реальное же их осуществление во многом определяется кинетическими факторами.
22
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ – источник электрического тока, в котором вследствие электрохимической реакции выделяется электрическая энергия. Состоит из отрицательных (чаще из цинка) и положительных (из меди, угля или окиси металла) электродов, погруженных в жидкий или пастообразный раствор электролита.
Между электродом и электролитом всегда возникает некоторая разность потенциалов, зависящая от электрода и состава электролита. Появление электродного потенциала объясняется тем, что вещество электрода под воздействием химической энергии растворяется в электролите и положительные ионы переходят в электролит.
Элемент Вольта состоит из погруженного в водный раствор отрицательного заряда – катода и положительного – анода.
В электрохимии процессы окисления носят название анодных процессов, а электрод, на котором протекает окисление называется анод; соответственно, процессы восстановления называются катодными процессами, а электрод, на котором проходит восстановление носит название катод.
Электродным потенциалом называется величина, равная ЭДС гальванического элемента, составленного из данного электрода и стандартного водородного электрода.
ЭДС электрохимического элемента равна разности электродных потенциалов: Е = φ1 - φ2
Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.
23
Электродвижущая сила гальванического элемента - это максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции данного элемента. Единицей измерения ЭДС служит вольт.
ЭДС элемента вычисляется вычитанием из потенциала катода потенциала анода.
