
- •Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
- •Следствия из закона Гесса
- •Межмолекулярные окислительно-восстановительные реакции
- •Уравнение в. Нернста
- •Таким образом, электрохимическая коррозия сводится к трём основным стадиям:
- •Различают следующие основные методы нанесения металлических защитных покрытий:
1
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовых числа определяют уникальное состояние электрона в атоме (его волновую функцию). Главное квантовое число обозначается как n. При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона. Главное квантовое число равно номеру периода элемента.
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики.
Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, Т.о., энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и l.
2
Магнитное квантовое число - ml - определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от -l до +l, включая 0. Это означает, что для каждой формы орбитали существует 2l+1 энергетически равноценных ориентаций в пространстве - орбиталей.
Для s-орбитали: l=0, m=0 - одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали: l=1, m=-1,0,+1 - три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали: l=2, m=-2,-1,0,1,2 - пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали: l=3, m=-3,-2,-1,0,1,2,3 - семь равноценных ориентаций в пространстве (семь орбиталей).
Спиновое квантовое число - ms. Спиновое квантовое число - ms - определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона - спинам. Для обозначения электронов с различными спинами используются символы: 5 и 6.
3
s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μl = 0.
p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
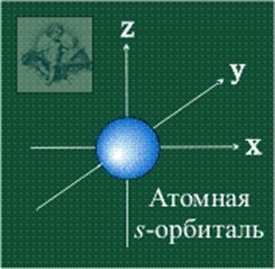 СФЕРИЧЕСКАЯ
ФОРМА s-орбитали
СФЕРИЧЕСКАЯ
ФОРМА s-орбитали
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
 РАСПОЛОЖЕНИЕ В
ПРОСТРАНСТВЕ р-орбиталей
РАСПОЛОЖЕНИЕ В
ПРОСТРАНСТВЕ р-орбиталей
4
Принцип Паули означает, что на орбитали может находиться не более двух электронов. На s-подуровне (1 орбиталь) может находиться 2 электрона, на p-подуровне (3 орбитали) – 6 электронов, на d-подуровне (5 орбиталей) – 10 электронов, на f-подуровне (7 орбиталей) – 14 электронов. Максимальное число электронов на энергетическом уровне составляет 2n2, где n – главное квантовое число.
Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d104p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией.
Правило Гунда: Электроны заполняют орбитали вначале в виде холостых с одинаковыми спинами, а затем в виде спаренных.
Рассмотрим заполнение трех орбиталей р-подуровня. Орбиталь принято обозначать графически в виде квадратиков или прямоугольников, называемых квантовыми ячейками, а электроны обозначают стрелками, направление которых связывают со спином. Первые три электрона заполнят три р-орбитали по-одному (холостые электроны) и с одинаковыми спинами (параллельные электроны) (рис.4.2,а). Последующие электроны будут заполнять эти же орбитали, но будут иметь противоположные спины (рис.4.2, б-г). Два электрона с противоположными спинами, занимающие одну орбиталь, называют спаренными, антипараллельными электронами. Неполностью заполненный подуровень или уровень называют ненасыщенным, а полностью заполненный – насыщенным.
5
Правило 2. Максимальное число электронов на подуровне:
s – 2; p – 6; d – 10; f – 14.
6
Строение электронной оболочки атома любого элемента можно представить в виде так называемых электронных формул , в которых буквами , , , обозначаются энергетические подуровни, цифры впереди букв обозначают уровни, а индекс вверху справа - число электронов на данном подуровне.
Чтобы составить электронную формулу любого элемента, надо знать следующее :
1,Порядковый номер элемента и соответствующее ему число электронов в атоме .
2,Номер периода, соответствующий числу энергетических уровней атома
3,Квантовые числа и связь между ними.
Так, атом водорода с порядковым номером 1 имеет 1 электрон. Водород - элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровне -орбиталь, имеющую наименьшую энергию.
Электронная формула атома водорода будет иметь вид: . Графически электронную структуру атомов можно выразить так называемыми электронно-графическими формулами с помощью квантовых ячеек, условно изображая электрон с - стрелкой, направленной вверх , а с - вниз .
7-9
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.При ответе на данный вопрос следует подробно остановиться на характеристике ковалентной и ионной связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода — частичный положительный . Таким образом, молекула становится полярной:
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалент-ная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалент-ная полярная. В случае, если электроны, участвую щие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
10
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи.
1. Прямое перекрывание:
В этом случае единственная область перекрывания электронных облаков лежит на прямой, соединяющей ядра атомов. Связь, образованная таким образом, называется -связью.
В зависимости от вида перекрывающихся облаков может образоваться s-s, s-p, p-p и другие разновидности -связи.
2. Боковое перекрывание:
В этом случае две области перекрывания электронных облаков находятся по разные стороны от плоскости, в которой лежат ядра связываемых атомов. Связь, образованная при таком перекрывании ЭО, называется - связью.
Как и в случае -связи, в зависимости от вида перекрывающихся облаков могут образоваться различные разновидности -связи: p-p, p-d, d-d и т. п.
И -, и -связь имеют определенное направление, которое возникает из-за стремления атомов к максимально эффективному перекрыванию ЭО, то есть к перекрыванию облаков в области максимальной электронной плотности. Таким образом, ковалентная связь обладает направленностью.
11
Гибридизация атомных орбиталей, квантовохимический способ описания перестройки орбиталей атома в молекуле по сравнению со свободным атомом. Являясь формальным математическим приемом, гибридизация атомных орбиталей позволяет отразить нарушение сферической симметрии распределения электронной плотности атома при образовании химической связи.
Сущность гибридизации атомных орбиталей состоит в том, что электрон молекулы вблизи выделенногибридная орбиталь атомногибридная орбиталь ядра характеризуется не отдельной атомной орбиталью, а линейной комбинацией атомных орбиталей с различным значениями азимутальногибридная орбиталь и магнитногибридная орбиталь квантовых чисел. Такая линейная комбинация называется гибридной (гибридизированной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии занятые атомные орбитали свободногибридная орбиталь атома. Например, для атомов элементов второгибридная орбиталь периода периодической системы типичная форма гибридной орбитали - линейная комбинация 2s-орбитали и 2р-орбиталей , , с численными коэффициентами.
СТРОЕНИЕ МОЛЕКУЛ (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений.
В классической теории химического строения молекула рассматривается как наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
12
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
В основе термохимических расчетов лежит закон, открытый русским ученым Г. И. Гессом в 1840 г. Закон гласит: тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода (из начального состояния в конечное).
Или иначе: тепловое эффект реакции равен алгебраической сумме тепловых эффектов всех его промежуточных стадий:
ΔН = ΔН1 + ΔН2.
Закон Гесса утверждает: тепловой эффект реакции не зависит от промежуточных стадий, а определяется лишь начальными и конечными состояниями веществ, если единственной работой является работа расширения, и объем (или давление) в ходе реакции остается неизменным. Таким образом, если возможно проведение реакций несколькими способами, то при совпадении состояний реагентов и продуктов реакции тепловой эффект ее должен быть одним и тем же.
