
1.
Химия изучает состав, свойства и превращения веществ, а также явления, которые сопровождают эти превращения.Одно из первых определений химии как науки дал русский ученый М.В. Ломоносов: «Химическая наука рассматривает свойства и изменения тел... состав тел... объясняет причину того, чтос веществами при химических превращениях происходит»
Материя - в химии представляется в виде атомов, атомных ядер и электронов, обладающих свойством образования между собой химических связей при соединении в молекулы.
Вещество – это вид материи, имеющий массу покоя. Весь окружающий нас материальный мир состоит, во-первых, из веществ и, во-вторых, из различных полей (например, существуют поля тяготения, электромагнитные поля и др.). Вещества могут быть газообразными, жидкими или твердыми, чистыми и содержащими примеси, растворимыми в воде и практически нерастворимыми, ядовитыми и неядовитыми, устойчивыми при хранении и быстро разлагающимися уже при комнатной температуре.
2 1. Все вещества состоят из атомов.
2. Атомы каждого вида одинаковы между собой, но
отличаются от атомов любого другого вида.
3. При взаимодействии атомов образуются молекулы: гомоядерные или гетероядерные.
4 При физических явлениях молекулы сохраняются; прихимических – разрушаются; при химических реакциях атомы в отличии от молекул
сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Закон сохранения массы. Закон эквивалентов. Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам
Закон сохранения энергии — основной закон природы, заключающийся в том, что энергия замкнутой системы сохраняется во времени. Другими словами, энергия не может возникнуть из ничего и не может в никуда исчезнуть, она может только переходить из одной формы в другую.
Закон Авогадро (1811г.) Равные объемы газов при одинаковых температурах и давлении содержат одинаковое число молекул в одном моле вещества: 6,21023
Следствие: моль любого газа при одинаковых условиях занимает один и тот же объем 22,4 л.
Валентность— способность атомов химических элементов образовывать химические связи с атомами других элементов. В свете строения атома валентность - это способность атомов отдавать или присоединять определенное число электронов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединенных или отданных электронов.
Уравнение Клапейрона-Менделева:
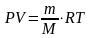
Нормальные условия: давление (Р) = 101,3кПа
объем (V) = 22,4 л
температура (Т) = 273К
Универсальная газовая постоянная R = 8,31 Дж/моль К - работа расширения идеального газа при нагревании его на один градус.
3. Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
4.
1 Пастулат
Электрон в атоме,
не теряя энергии, двигается по определённым
дискретным круговым орбитам для
которых момент
импульса квантуется: ![]() ,
где n — натуральные
числа,
а
,
где n — натуральные
числа,
а ![]() — постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.
— постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.
2 пастулат При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии hν = En − Em, где En;Em — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается
5. Квантовые числа. n – главное квантовое число характеризует количество энргии и размеры
l (L маленькое) – орбитальное квантовое число принимает значение в зависимости от n
ml – магнитная кв. число зависит от l характеризует орбиталь в пространстве.
ms – спиновое квантовое число (спин) характеризует состояние электрона
6. Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f5d < 6p < 7s < 5f6d...
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms).
Согласно правилу Хунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
7. Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
8. Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной.
Химическая связь, осуществляемая за счет электростатического притяжения между ионами, называется ионной связью.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
Водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов(О,F,N). Водородная связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Водородная связь может быть межмолекулярной и внутримолекулярной.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
9. Виды гибридизации
sp-гибридизация
sp2-гибридизация
sp3-гибридизация
dsp2-гибридизация
sp3d-гибридизация
sp3d2 (d2sp3) –гибридизация
12. Если двухатомная молекула состоит из атомов одного элемента, то электронное облако распределяется в пространстве симметрично относительно ядер атомов. Такая ковалентная связь называется неполярной. Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной.
Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной.
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью. Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов (Δχ > 2 ), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
14. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
При неизменных условиях химическое равновесие может сохраняться как угодно долго. Изменяя условия, можно нарушить равновесие. Сдвиг равновесия обратимой реакции может быть вызван изменением концентрации одного из веществ, участвующих в реакции, изменением температуры и давления.
15. Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами
16. При прохождении в изолированной системе самопроизвольных процессов энтропия системы возрастает. Или Энтропия изолированной системы стремится к максимуму так как самопроизвольные процессы передачи тепла всегда будут происходить, пока есть перепады температур.
17. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
G=U+PV-TS
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия.
18. Внутренняя энергия
Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами: U=Q-W
Энтальпия
Определяется следующим образом:
H=U+PV
где P — давление, а V — объем.
Поскольку в изобарном процессе работа равна , приращение энтальпии в квазистатическом изобарном процессе равно количеству теплоты, полученному системой.
Термодинамическая энтропия — термодинамическая функция, характеризующая меры неупорядоченности системы, то есть неоднородности расположения движения её частиц термодинамической системы.

где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
22. Полимеры (от греч. polymeres - состоящий из многих частей, многообразный), химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерных звеньев). Атомы, входящие в состав макромолекул, соединены друг с другом силами главных и (или) координационных валентностей.
Полимеризация — это процесс соединения друг с другом большого числа молекул мономера за счет кратных связей (С = С, С = О и др.) или раскрытия циклов, содержащих гетероатомы (О, N, S). При полимеризации обычно не происходит образования низкомолекулярных побочных продуктов, вследствие чего полимер и мономер имеют один и тот же элементный состав,
Поликонденсация — это процесс соединения друг с другом молекул одного или нескольких мономеров, содержащих две и да более функциональные группы (ОН, СО, СОС, NHS и др.) способные к химическому взаимодействию, при котором происходит отщепление низкомолекулярных продуктов. Полимеры, получаемые поликонденсационным способом, по элементному составу не соответствуют исходным мономерам. Сегодня можно говорить по меньшей мере о четырех основных направлениях использования полимерных материалов в сельском хозяйстве. И в отечественной и в мировой практике первое место принадлежит пленкам. Благодаря применению мульчирующей перфорированной пленки на полях урожайность некоторых культур повышается до 30%, а сроки созревания ускоряются на 10-14 дней. Использование полиэтиленовой пленки для гидроизоляции создаваемых водохранилищ обеспечивает существенное снижение потерь запасаемой влаги. Укрытие пленкой сенажа, силоса, грубых кормов обеспечивает их лучшую сохранность даже в неблагоприятных погодных условиях. Но главная область использования пленочных полимерных материалов в сельском хозяйстве - строительство и эксплуатация пленочных теплиц. В настоящее время стало технически возможным выпускать полотнища пленки шириной до 16 м, а это позволяет строить пленочные теплицы шириной в основании до 7,5 и длиной до 200 м. В таких теплицах можно все сельскохозяйственные работы проводить механизированно; более того, эти теплицы позволяют выращивать продукцию круглогодично. В холодное время теплицы обогреваются опять-таки с помощью полимерных труб, заложенных в почву на глубину 60-70 см.
С точки зрения химической структуры полимеров, используемых в тепличных хозяйствах такого рода, можно отметить преимущественное использование полиэтилена, непластифицированного поливинилхлорида и в меньшей мере полиамидов. Полиэтиленовые пленки отличаются лучшей светопроницаемостью, лучшими прочностными свойствами, но худшей погодоустойчивостью и сравнительно высокими теплопотерями. Они могут исправно служить лишь 1-2 сезона. Полиамидные и другие пленки пока применяются сравнительно редко.
Другая область широкого применения полимерных материалов в сельском хозяйстве - мелиорация. Тут и разнообразные формы труб и шлангов для полива, особенно для самого прогрессивного в настоящее время капельного орошения; тут и перфорированные пластмассовые трубы для дренажа. Интересно отметить, что срок службы пластмассовых труб в системах дренажа, напри мер, в республиках Прибалтики в 3-4 раза дольше, чем соответствующих керамических труб. Вдобавок использование пластмассовых труб, особенно из гофрированного поливинилхлорида, позволяет почти полностью исключить ручной труд при прокладке дренажных систем.
Два остальных главных направления использования полимерных материалов в сельском хозяйстве - строительство, особенно животноводческих помещений, и машиностроение.
23. Растворы однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными.
Способы выражения консентрации:
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M".
Нормальность - число грамм-эквивалентов растворённого вещества, содержащееся в 1 литре раствора.
Весовой процент - число граммов растворённого вещества, содержащееся в 100g раствора.
Первый закон Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
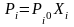
Второй
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
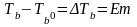
24. О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворенного вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
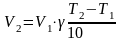
где — скорость реакции при температуре , — скорость реакции при температуре , — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах.
Из
уравнения Вант-Гоффа температурный
коэффициент вычисляется по формуле:
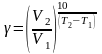
25. Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации.
Сильные и слабые электролиты сильные-полностью диссоциируют на ионы.слабые частично.Для концентрации 0.1 моль/л сильными называются электролиты со степенью диссоциации белее 30%,слабые-менее 3%.примеры сильных электролитов-практически все соли,серная кислота,соляная кислота,азотная.Слабые-угольная,фтороводородная,синильная,сероводородная.слабыми я вляются Летучие,неустойчивые кислоты
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации
