
Примерный перечень вопросов к коллоквиуму-2
Физические основы молекулярно-кинетической теории. Газовые законы. Идеальный газ. Термодинамические параметры. Уравнение состояния идеального газа ?
Основные положения молекулярно-кинетической теории:
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
ГАЗОВЫЕ ЗАКОНЫ.
Абсолютная температура.
Если предположить, что закон теплового расширения справедлив и для низких температур (чего нельзя принять без ограничений), можно получить чисто вычислительным путём: при t = - 273ºС объем газа обратится в нуль. Абсолютный нуль лежит при - 273ºС.Абсолютная температура (шкала Кельвина) => Тº = 273 + tºС.
Закон Гей – Люссака.
Из закона расширения следует: при постоянном давлении объемы газов относятся, как абсолютные температуры:
V1 : V2 = T1 : T2, Закон Гей – Люссака.
Закон Бойля - Мариотта.
Закон устанавливает зависимость объема газа от давления при неизменной температуре. Получается:
-
p1V1 / Т1 = p2V2 / Т2 – уравнение состояния идеального газа.
Изменение удельного веса и плотности с температурой.
Из того, что объем изменяется при нагревании, следует, что удельный вес и плотность также зависят от температуры. В таблицах обе величины обычно приводятся к 0ºС и давлению 760 мм рт. ст.
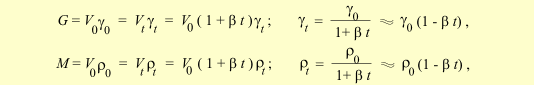
Приведение массы к нормальным условиям.
![]()
Вес газа:
![]()
ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
Молекулы находятся в непрекращающемся хаотическом движении.
Уравнение состояния идеального газа (уравнение Клайперона-Менделеева):
О
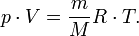 сновное
уравнение молекулярно-кинетической
теории ?
сновное
уравнение молекулярно-кинетической
теории ?
Основное
уравнение молекулярно-кинетической
теории идеальных газов :
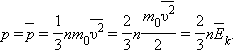
Закон распределения молекул по скоростям и энергиям. Наиболее вероятная скорость. Средняя арифметическая скорость ?
Если газ находится в равновесии, молекулы движутся хаотически, и все направления их движения равновероятны. Скорости молекул могут быть самыми различными по модулю и при каждом соударении с другими молекулами изменяются случайным образом.
Cредняя кинетическая энергия молекулы идеального газа:
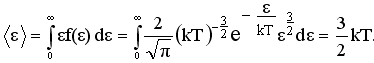
Средняя квадратичная скорость молекул
:
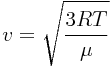
Наиболее вероятная скорость молекул :
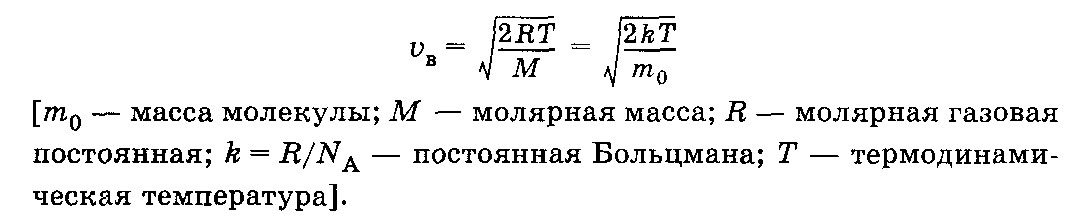
Среднее число столкновений и средняя длина свободного пробега молекул ?
Молекулы газа, находясь в хаотическом движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь , называемым длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с очень большим числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул.
Идеальный газ в поле силы тяжести. Изменение концентрации частиц с высотой. Барометрическая формула?
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
При выводе основного уравнения
молекулярно-кинетической теории газов
и максвелловского распределения молекул
по скоростям делалось предположение,
что внешние силы не действуют на молекулы
газа, поэтому молекулы равномерно
распределены по объему. Но молекулы
любого газа находятся в потенциальном
поле тяготения Земли. Сила тяжести, с
одной стороны, и тепловое движение
молекул — с другой, приводят газ к
некоторому стационарному состоянию,
при котором давление газа с высотой
уменьшается. Выведем Барометрическую
формулу :
![]()
![]() (1)
Выражение
(1) называется барометрической
формулой. Она позволяет вычислить
атмосферное давление в зависимости от
высоты или, измеряя давление, найти
высоту: Так как высоты считаются
относительно уровня моря, где давление
считается нормальным, то выражение (1)
может быть представлено в виде
(1)
Выражение
(1) называется барометрической
формулой. Она позволяет вычислить
атмосферное давление в зависимости от
высоты или, измеряя давление, найти
высоту: Так как высоты считаются
относительно уровня моря, где давление
считается нормальным, то выражение (1)
может быть представлено в виде
![]() (2)
где
р — давление на высоте h.
Барометрическую
формулу (2) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 – то же, на высоте h=0. Так как
M=m0NA (NA – постоянная Авогадро, m0 –
масса одной молекулы)
(2)
где
р — давление на высоте h.
Барометрическую
формулу (2) можно преобразовать, если
воспользоваться формулой p=nkT:
где
n – концентрация молекул на высоте h,
n0 – то же, на высоте h=0. Так как
M=m0NA (NA – постоянная Авогадро, m0 –
масса одной молекулы)
Явления переноса. Диффузия. Вязкость. Теплопроводность ?
В термодинамических неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса).
Теплопроводность. Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, т. е., иными словами, выравнивание температур.
Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия сводится к обмену масс частиц этих тел, возникает и продолжается, пока существует градиент плотности.
Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Теплота и работа. Внутренняя энергия идеального газа ?
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Отсюда вытекает закон Джоуля, подтверждаемый многочисленными экспериментами.
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема |
![]() ,
выражающей внутреннюю энергию идеального
газа через его температуру Т и количество
молей газа. Иначе формулу можно представить
в виде:
,
выражающей внутреннюю энергию идеального
газа через его температуру Т и количество
молей газа. Иначе формулу можно представить
в виде: ![]() .
.
Два способа изменения внутренней энергии — теплопередача и совершение механической работы. Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. При механическом взаимодействии тел мерой энергии, переданной от одного тела к другому, является работа А.
При осуществлении теплопередачи от одного тела к другому мерой переданной энергии является количество теплоты Q.
Работу можно преобразовать в тепловую энергию, а тепловую энергию можно преобразовать в работу, хотя эти процессы никогда не эффективны на 100%. Работу можно использовать для увеличения тепловой энергии. Аналогично, тепловую энергию можно использовать для выполнения работы. Следовательно, теплота и работа взаимозаменяемы.
Первое начало термодинамики. Применение его для различных процессов ?
Первое начало термодинамики : Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как δQ = δA + dU, где dU есть полный дифференциал внутренней энергии системы, а δQ и δA есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что δA и δQ нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось.
Первое начало термодинамики утверждает, что изменение внутренней энергии термодинамической системы (тела) может быть осуществлено двумя путями: путём совершения механической работы и путём теплопередачи.
Применение первого начала к различным тепловым процессам :
