
- •Т. И. Макрушина, а. Л. Верещагин,
- •Растворы
- •071900, 171200, 17150, 230100, Изучающих
- •Введение
- •1 Теоретическая часть
- •Классификация растворов
- •1.2 Общие свойства растворов
- •1.3 Химическое равновесие в растворах
- •1.3.4 Механизм электролитической диссоциации ионных веществ.
- •1.3.5 Механизм электролитической диссоциации полярных веществ
- •1.4 Термодинамика процессов растворения
- •1.5 Теория кислот и оснований
- •Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
- •1.6 Слабые электролиты
- •1.7 Растворы сильных электролитов
- •1.8 Неэлектролиты
- •1.9 Способы выражения концентрации растворов
- •1.10 Методы расчёта заданных концентраций
- •2 Экспериментальная часть
- •2.1 Цель работы
- •2 .2 Мерная химическая посуда
- •Методика проведения работы
- •2.4 Определение концентраций заданных растворов
- •3 Техника безопасности
- •4 Контрольные вопросы на допуск к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •Основные термины и определения
- •Подготовка к защите лабораторной работы
- •Приложение б Тесты по теме «Растворы»
- •Приложение в
- •В.2 Пример компьютерного отчета
- •Приложение г Основные термины и определения
- •Содержание
- •Введение 4
1.8 Неэлектролиты
Неэлектролиты – это вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
1.9 Способы выражения концентрации растворов
Для характеристики состава раствора используются следующие способы выражения концентрации.
1). Массовая доля () – это доля, которую составляет масса растворённого вещества (mв) от массы раствора (mр-ра):
![]() (1.20)
(1.20)
где mв – масса вещества, кг.
mр-ра – масса раствора, кг.
2). Массовая доля в процентах (,%) – это выраженная в процентах доля, которую составляет масса растворённого вещества от массы раствора:
![]() . (1.21)
. (1.21)
3). Молярная концентрация (СМ) – характеризует количество растворённого вещества (nв) в 1 литре раствора:
![]() (моль/л), (1.22)
(моль/л), (1.22)
так
как
![]() то
то
![]() , (1.23)
, (1.23)
где V – объём раствора, л;
МВ – молярная масса вещества, кг/моль.
Размерность моль/л сокращённо обозначается большой буквой М.
4). Нормальная концентрация (![]() )
– характеризует количество вещества
эквивалента (nэ),
содержащегося в 1 литре раствора:
)
– характеризует количество вещества
эквивалента (nэ),
содержащегося в 1 литре раствора:
![]() (моль/л), (1.24)
(моль/л), (1.24)
так как
![]() то
то
![]() ,
(1.25)
,
(1.25)
где fэ – фактор эквивалентности.
Размерность (моль-экв/л) сокращенно обозначается буквой Н.
Растворы с концентрацией 0,1 М, 0,1 Н, 0,01 М, 0,01 Н имеют следующие названия: децимолярный и децинормальный растворы, сантимолярный и сантинормальный растворы, соответственно.
5). Моляльная концентрация (Сm) – характеризует количество растворного вещества (nB), содержащегося в 1000 г растворителя (mр-ля):
![]() (моль/1000
г) , (1.26)
(моль/1000
г) , (1.26)
или
![]() (моль/1000г).
(1.27)
(моль/1000г).
(1.27)
6). Титр (Т) – характеризует массу вещества, содержащуюся в 1мл раствора:
![]() (г/мл). (1.28)
(г/мл). (1.28)
7). Мольная доля (х) – характеризует долю, которая составляет количество растворённого вещества от суммы количества веществ всех компонентов раствора. Мольная доля – величина безразмерная.
![]() ,
(1.29)
,
(1.29)
где nB – количество молей растворенного вещества;
nр-ля – количество молей растворителя.
1.10 Методы расчёта заданных концентраций
В лабораторной практике расчётные задачи, связанные с приготовлением растворов можно условно разделить на несколько типов:
расчёты при использовании сухих солей;
расчёты, связанные с разбавлением или смешиванием растворов;
пересчёты из одной концентрации в другую.
Иногда при решении задач требуется знать плотность раствора (), т.е. отношение массы раствора (mр-ра) к его объёму(V).
![]() (г/мл) или (кг/м3)
(1.30)
(г/мл) или (кг/м3)
(1.30)
Эту величину находят из справочника (ПРИЛОЖЕНИЕ А).
1.10.1 Расчёты растворов, концентрация которых задана в массовых долях
Задача1. Приготовить 100 мл 10%-го хлорида кальция из безводной соли CaCl2.
Решение. Найдём из справочника плотность 10%-го раствора хлорида кальция: =1,083 г/мл.
Найдём массу 100 мл раствора:
mр-ра=V=1,083100=108,3 г
и найдём массу растворённого вещества (CaCl2):
100 г р-ра – 10 г (СaCl2),
108,3 – Х
![]() (г).
(г).
Найдём объём воды;
Так как плотность воды равна 1 г/мл, то масса воды и объём воды численно равны. Отсюда Vн2о= mр-ра- mв-ва:
Vн2о=108,3-10,83=97,47 (мл).
Задача 2. Приготовить 100 мл 10%-го раствора хлорида кальция из кристаллогидрата CaCl22Н2О.
Решение. Найдём массу растворённого вещества, содержащегося в 100 мл 10%-го раствора хлорида кальция. Она равна 10,83 г (см. задачу1).
Найдём массу кристаллогидрата CaCl22Н2О, содержащего 108,3 г раствора CaCl2:
CaCl2 CaCl2Н2О
111 – 147,
10,83 – Х
![]() (г),
(г),
где 111 г и 147 г – молярные массы CaCl2 и CaCl22Н2О, соответственно.
Следовательно, для приготовления раствора необходимо взять объём воды, равный: 108,3-14,34=93,96 (мл).
Задача 3.Приготовить 100 мл 6%-го раствора сульфата аммония из 20%-го (=1,226 г/см3) , 2%-го (=1,019 г/см3) и 6%-го (=1,061 г/см3)растворов Al2(SO4)3.
Решение 1. Для приготовления растворов заданной концентрации путём смешивания двух растворов разных концентраций или путём разведения более концентрированного раствора водой удобно пользоваться правилом креста:
г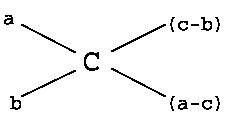 де
a и b – процентные
концентрации первого и второго растворов,
причём a > b;
де
a и b – процентные
концентрации первого и второго растворов,
причём a > b;
с – заданная процентная концентрация;
(c-b) – весовое количество первого раствора;
(a-c) – весовое количество второго раствора или чистого растворителя.
Н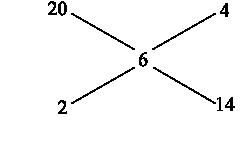 аходим
по правилу креста необходимое количество
каждого из растворов:
аходим
по правилу креста необходимое количество
каждого из растворов:
Следовательно, на 4 весовые части 20%-го раствора приходится 14 весовых частей 2%-го раствора, или в пересчёте на объём это составит:
20 %-го раствора Al2(SO4)3 – 4: 1,226=3,26 (мл),
2 %-го раствора Al2(SO4)3 – 14: 1,019=13,74 (мл),
общий объём раствора – 17 мл.
Для приготовления 100 мл 6 %-го раствора надо взять:
20 %-го раствора Al2(SO4)3:
![]() (мл),
(мл),
2 %-го раствора Al2(SO4)3:
![]() (мл).
(мл).
Решение 2.
Масса 100 мл 6 %-го раствора:
mр-ра=V=1,061100=106,1 г
Обозначим массу 20 %-го раствора Al2(SO4)3, необходимую для приготовления 100 мл 6 %-го раствора, как m1, тогда необходимая масса 2 %-го раствора будет равна 106,1 – m1. Составим уравнение материального баланса по растворенному веществу:
106,1 ∙ 0,06 = m1·∙ 0,2 + (106,1 - m1) .
Решая данное уравнение относительно m1, получим:
масса 20 %-го раствора Al2(SO4)3; m1 = 23,58 (г),
масса 2 %-го раствора Al2(SO4)3; (106,1 - m1) = 82,52 (г).
Пересчитаем на объемы:
объем 20 %-го раствора Al2(SO4)3: 23,58/1,226 = 19,2 (мл),
объем 2 %-го раствора Al2(SO4)3: 82,52/1,019 = 80,8 (мл).
