
- •Т. И. Макрушина, а. Л. Верещагин,
- •Растворы
- •071900, 171200, 17150, 230100, Изучающих
- •Введение
- •1 Теоретическая часть
- •Классификация растворов
- •1.2 Общие свойства растворов
- •1.3 Химическое равновесие в растворах
- •1.3.4 Механизм электролитической диссоциации ионных веществ.
- •1.3.5 Механизм электролитической диссоциации полярных веществ
- •1.4 Термодинамика процессов растворения
- •1.5 Теория кислот и оснований
- •Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
- •1.6 Слабые электролиты
- •1.7 Растворы сильных электролитов
- •1.8 Неэлектролиты
- •1.9 Способы выражения концентрации растворов
- •1.10 Методы расчёта заданных концентраций
- •2 Экспериментальная часть
- •2.1 Цель работы
- •2 .2 Мерная химическая посуда
- •Методика проведения работы
- •2.4 Определение концентраций заданных растворов
- •3 Техника безопасности
- •4 Контрольные вопросы на допуск к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •Основные термины и определения
- •Подготовка к защите лабораторной работы
- •Приложение б Тесты по теме «Растворы»
- •Приложение в
- •В.2 Пример компьютерного отчета
- •Приложение г Основные термины и определения
- •Содержание
- •Введение 4
Основные термины и определения
* Химическая связь |
* Энергия связи |
* Длина связи |
* Правило октета |
* Ионная связь |
* Ковалентная связь |
* Полярная ковалентная связь |
* Неполярная ковалентная связь |
* Связывающая орбиталь |
* Разрыхляющая орбиталь |
* Диполь |
* Электрический момент диполя |
* σ-связи |
* π-связи |
* π-связи |
* sp3-гибридизация |
* sp2- гибридизация |
* sp- гибридизация |
* Делокализованная связь |
* Порядок связи |
* Кратность связи |
* Металлическая связь |
* Водородная связь |
* Донорно-акцепторная связь |
* Ван-дер-ваальсовые силы |
* Дисперсионное взаимодействие |
* Индукционное взаимодействие |
* Ориентационное взаимодействие |
* Энергия ван-дер-ваальсово-го взаимодействия |
* Межмолекулярная водородная связь |
* Внутримолекулярные водородные связи |
* Межатомная водородная связь |
* Донорно-акцепторная связь |
* Комплексы |
* Комплексообразователь |
* Лиганды |
* Хелатные комплексы |
* Химические системы |
* Фаза |
* Компоненты |
* Дисперсные системы |
* Золи |
* Мицеллы |
* Студни |
* Гели |
* Концентрация |
* Мольная доля вещества |
* Объёмная доля вещества |
* Молярная концентрация вещества |
* Массовая доля вещества |
* Моляльная концентрация вещества |
* Нормальная концентрация |
* Идеальный газ |
* Плазма |
* Кластеры |
* Ассоциаты |
* Давление насыщенных паров |
* Температура кипения |
* Вязкость |
* Поверхностное натяжение |
*Жидкокристаллическое сотояние |
* Температура растворения |
* Стеклообразное состояние |
* Температура просветления |
* Температура плавления |
* Постоянные решётки |
* Координационное число |
* Энергия кристаллической решётки |
* Изоморфные вещества |
* Полиморфизм |
* Аллотропные модификации |
* Молекулярные кристаллы |
*Атомно-ковалентные кристаллы |
* Ионные кристаллы |
* Металлические кристаллы |
* Кристаллы со смешанными связями |
* Металлы |
* Полупроводники |
* Диэлектрики |
* Электронные аналоги |
Подготовка к защите лабораторной работы
Изучить материал занятия по литературе [1] и конспектам лекций.
Выучить значения основных терминов и определений.
Подготовиться к письменному опросу по терминам и определениям и решению задач по теме "Растворы".
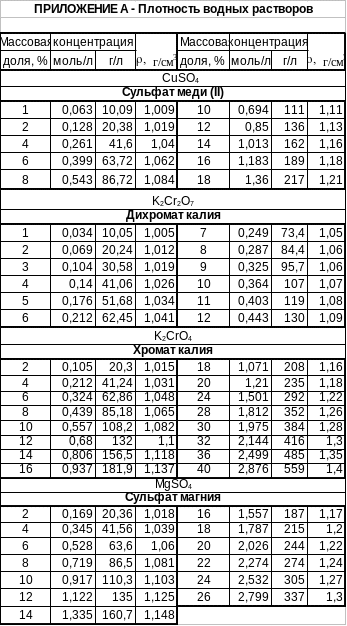
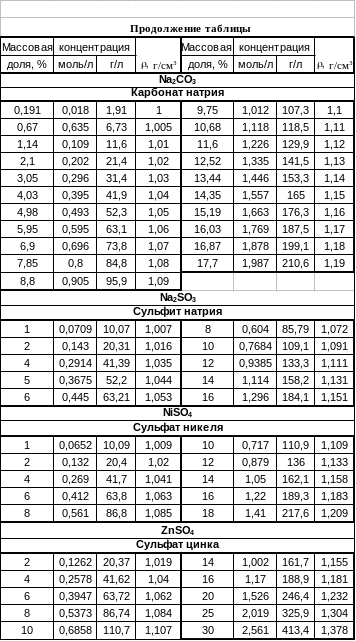
Приложение б Тесты по теме «Растворы»
1. Чтобы ослабить или прекратить гидролиз в растворе хлорида алюмииния необходимо:
а) добавить гидроксид натрия;
б) добавить серную кислоту;
в) добавить хлорид натрия;
г) добавить воду;
д) охладить раствор; е. нагреть раствор.
2. Какие факторы понижают степень диссоциации уксусной кислоты:
а) подщелачивание раствора; б. разбавление раствора водой;
в) подкисление раствора; г. повышение температуры;
д) понижение температуры; е. добавление ацетата натрия.
3. Какая соль гидролизуется в большей степени?
а) ацетат железа (II); б. нитрат железа (II);
в) нитрат железа (III); г. бромид железа (III);
д) хлорид железа (II); е. ацетат железа (III)?
4. Сокращенное ионное уравнение реакции Ba2+ + SO42- = BaSO4. соответствует взаимодействиям таких веществ:
а) гидроксида бария с серной кислотой;
б) гидроксида бария с оксидом серы (VI);
в) хлорида бария с сульфатом натрия;
г) оксида бария с сульфатом калия;
д) карбоната бария с серной кислотой;
е) нитрата бария с сульфитом калия;
ж) хлорида бария с гидросульфатом аммония.
5. При сливании растворов каких веществ происходит реакция, описываемая сокращенным ионным уравнением H+ + OH- = H2O:
а) гидроксида бария и серной кислоты;
б) гидроксида меди и азотной кислоты;
в) гидроксида магния и азотная кислота;
г) гидроксида натрия и уксусной кислоты;
д) гидроксида калия и бромистоводородной кислоты;
е) гидрокарбоната натрия и гидроксида натрия?
6. Нейтрализацию какой кислоты и основания изображает следующее сокращенное ионное уравнение M(OH)n + nH+ = Mn+ + nH2O:
а) слабой кислоты и слабого основания;
б) слабой кислоты и сильного основания;
в) слабой кислоты и сильного основания;
г) сильной кислоты и слабого основания?
7. С каким веществом реагирует нитрат меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
а) сероводородом; д) сульфидом натрия;
б) сульфатом натрия; е) сульфидом свинца;
в) гидросульфидом натрия; ж) гидросульфатом натрия.
г) сульфитом натрия;
8. Какое сокращенное ионное уравнение соответствует реакции водных растворов гидрокарбоната натрия и гидроксида натрия:
а) CO32- + 2H+ = H2O + CO2;
б) NaHCO3 + OH- = Na+ + CO32- + H2O;
в) HCO3- + OH- = CO32- + H2O;
г) H+ + OH- = H2O.
9. Гидролиз какой соли описывается уравнением S2- + H2O = HS- + OH-:
а) сульфида алюминия; г) сульфида натрия;
б) сульфида аммония; д) сульфита натрия;
в) гидросульфида натрия; е) гидросульфита натрия?
10. Гидролиз водных растворов каких солей ослабляется при добавлении минеральной кислоты:
а. NH4NO3; б. Na2SO3; . NaHCO3; . Sn(NO3)2; д. CrCl3;
е. CH3COONa.
11. Какие факторы благоприятствуют гидролизу как хлорида аммония, так и хлорида хрома (III):
а. подкисление раствора; б. подщелачивание раствора;
в. охлаждение раствора; г. добавление воды;
д. нагревание раствора.
12. При растворении NH4NO3 в воде температура системы понизилась на несколько градусов. Является ли этот процесс эндотермическим и экзотермическим? Какой знак имеет изменение энтальпии данного процесса?
а) экзотермический, ∆Н<0;
б) эндотермический, ∆Н>0;
в) эндотермический, ∆H<0.
Буферные растворы – это растворы
а) с постоянным рН раствора вне зависимости от разбавления или добавления больших количеств сильной кислоты или сильного основания;
б) с переменным рН раствора при разбавлении;
в) с сохраняющимся практически постоянным рН раствора при разбавлении или добавлении небольших количеств сильной кислоты или сильного основания;
г) нейтральной реакцией;
д) с щелочной реакцией.
Изотонический раствор – это
а) раствор с одинаковым осмотическим давлением;
б) с давлением выше внутриклеточного;
в) с давлением ниже внутриклеточного;
г) с давлением выше атмосферного;
д) с давлением ниже атмосферного.
15. Давление пара над раствором:
а) ниже, чем над чистым растворителем;
б) выше, чем над чистым растворителем;
в) равно давлению над чистым растворителем;
г) не зависит от природы растворённого вещества;
д) не зависит от природы растворителя.
16. По теории Бренстеда-Лоури кислота – это:
а) вещество, способное отдавать протон;
б) акцептор электронов;
в) электролит, диссоциирующий в растворах с образованием ионов Н+;
г) вещество, способное принимать протон;
д) вещество, способное отдавать электрон.
1![]() 7.
Математическая запись закона разбавления
Оствальда имеет вид:
7.
Математическая запись закона разбавления
Оствальда имеет вид:
а) k =α2c; б) k =β2c; в)
г) k = β 2c;
![]()
д)
