
- •Т. И. Макрушина, а. Л. Верещагин,
- •Растворы
- •071900, 171200, 17150, 230100, Изучающих
- •Введение
- •1 Теоретическая часть
- •Классификация растворов
- •1.2 Общие свойства растворов
- •1.3 Химическое равновесие в растворах
- •1.3.4 Механизм электролитической диссоциации ионных веществ.
- •1.3.5 Механизм электролитической диссоциации полярных веществ
- •1.4 Термодинамика процессов растворения
- •1.5 Теория кислот и оснований
- •Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
- •1.6 Слабые электролиты
- •1.7 Растворы сильных электролитов
- •1.8 Неэлектролиты
- •1.9 Способы выражения концентрации растворов
- •1.10 Методы расчёта заданных концентраций
- •2 Экспериментальная часть
- •2.1 Цель работы
- •2 .2 Мерная химическая посуда
- •Методика проведения работы
- •2.4 Определение концентраций заданных растворов
- •3 Техника безопасности
- •4 Контрольные вопросы на допуск к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •Основные термины и определения
- •Подготовка к защите лабораторной работы
- •Приложение б Тесты по теме «Растворы»
- •Приложение в
- •В.2 Пример компьютерного отчета
- •Приложение г Основные термины и определения
- •Содержание
- •Введение 4
Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации () зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n), к общему числу молекул, введенных в раствор (N).
= n / N , 0<<1 . (1.10)
Кислотой
называют электролит, диссоциирующий в
растворах с образованием ионов Н+;
основанием
называют электролит,
диссоциирующий в воде с образованием
гидроксид-ионов ОН![]() .
Амфолитом (амфотерным гидроксидом)
называют электролит, диссоциирующий в
воде с образованием как ионов Н+,
так и ионов ОН
:
.
Амфолитом (амфотерным гидроксидом)
называют электролит, диссоциирующий в
воде с образованием как ионов Н+,
так и ионов ОН
:
![]() .
.
Общепринятыми считаются протонная теория электролитической диссоциации Бренстеда-Лоури и электронная теория Льюиса. Протонная теория Бренстеда-Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
HAn =H++ An-.
По определению, HАn – кислота, An- - основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
NH3 + H+=NH4+
Любое кислотно-основное равновесие включает взаимодействие двух пар кислот и оснований.
сопряженная пара


Н+

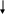
Кислота1 + Основание2 = Основание1 + Кислота2
Н+


сопряженная пара
В определённых условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому её называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары NF3(основание) и акцептора электронной пары BF3 (кислота) образуется более устойчивое электронное окружение (октет) за счёт донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
F F F F

F


 N: + B F
F N B F
N: + B F
F N B F
F F F F
основание кислота
В периоде сила кислородсодержащей кислоты растёт с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
H4SiO4<H3PO4<H2SO4<HClO4.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
HClO3 > HBrO3 > HIO3.
