
Хроматографія як метод аналізу.Газова хроматографія.Основи методу.
\Вступ. Антропогенне забруднення об’єктів довкілля різноманітними
неорганічними та органічними речовинами та низькі значення гранично-
допустимих концентрацій забруднювачів призвело до необхідності використання
для аналізу комбінованих методів, які дозволяють проводити концентрування,
розділення та визначення сумішей речовин. Таким методом є хроматографія в її
різних варіантах.
Сучасні автоматизовані прилади дозволяють за короткий час провести
розділення, якісний і кількісний аналіз багатокомпонентних рідких і газових
сумішей.
Курс “Хроматографія в аналізі об’єктів довкілля” має на меті ознайомити
студентів спеціалізації “хімічний контроль об’єктів довкілля” з окремими
положеннями теорії і практики хроматографічного аналізу, які безпосередньо
використовуються для розробки методик розділення, ідентифікації та кількісного
визначення близьких за властивостями речовин, та з практичними можливостями
різних варіантів хроматографічного методу при аналізі неорганічних та органічних
речовин.
Вступна частина. Принцип хроматографічного методу. Функції нерухомої та
рухомої фаз. Класифікація хроматографічних методів за такими параметрами:
агрегатний стан рухомої та нерухомої фаз, природа взаємодії між сорбентом та
сорбатом, техніка виконання аналізу.
Основні етапи проведення хроматографічного аналізу: отримання первинної та
промитої хроматограм, вилучення речовин з фази сорбенту (елюювання,
витіснення). Фронтальний аналіз.
Напрямки використання хроматографічних методів. Поняття про класичну та
високоефективну, аналітичну та препаративну хроматографію.
Основні положення теорії хроматографічного аналізу. Сили міжмолекулярної
взаємодії (Ванн-дер-Ваальса, водневий, донорно-акцепторний зв’язок). Поняття
про сорбцію (адсорбцію, абсорбцію, розподіл), сорбент (адсорбент), сорбат
(адсорбат), десорбцію. Фізичні і хімічні фактори, які впливають на величину
сорбції.
Ізотерма адсорбції (Генрі, Ленгмюра, Фрейндліха), коефіцієнт розподілу.
Розподіл молекул між двома рідкими фазами, закон розподілу Нернста. Основне
рівняння лінійної ідеальної хроматографії.
Хроматограма, хроматографічний пік, характеристики утримування:
утримуваний і виправлений утримуваний об`єм, час і виправлений час
утримування, вільний час, вільний об’єм, індекс утримування Ковача (І). Способи
якісного аналізу. Способи кількісного визначення: нормування, внутрішнього
стандарту, зовнішнього стандарту (абсолютної калібровки).
Пояснення причин розмивання хроматографічних піків. Взаємозв′язок між
типом ізотерми адсорбції (лінійна, опукла, увігнута) та формою хроматографічного
піку. Основне рівняння лінійно-ідеальної хроматографії. Зв′язок між утримуваним
об′ємом та коефіцієнтом розподілу. Поняття про теорію еквівалентних тарілок. Параметри, за допомогою яких
можна оцінити ефективність хроматографічної колонки: число теоретичних тарілок
(N) та висота (Н) еквівалентна теоретичній тарілці (ВЕТТ), експериментальне
знаходження цих величин на підставі хроматографічного піку. Ефективність
роботи колонки. Вплив на ефективність величини вільного (мертвого) об′єму.
Поняття про дифузійну (кінетичну) теорію. Рівняння Ван-Деємтера, визначення
оптимальної швидкості потоку рухомої фази.
Параметри, за допомогою яких можна оцінити селективність хроматографічної
колонки: ступінь розділення, коефіцієнт селективності.
Роздільна здатність хроматографічної колонки. Вплив ефективності і
селективності на роздільну здатність хроматографічної колонки. Оптимізація
процесу розділення. Критерій (коефіцієнт) розділення. Коефіцієнт ємності колонки.
Розрахунок оптимальної довжини хроматографічної колонки, яка забезпечує повне
розділення двох речовин.
Хроматографія (з грецьк. хромо-колір, графо-пишу ) – високоефективний фізико-хімічний метод розділення і аналізу, в якому речовина розподіляється між двома фазами: рухомою і нерухомою.
Істор.
В 1850 році в роботах німецького хіміка Рунге було описано процес розділення фарбників методом фронтальної проявки на папері. Знайдені й інші роботи аналогічного характеру. Проте досліди Рунге й інших вчених не склали наукової дисципліни.
Засновником хроматографії вважають російського вченого Михайла Семеновича Цвєта. Відкриття хроматографії відноситься до періоду завершення М.С. Цвєтом магістрської дисертації в Петербурзі (1900-1902) і першого періоду роботи в Варшавському унверситеті (1902-1903). Більша частина роботи була зроблена ним в Петербурзі в Ботанічній лабораторії Академії наук, а в Варшаві проведені остаточні досліди і обдумані отримані результати. Ця дисертація була присвячена питанням хіміко-фізичної будови хлорофільного зерна і в ній вже є зачатки хроматографічного методу.
Хроматографію спочатку використовували дуже рідко, вона зявилась занадто рано. Прихований період хроматографії тривав приблизно 20 років, причому протягом цього періоду зявилась лиш невелика кількість про різноманітні застосування цього методу.
Прихований період хроматограффії закінчився в 1931 році, після того як Е.Ледерер прочитав зроблений Вільштетером рукописний переклад книги М.С. Цвєта на німецьку мову, провів хроматографічне розділення каротинів. З тих пір хроматографію почали широко використовувати в ботанічних і біохімічних лабораторіях.
Важливим етапом стало відкриття Н. А. Ізмайловим і М. С. Шрайбер методу хроматограффії в тонкому шарі в 1938 році в Харківському хіміко-фармацевтичному інституті. Подальшим важливим в розвитку хроматограффії стало відкриття Мартіном і Сингом в 1940 році варіанту рідинної розподільної хроматограффії на прикладі розділення похідних амінокислот на колонці, заповненій силікагелем, насиченим водою, з використанням хлороформа в якості розчинника.
За відкриття розподільного варіанту хроматограффії Мартін і Синг в 1952 році отримали Нобелівську премію.
Класиф.
Варіанти хроматографії за фазовим станом
Газова хроматографія (використовується наприклад для визначення якості харчового спирту)
Рідинна хроматографія (використовується для аналізу та виділення органічних сполук)
Хроматографія над критичними рідинами/газами (рідкісний вид, проміжний між першими двома. Найчастіше використовують як елюєнт вуглкислий газ під високим тиском та підвищених температурах)
Варіанти хроматографії за способом проведення
Препаративна - використовується для розділення речовин залежно від їхньої швидкості руху. В більшості випадків застосовують рідинну зроматографію.
Аналітична - має на меті лиш оцінити склад суміші. Маси зразків - мікрограми.
Найросповсюдженіші техніки
Тонкошарова хроматографія
Аналітична Тонкошарова хроматографія широко застосовується в органічній хімії для поточного аналізу сумішей (сумарний час експерименту 2-10хв). Нерухомою фазою служить силікагель нанесений на пластинку (найчастіше товсту алюмінієву фольгу). Як рухому фазу застосовують органічні розчинник. Набір гептан<етилацетат<метанол дозволяє елюювати більшість сполук. Часто також застосовують етер та хлороформ. Тонкошарова хроматографія можлива й в препарати
Колонкова хроматографія
Один з основних спосіб очистки органічних речовин в сучасній синтетичній практиці. Силікагелем набивають скляну колонку завтовшки 5-50мм. Зверху наносять малу кількість концентрованого р-ну суміші, а потім починають елюювання аналізуючи час від часу розчин, що виходить через малий отвір знизу колонки.
Hplc (верх)
HPLC (ВЕРХ, ВисокоЕфективна Рідинна Хроматографія) використовує прикладання зовнішнього тиску для прискорення проходження рідини через колонку. Це дозволяє застосовувати наповнювач з часточками меншого розміру й прискорює розділення. Препаративні хроматографи для розділення органічних речовин працюють при тиску порядку 100-600 бар з металевими колонками діаметром 0.5-4.6 мм (найчастіше використовують диаметром 2.1 та 4.0 - 4.6 мм) та довжиною 15-300 мм. Як нерухому фазу застосовують ліпофільно-модифікований силікагель (оберненофазна хроматографія), тоді як рухомою фазою слугують суміші води та органічного розчинника (найчастіше ацетонітрилу). ВЕРХ застосовують як для аналізу, так і для розділення сумішей. Типовий час експерименту 2-30хв.
Афінна хроматографія
Для розділення біологічних зразків часто застосовують модифікування нерухомої фази речовиною, що вибірково зв'язується з сполукою, що цікавить експериментатора. Так, наприклад очистка антитіл може проводитись на колонках з сефарози модифікованої протеїном.
Газова хроматографія. Принцип методу. Вимоги до визначуваних речовин. Гази-
носії (рухома фаза) та вимоги до них.
Блок-схема газового хроматографу (дозатор, термостат колонок, детектор). Типи
хроматографічних колонок за призначенням, за способом заповнення сорбентом.
Класифікація детекторів за універсальністю, за способом вимірювання (потокові,
концентраційні). Основні характеристики детектора (МВ, ЛДД). Принцип роботи:
катарометра (ДТП), полуменево-іонізаційного (ПІД), електронозахоплюючого
(ЕЗД) детекторів.
Газо-адсорбційна хроматографія. Фізико-хімічні основи методу. Хроматографія
з програмуванням температури. Газо-рідинна хроматографія. Фізико-хімічні
основи методу. Рідкі нерухомі фази і вимоги до них.
Реакційно-сорбційне концентрування при аналізі повітря.
Застосування газової хроматографії для аналізу органічних сполук
(нафтопродуктів) в природних водах.
Газова хроматографія -
найбільш теоретично розроблений метод
аналізу. Саме розвиток теорії
і практики газової хроматографії сприяло
швидкому розвитку в останні десятиліття
рідинної колонкової хроматографії і
високошвидкісний рідинної хроматографії.
Відмінність методу газової хроматографії
від іншиххроматографічних методів
пов'язані з тим, що в якості рухомої фази
в ній використовують газ. У залежності
від агрегатного стану нерухомої
фази розрізняють газо-адсорбційну
хроматографію і газо-рідинну.
Газохроматографическое поділ в таких
системах досягається за рахунок
багаторазово повторюваногопроцесу розподілу
компонентів суміші між рухається газовою
фазою і нерухомою твердої або рідкої
фазою, нанесеною на інертний
носій. Процес поділу
заснований на відмінності в розчинності
і летючості аналізованих компонентів.
Швидше через хроматографічну колонку
рухається той компонент, розчинність
якого в нерухомій фазі менше, а летючість
при даній температурі більше.
Вибір умов
отримання ефективної колонки в газовій
хроматографії випливає безпосередньо
із загальної теорії хроматографічного
розділення, а вибір селективної
стаціонарної фази пов'язаний з теорією
адсорбції і розчинення. Відмінності в
коефіцієнтах розподілу компонентів
між рухомою і стаціонарної фазами
обумовлені відмінностями міжмолекулярних
взаємодій. Найбільш важливими з них є
Ван-дер-ваальсових взаємодії. Велику
роль також відіграє такий вид
взаємодій, як воднева зв'язок, причому
внесок її в утримування значно зменшується
зі зростанням температури. Це може
виразитися в зміні порядку виходу
поділюваних речовин з колонки при
підвищенні температури. Комплексоутворення
для селективного розділення речовин в
газовій хроматографії використовується
рідше, ніж у рідинної.
Газова
хроматографія буває елюентная, фронтальна
та витіснювальний.
Застосування
газу як рухомої фази обумовлює
такі переваги методу,
як швидкість проведення аналізу, чіткість
поділу. Аналізована проба проходить
через колонку у вигляді газу або пари.
Цим методом можуть бути проаналізовані
не тільки газоподібні, а й рідкі та
тверді речовини. Їх аналіз можливий при
нагріванні, що необхідно для переведення
речовин в газоподібний стан. Тому
температура як робочий параметр процесу
грає в газовій хроматографії велику
роль, ніж в інших хроматографічних
процесах. Робочі температурні межі для
газо-адсорбційної хроматографії від
70 до 600 ° С, для газо-рідинної - від 20 до
400 ° С. Описана апаратура для проведення
газохроматографічний аналізів в області
температур вище 800 ° С. У більшості
випадків Газохроматографический аналіз
проводять в ізотермічних умовах. При
аналізі речовин з великим розкидом
значень температур кипіння періодично
або безперервно у процесі аналізу
підвищують температуру. Промисловістю
випускаються прилади
для роботи з програмуванням температури.
Методом
газової хроматографії можуть бути
проаналізовані речовини з молекулярною
масою менше 400. Випаровування цих речовин
можна провести 'відтворено, тобто вони
можуть бути переведені в парову фазу і
знову сконденсовані без зміни складу.
В
аналітичній практиці в основному
застосовують метод газорідинної
хроматографії. Його переваги перед
газо-адсорбційним пов'язані головним
чином з можливістю широкого вибору
нерухомих рідких фаз різної хімічної
природи, а також з високою чистотою і
однорідністю рідин. Термостійкість
адсорбентів дає можливість також
проводити поділу висококиплячих
сполук.
Недоліком
газо-адсорбційного методу є нелінійність
ізотерм адсорбції, що призводить до
несиметричності піків.
Газохроматографический
АНАЛІЗ НЕОРГАНІЧНИХ РЕЧОВИН
Розвиток методів
газової хроматографії в аналізі
неорганічних речовин відстає в порівнянні
з газовоюхроматографією органічних
речовин. По-перше, це пов'язано з
агресивністю багатьох неорганічних
сполук по відношенню до адсорбенту,
нерухомим фазах і до матеріалів,
з яких виготовляється зазвичай апаратура
для проведення газохроматографічний
аналізів. По-друге, газова хроматографія
неорганічних речовин почала розвиватися
пізніше, ніж газова хроматографія
органічних сполук. Це обумовлено тим,
що для аналізу неорганічних речовин є
класичні методи, що перевершують за
точністю і швидкості методи аналізу
органічних сполук. Одна вже в даний час
газова хроматографія дозволяє аналізувати
сполуки майже всіх елементів періодичної
системи.
ВИМОГИ
ДО аналізованій речовині
Газохроматографическим
методом можуть бути проаналізовані не
будь-які речовини, а тільки відповідаютьпевним
вимогам, головні з яких перераховані
нижче.
1.
Летючість. Достатньо, щоб пружність
пари речовини при робочій температурі
колонки була невисокою. Більш летючим
вважається речовина, пружність пари
якого вище, ніж в іншого. Наявність
великих моментів диполя, поляризація,
воднева зв'язок призводять до зменшення
летючості; іонні та сільнополярние
з'єднання нелетких.
2.
Стабільність. Кількісний
аналіз речовини
можливий, якщо воно випаровується в
дозаторі і елюіруется без розкладання,
тобто є термостійким. При розкладанні
речовин на хроматограмі з'являються
неправдиві піки, притаманні продуктам
розкладання, що призводить до помилок
в аналізі. Можливий аналіз сполук, для
яких відпрацьована методика відтвореного
розкладання.
3.
Інертність. Речовина не повинно утворювати
міцних сольвати при розчиненні в рідкій
стаціонарної фазі, не має реагувати
з матеріалами,
з яких виготовлені деталі хроматографа.
4.
Легкість отримання. При проведенні
кількісного аналізу бажано працювати
з такими сполуками, які легко отримати
з кількісним виходом.
Цим
вимогам в більшій мірі, як правило,
задовольняють органічні речовини. Однак
в останні роки розроблені способи
газохроматографического аналізу різних
металів і їх неорганічних і органічних
сполук.
АНАЛІЗ
МЕТАЛІВ І ЇХ СПОЛУК
Аналіз
вільних металів можливий при використанні
сверхвисокотемпературной хроматографічноїапаратури.
Сполук металів, летючих при порівняно
низьких температурах,
небагато: галогеніди,алкоголяти,
різні хелати, гідриди.
Вільні
метали. Розроблено методи хроматографування
вільних металів при надвисоких
тисячеградусних температурах. Наприклад,
вдалося здійснити пряме Газохроматографическое
визначення цинку, кадмію і магнію в
сплавах типу припоїв і легких сплавах
на основі олова, свинцю та вісмуту без
хімічної обробки. Розділені цинк, кадмій і ртуть у
вигляді парів цих металів. Металеві калій
та натрій розділити
у вигляді пари поки не вдалося, вони
елюіруются разом при 600-1000 0 C.
У майбутньому пряме Газохроматографическое
поділ металів може бути використано
при очищенні металів та їх сплавів від
ультрамалих кількостей домішок.
Гідриди
металів. У ряді робіт здійснено
Газохроматографический аналіз летючих
гідридів металів. Можливо безпосереднє
поділ гідридів сурми, олова, титану,
ніобію і танталу. При хроматографування
гідридів металів слід враховувати їх
високу реакційну здатність, схильність
до гідролізу і легку окислюваність.
Газохроматографический аналіз гідридів
можливий лише за відсутності кисню в
системі.
Галогеніди металів.
Газохроматографическим методом можуть
бути розділені і кількісно
визначенігалогеніди перехідних
металів. Поділ летких хлоридів можна
здійснити методом термохроматографіі
в поєднанні з комплексоутворення.
Описано поділ летких хлоридів Sb, Sn, In,
Cd, Zr, Hf, Nb, Ta, Mo, Tc, Re, Ru, Os методом
термохроматографіі з використанням
температурного градієнта від 600 до 25 °
С. При значно нижчих температурах можливе
визначення хлоридів галію, германію,
миш'яку, сурми і кремнію. Основні труднощі,
що виникає при хроматографії галогенідів
металів, - їх висока реакційна здатність.
У колонці при підвищеній температурі
вони реагують з багатьма рідкими
нерухомими фазами, з металевимиповерхнями деталей
хроматографа, в тому числі
колонок. Галогеніди легко
гідролізуються, тому з газу-носія слід
видаляти навіть сліди вологи.
Оскільки адсорбенти часто більш інертні,
ніж рідкі нерухомі фази, то при аналізі
галогенідів металів метод газо-адсорбційної
хроматографії має певні переваги в
порівнянні з методом газо-рідинної
хроматографії.
Із
усіляких сполук металів, використовуваних
для газохроматографического аналізу,
найбільший практичний інтерес
представляють хелати. Можна отримати
хелати практично будь-якого металу. В
даний час синтезовано багато хелатів,
летючість та термічна стійкість яких
задовольняють вимогам газової
хроматографії. Отримати хелати металів
з кількісним виходом можна або при
взаємодії хлоридів металів
звідповідними лігандами,
або при безпосередній обробці металу
або його оксиду хелатообразующім
реагентом. Це знательних спрощує і
прискорює аналіз. Тому надзвичайно
зручно використовувати хелати металів
з отримують нові ліганди, здатні давати
міцні летючі хелати з металами:
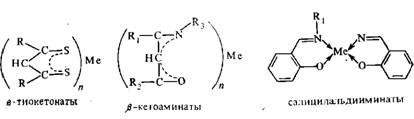 Слід
зазначити, що межа виявлення добре
хроматографірующіхся хелатів становить
кілька пікограмів і залежить від
чутливості детектора. Для погано
хроматографірующіхся хелатів межа
виявлення складає кілька мікрограмів.
Зв'язок
летючості хелатів зі структурою їх
молекул. Для цілеспрямованого синтезу
летких хелатів металів були зроблені
спроби теоретично узагальнити накопичений
експериментальний матеріал по
їх хроматографічному поведінки.
Спроби
зв'язати конфігурацію молекули комплексу
з летючістю або хроматографічностью
поки не дали однозначних результатів.
Відомі летючі і добре хроматографірующіеся
комплекси, що мають тетраедричних,
октаедричні і плоскоквадратную
конфігурації. У той же час багато
комплексів такої ж конфігурації мало
летючі чи погано хроматографіруются.
Відомі
як стабільні, так і лабільні леткі
комплекси, тобто не цілком зрозуміле
питання про роль кінетичної стабільності
комплексів.
Більшість відомих
летючих комплексів містить або шестичленні
цикли з делокалізовані подвійним
зв'язком, або чотирьохчленні цикли з
делокалізовані подвійним зв'язком.
Практично невідомі летючі хелати з
п'ятичленних циклом.
До теперішнього
часу встановлено, що структура комплексу
впливає на його хроматографічне утримування.
Утримання ізоструктурного по-дикетонатів
різних металів з одним і тим же лігандом
зростає із збільшенням радіуса іона
металу. Проте утримування аналогічних
за структурою хелатів різних металів
в більшій мірі обумовлено лігандом і
використовуваної рідкою фазою. При
невеликих відмінностях іонних радіусів
металів можна підбором рідкої фази
змінити порядок виходу хелатів з колонки.
Так, при хроматографування в-кетоамінатов
нікелю та міді на колонці з
поліметілтріфторпропіл-сілоксанов
QF-I хелат нікелю виходить з колонки
раніше хелати міді. На колонці з апіезоном
L ці хелати виходять одночасно, а на
колонці з полікарборансілоксаном
в.-кетоамінат міді виходить
раніше відповідного хелату
нікелю. Часто багато експериментально
спостережувані факти можна пояснити
тільки специфічною взаємодією молекул
хелатів металів з рідкою фазою,
однак природа цієї
взаємодії у багатьох випадках недостатньо
ясна.
Механізм утримування
хелатів. У ряді робіт досліджувався
механізм утримування хелатів металів.
Було встановлено, що утримування ряду
хелатів визначається трьома головними
факторами: 1) розчиненням в рідкій фазі;
2) адсорбцією на поверхні твердої
фази; 3) адсорбцією хелати на поверхні
рідкої фази.
Газова хроматографія
з модифікованої рухомою фазою. Для
розділення комплексів металів розроблені
два методи, які використовують газову
хроматографію з модифікованою рухомою
фазою.
В одному з них використовується
носій, що містить лари ліганду. Розкладання
і сорбцію по-дикетонатів металів у
колонках зменшують додаванням в таз-носій
невеликої кількості парів відповідного
по-дикетону. Термодинамічні характеристики
системи при цьому не змінюються.
Поліпшення хроматограм пояснюється
придушенням дисоціації хелатів в рідкій
фазі в присутності надлишку вільного
по-дикетону. У таких умовах вдалося
повністю розділити ряд хелатів сусідніх
в таблиці Д.І. Менделєєва РЗЕ.
Цей метод поки що не вдалося поширити
на інші леткі комплекси металів, такі,
як ді-етілдітіокарбамінати,
діалкілдитіофосфату і діалкілдітіо-фосфінати.
У
другому методі пропонується використовувати
три високих тисках в якості рухомої
фази фреон в сверхкритическом стані.
При цьому летючість багатьох комплексів
металів збільшується за рахунок зміни
термодинамічних параметрів системи.
Метод не знайшов широкого практичного
застосування через порівняльної
складності апаратури.
Слід
зазначити, що великі труднощі в газовій
хроматографії хелатів металів пов'язані
з аномалією в поведінці багатьох з них
у хроматографічної колонці, причому
аномальна поведінка різко посилюється
при переході до дуже малим
кількостей.
ВИЗНАЧЕННЯ ВОДИ
Вміст
води в речовинах різного агрегатного
стану можна визначати методами
газо-рідинної, газо-адсорбційної і
реакційної газової хроматографії.
Найшвидшим і часто найбільш зручним
способом визначення води в неорганічних
і органічних матеріалах є
метод газо-адсорбційної хроматографії
на колонках з пористими
полімерними сорбентами або
вуглецевими молекулярними ситами. Метод
газо-рідинної хроматографії для
визначення води менш придатний. При
використанні «акполярних, так і неполярних
рідких фаз, нанесених на діатомітової
носії, піки води виходять несиметричними,
в першому випадку - через сильний
взаємодії води з гідроксильними групами
поверхні носія, а в другому - через
утворення міцних водневих зв'язків між
молекулами полярної нерухомої фази і
молекулами води. Найбільш симетричні
піки води були отримані на насадці, що
складається з тефлону і різних
поліетіленгліколей, тобто при використанні
зовсім інертного носія нерухомої рідкої
фази.
Часто вміст води визначають
непрямими методами, застосовуючи
реакційну газову хроматографію. Водареагує
з гідридами металів, карбідом кальцію,
металевим натрієм і т. д., продукти
реакції детектируются полум'яно-іонізаційним
детектором.
ГІДНОСТІ ТА ОБЛАСТІ
ЗАСТОСУВАННЯ Газовий хроматограф
Метод
газової хроматографії є одним
з найсучасніших методів аналізу.
Його відмінні риси - експресність, висока
точність, чутливість, можливість
автоматизації. За допомогою цього методу
можуть бути вирішені багато аналітичних
проблеми вибором хроматографічної
системи і робочих умов. Широкий набір
стаціонарних рідких фаз і адсорбентів,
з одного боку, програмування температури,
високий тиск, специфічні методи
детектування, з іншого боку, дозволяють
розділяти і кількісно визначати з'єднання
з ледь помітною різницею в тиску пари.
Ступінь універсальності і гнучкості
методу газової хроматографії багато в
чому визначається існуючим технічним
рівнем апаратури. Якщо в якісній газової
хроматографії надійна ідентифікація
компонентів суміші може бути найчастіше
забезпечена лише поєднанням з іншими
незалежними аналітичними методами, то
кількісний Газохроматографический
аналіз може розглядатися як самостійний
аналітичний метод, який дає результати,
які не викликають сумнівів.
Газова
хроматографія використовується також
у препаративних цілях для очищення хімічних
препаратів, виділення індивідуальних
речовин із сумішей. Метод особливо
ефективний при розділенні речовин, які
стосуються одного і того ж
класу - вуглеводнів,
органічних кислот, спиртів і т. д.
Метод
широко застосовується у фізико-хімічних
дослідженнях: для визначення фізико-хімічних
властивостей адсорбентів, для визначення
термодинамічних характеристик адсорбції,
теплоти адсорбції, 'поверхні твердого
тіла і термодинамічних властивостей
розчинів - констант рівноваги, ізотерм
розподілу, коефіцієнтів активності та
ін
Слід зазначити, що метод
безперервно розвивається і вдосконалюється.
Розширюються і межі застосування методу
в різних областях науки і
техніки. У хімії та нафтохімії це аналіз
нафти і продуктів її переробки: аналіз
сумішей газоподібних вуглеводнів;
аналіз бензину, воску і продуктів їх
окислення; вивчення сіро-та азотовмісних
продуктів крекінгу;
аналіз розчинників - спиртів, кетонів,
сумішей вуглеводнів; вивчення складу
природних продуктів. У сільському господарстві це
аналіз гербіцидів, пестицидів,
добрив.
Розвиток методу
йде шляхом синтезу нових хелатів металів,
досить летких і стійких в умовах
хроматографування, а також у напрямку
пошуку ше більш чутливих і селективних
детектуючих систем для комплексних
сполук металів з органічними
лігандами.
Метод газової
хроматографії незамінний в металургії,
енергетиці, біології, медицині, в харчовій
промисловості, використовується
для управління технологічними
процесами.
Слід
зазначити, що межа виявлення добре
хроматографірующіхся хелатів становить
кілька пікограмів і залежить від
чутливості детектора. Для погано
хроматографірующіхся хелатів межа
виявлення складає кілька мікрограмів.
Зв'язок
летючості хелатів зі структурою їх
молекул. Для цілеспрямованого синтезу
летких хелатів металів були зроблені
спроби теоретично узагальнити накопичений
експериментальний матеріал по
їх хроматографічному поведінки.
Спроби
зв'язати конфігурацію молекули комплексу
з летючістю або хроматографічностью
поки не дали однозначних результатів.
Відомі летючі і добре хроматографірующіеся
комплекси, що мають тетраедричних,
октаедричні і плоскоквадратную
конфігурації. У той же час багато
комплексів такої ж конфігурації мало
летючі чи погано хроматографіруются.
Відомі
як стабільні, так і лабільні леткі
комплекси, тобто не цілком зрозуміле
питання про роль кінетичної стабільності
комплексів.
Більшість відомих
летючих комплексів містить або шестичленні
цикли з делокалізовані подвійним
зв'язком, або чотирьохчленні цикли з
делокалізовані подвійним зв'язком.
Практично невідомі летючі хелати з
п'ятичленних циклом.
До теперішнього
часу встановлено, що структура комплексу
впливає на його хроматографічне утримування.
Утримання ізоструктурного по-дикетонатів
різних металів з одним і тим же лігандом
зростає із збільшенням радіуса іона
металу. Проте утримування аналогічних
за структурою хелатів різних металів
в більшій мірі обумовлено лігандом і
використовуваної рідкою фазою. При
невеликих відмінностях іонних радіусів
металів можна підбором рідкої фази
змінити порядок виходу хелатів з колонки.
Так, при хроматографування в-кетоамінатов
нікелю та міді на колонці з
поліметілтріфторпропіл-сілоксанов
QF-I хелат нікелю виходить з колонки
раніше хелати міді. На колонці з апіезоном
L ці хелати виходять одночасно, а на
колонці з полікарборансілоксаном
в.-кетоамінат міді виходить
раніше відповідного хелату
нікелю. Часто багато експериментально
спостережувані факти можна пояснити
тільки специфічною взаємодією молекул
хелатів металів з рідкою фазою,
однак природа цієї
взаємодії у багатьох випадках недостатньо
ясна.
Механізм утримування
хелатів. У ряді робіт досліджувався
механізм утримування хелатів металів.
Було встановлено, що утримування ряду
хелатів визначається трьома головними
факторами: 1) розчиненням в рідкій фазі;
2) адсорбцією на поверхні твердої
фази; 3) адсорбцією хелати на поверхні
рідкої фази.
Газова хроматографія
з модифікованої рухомою фазою. Для
розділення комплексів металів розроблені
два методи, які використовують газову
хроматографію з модифікованою рухомою
фазою.
В одному з них використовується
носій, що містить лари ліганду. Розкладання
і сорбцію по-дикетонатів металів у
колонках зменшують додаванням в таз-носій
невеликої кількості парів відповідного
по-дикетону. Термодинамічні характеристики
системи при цьому не змінюються.
Поліпшення хроматограм пояснюється
придушенням дисоціації хелатів в рідкій
фазі в присутності надлишку вільного
по-дикетону. У таких умовах вдалося
повністю розділити ряд хелатів сусідніх
в таблиці Д.І. Менделєєва РЗЕ.
Цей метод поки що не вдалося поширити
на інші леткі комплекси металів, такі,
як ді-етілдітіокарбамінати,
діалкілдитіофосфату і діалкілдітіо-фосфінати.
У
другому методі пропонується використовувати
три високих тисках в якості рухомої
фази фреон в сверхкритическом стані.
При цьому летючість багатьох комплексів
металів збільшується за рахунок зміни
термодинамічних параметрів системи.
Метод не знайшов широкого практичного
застосування через порівняльної
складності апаратури.
Слід
зазначити, що великі труднощі в газовій
хроматографії хелатів металів пов'язані
з аномалією в поведінці багатьох з них
у хроматографічної колонці, причому
аномальна поведінка різко посилюється
при переході до дуже малим
кількостей.
ВИЗНАЧЕННЯ ВОДИ
Вміст
води в речовинах різного агрегатного
стану можна визначати методами
газо-рідинної, газо-адсорбційної і
реакційної газової хроматографії.
Найшвидшим і часто найбільш зручним
способом визначення води в неорганічних
і органічних матеріалах є
метод газо-адсорбційної хроматографії
на колонках з пористими
полімерними сорбентами або
вуглецевими молекулярними ситами. Метод
газо-рідинної хроматографії для
визначення води менш придатний. При
використанні «акполярних, так і неполярних
рідких фаз, нанесених на діатомітової
носії, піки води виходять несиметричними,
в першому випадку - через сильний
взаємодії води з гідроксильними групами
поверхні носія, а в другому - через
утворення міцних водневих зв'язків між
молекулами полярної нерухомої фази і
молекулами води. Найбільш симетричні
піки води були отримані на насадці, що
складається з тефлону і різних
поліетіленгліколей, тобто при використанні
зовсім інертного носія нерухомої рідкої
фази.
Часто вміст води визначають
непрямими методами, застосовуючи
реакційну газову хроматографію. Водареагує
з гідридами металів, карбідом кальцію,
металевим натрієм і т. д., продукти
реакції детектируются полум'яно-іонізаційним
детектором.
ГІДНОСТІ ТА ОБЛАСТІ
ЗАСТОСУВАННЯ Газовий хроматограф
Метод
газової хроматографії є одним
з найсучасніших методів аналізу.
Його відмінні риси - експресність, висока
точність, чутливість, можливість
автоматизації. За допомогою цього методу
можуть бути вирішені багато аналітичних
проблеми вибором хроматографічної
системи і робочих умов. Широкий набір
стаціонарних рідких фаз і адсорбентів,
з одного боку, програмування температури,
високий тиск, специфічні методи
детектування, з іншого боку, дозволяють
розділяти і кількісно визначати з'єднання
з ледь помітною різницею в тиску пари.
Ступінь універсальності і гнучкості
методу газової хроматографії багато в
чому визначається існуючим технічним
рівнем апаратури. Якщо в якісній газової
хроматографії надійна ідентифікація
компонентів суміші може бути найчастіше
забезпечена лише поєднанням з іншими
незалежними аналітичними методами, то
кількісний Газохроматографический
аналіз може розглядатися як самостійний
аналітичний метод, який дає результати,
які не викликають сумнівів.
Газова
хроматографія використовується також
у препаративних цілях для очищення хімічних
препаратів, виділення індивідуальних
речовин із сумішей. Метод особливо
ефективний при розділенні речовин, які
стосуються одного і того ж
класу - вуглеводнів,
органічних кислот, спиртів і т. д.
Метод
широко застосовується у фізико-хімічних
дослідженнях: для визначення фізико-хімічних
властивостей адсорбентів, для визначення
термодинамічних характеристик адсорбції,
теплоти адсорбції, 'поверхні твердого
тіла і термодинамічних властивостей
розчинів - констант рівноваги, ізотерм
розподілу, коефіцієнтів активності та
ін
Слід зазначити, що метод
безперервно розвивається і вдосконалюється.
Розширюються і межі застосування методу
в різних областях науки і
техніки. У хімії та нафтохімії це аналіз
нафти і продуктів її переробки: аналіз
сумішей газоподібних вуглеводнів;
аналіз бензину, воску і продуктів їх
окислення; вивчення сіро-та азотовмісних
продуктів крекінгу;
аналіз розчинників - спиртів, кетонів,
сумішей вуглеводнів; вивчення складу
природних продуктів. У сільському господарстві це
аналіз гербіцидів, пестицидів,
добрив.
Розвиток методу
йде шляхом синтезу нових хелатів металів,
досить летких і стійких в умовах
хроматографування, а також у напрямку
пошуку ше більш чутливих і селективних
детектуючих систем для комплексних
сполук металів з органічними
лігандами.
Метод газової
хроматографії незамінний в металургії,
енергетиці, біології, медицині, в харчовій
промисловості, використовується
для управління технологічними
процесами.
Висновок
Застосування
хроматографії поряд з іншими
фізико-хімічними методами, а також їх
взаємне поєднання, єтенденцією в
розробці методик дослідження якості
споживчих товарів.
Рис. 3.6.4. Хроматограмма
градуювальної суміші, отримана на
хроматографі, оснащеному капілярноїколонкою
HP-FFAP (США)
1
оцтовий альдегід, 2 метиловий спирт оцтової
кислоти, 3 етиловий ефір оцтової кислоти,
4 метиловий спирт, 5 етиловий
спирт,
6 пропанол-1, 7 ізобутіловий спирт, 8 - 6
бутанол-1, 9 ізоаміловий спирт.
В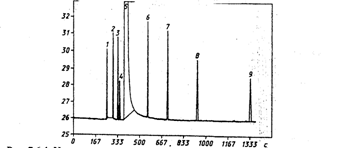 ідбувається
перегляд державних стандартів. Так, у
1997-1998 р.р. введені нові стандарти з
дослідження якості води питної (ГОСТ
Р51209-98), на вміст хлорорганічних пестицидів
і етилового спирту та горілки (ГОСТ
30536-97), які регламентують визначення
вмісту токсичних мікродомішок методами
газорідинної хроматографії. На рис.
3.6.4 представлена хроматограмма
токсичних мікродомішок горілки і
етилового спирту, з якої видно, що методом
ГЖХ з використанням капілярної колонки
можливо роздільне визначення всіх
компонентів (на відміну від методик
попереднього ГОСТ).
Методи
хроматографії володіють великою
аналітичної ємністю, і, як вже було
зазначено вище, знаходять саме широке
застосування.
Література:
1.
Дорохова О.М., Прохорова Г.В. Аналітична
хімія. Фізико-хімічні
методи аналізу. - М.: Вища школа,
1991.-256 с.
2. Курко В.І. Хромат
ідбувається
перегляд державних стандартів. Так, у
1997-1998 р.р. введені нові стандарти з
дослідження якості води питної (ГОСТ
Р51209-98), на вміст хлорорганічних пестицидів
і етилового спирту та горілки (ГОСТ
30536-97), які регламентують визначення
вмісту токсичних мікродомішок методами
газорідинної хроматографії. На рис.
3.6.4 представлена хроматограмма
токсичних мікродомішок горілки і
етилового спирту, з якої видно, що методом
ГЖХ з використанням капілярної колонки
можливо роздільне визначення всіх
компонентів (на відміну від методик
попереднього ГОСТ).
Методи
хроматографії володіють великою
аналітичної ємністю, і, як вже було
зазначено вище, знаходять саме широке
застосування.
Література:
1.
Дорохова О.М., Прохорова Г.В. Аналітична
хімія. Фізико-хімічні
методи аналізу. - М.: Вища школа,
1991.-256 с.
2. Курко В.І. Хромат
1. Набиванець Б.Й., Сухан В.В., Лисенко О.М. Основи хроматографічного аналізу.
ВПЦ “Київський університет”. 2002.
2. Набиванец Б.И., Мазуренко Е.А. Хроматографический анализ. Киев: “Вища
школа”. 1979.
3. Айвазов Б.В. Введение в хроматографию. Москва: “Высшая школа”. 1983.
4. Основы аналитической химии. Книга 1. Под ред. Ю.А.Золотова. М.: “Высшая
школа”. 1996.
5. Шпигун О.А., Золотов Ю.А. Ионная хроматография и ее применение в анализе
вод. – М.: МГУ, 1990.
