
§3. Электролиз водных растворов электролитов
При электролизе водных растворов необходимо учитывать возможность участия молекул воды и продуктов ее диссоциации - ионов H+ и ОН- в реакциях, протекающих на электродах. Рассмотрим процессы, протекающие на инертных электродах, изготовленных из графита или благородного металла (например, платины) с участием воды при различных значениях рН. В табл. 1 приведены уравнения реакций, протекающих на электродах в различных средах, и соответствующие им электродные потенциалы.
Таблица 1. Окислительно-восстановительные потенциалы процессов, протекающих при электролизе с участием воды
|
Кислая среда; рН=0 |
Нейтральная среда; рН=7 |
Щелочная среда; рН=14 |
катод (-) |
2H+ +2ē →H2; φ° = -0,000 В |
2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,828 В |
анод (+) |
Н2О- 2ē → ½О2 + 2Н+; φ° = 1,229 В |
Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В |
2ОН- -2ē →½О2 + Н2О φ° = 0,401 В |
ΔЕразл |
ΔЕразл = 1,229 - 0 = 1,229 В |
ΔЕразл = 0,815 - (-0,414) = 1,229 В |
ΔЕразл = 0,401 - (-0,823) = 1,229 В |
Представим данные таблицы в виде графика зависимости электродного потенциала от рН при электролитическом разложении воды (диаграмма Пурбе).
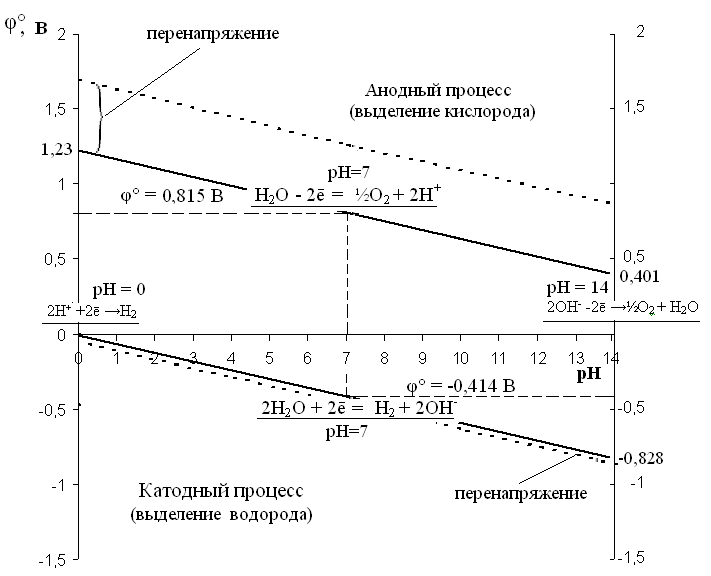
Рис. 5. Диаграмма зависимости электродного потенциала от рН для воды и продуктов ее диссоциации (диаграмма Пурбе).
Расстояние между сплошными линиями соответствует теоретическому значению потенциала разложения воды. Перенапряжение при выделении водорода и кислорода зависит от природы электрода. Так, при использовании платиновых электродов, перенапряжение водорода составляет 0,09 В, а кислорода 0,45 В.
При электролизе водных растворов электролитов (солей, кислот, щелочей) в электродных процессах наряду с молекулами воды участвуют ионы растворенного вещества. На катоде и аноде всегда идут те процессы, для которых необходим минимальный потенциал разложения ( ). На аноде первыми окисляются вещества с самым низким (наиболее отрицательным) потенциалом. На катоде восстанавливаются самые сильные окислители - вещества с высоким (наиболее положительным) потенциалом.
Разберем подробнее катодный и анодный процессы.
Совместим диаграмму Пурбе для катодного процесса с электрохимическим рядом напряжения металлов.
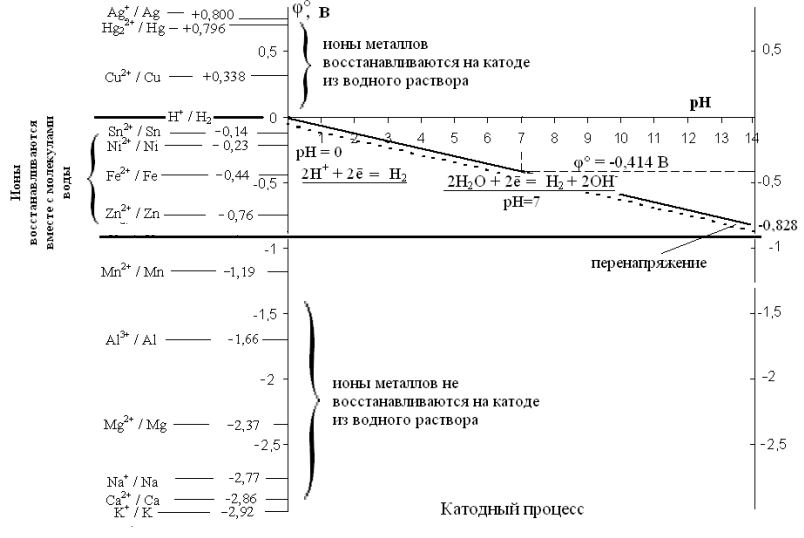 Рис.
6. Катодный процесс в водных растворах
электролитов
Рис.
6. Катодный процесс в водных растворах
электролитов
На катоде восстановление воды в зависимости от рН происходит в диапазоне потенциалов от 0 до - 0,84 В (с учетом перенапряжения). Катионы металлов, находящихся в ряду напряжений после водорода и имеющих потенциалы выше 0 В (Cu2+, Ag+ и др.), обладают более сильными окислительными свойствами по сравнению с водой, и на катоде они восстановятся раньше молекул воды (или ионов Н+). Вода при этом восстанавливаться не будет.
Катионы металлов с потенциалом от 0 до - 0,84 В восстанавливаются совместно с молекулами воды.
Катионы металлов с величиной стандартного электродного потенциала ниже - 0,84 В (от Li+ до Mn2+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды.
Для рассмотрения анодного процесса совместим диаграмму Пурбе с рядом напряжений неметаллов.
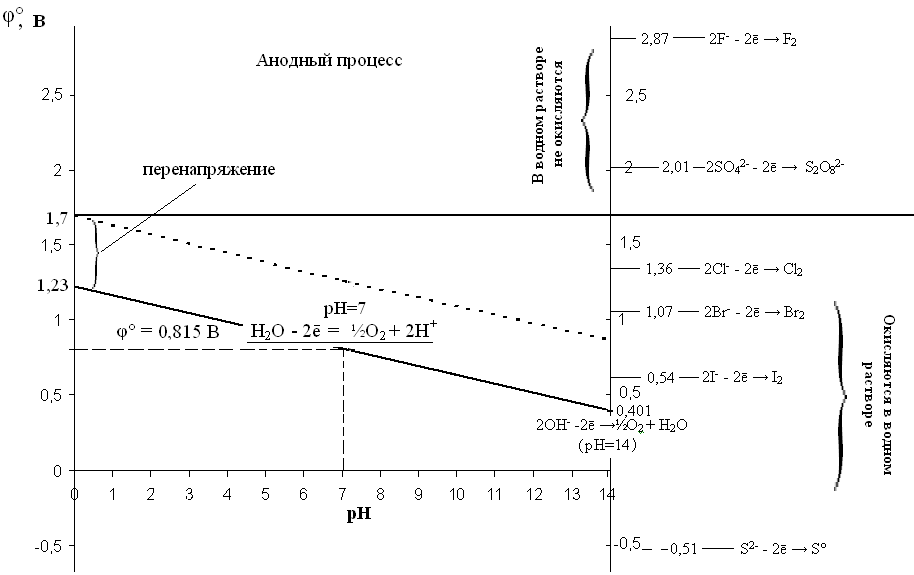
Рис. 7. Анодный процесс в водных растворах.
На инертном аноде окисление воды и продуктов ее диссоциации гидроксид-ионов происходит при значениях потенциала от 0,4 до 1,7 В. Анионы бескислородных кислот (S2-, I-, Вг-, С1-) особенно в кислой среде при их достаточной концентрации окисляются легче молекул воды. Поэтому при электролизе на аноде данные анионы будут окисляться раньше молекул воды.
Если раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СlО3 –, PO43– и др.) и фторид-анионы с потенциалом выше 1,7 В, то на аноде окисляются молекулы воды.
Пример 4. Составьте схемы электролиза водных растворов гидроксида натрия и серной кислоты.
Решение: В растворе гидроксида натрия (щелочная среда) на электродах могут идти реакции:
Катод (-):
Na+ + ē → Na°; φ° = - 2,71В
2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,828 В
Анод (+):
2ОН- -2ē →½О2 + Н2О; φ° = 0,401 В
Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В
Минимальное значение потенциала разложения электролита, т.е. разность между электродными потенциалами анода и катода будет в том случае, если на катоде восстанавливается вода (φ° = -0,828 В) как более сильный окислитель, а на аноде - ионы ОН- (φ° = 0,401 В).
Уравнение диссоциации электролита: NaOH → Na+ + OH- рН ≈ 14 |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
К катоду - катионы Na+ и молекулы Н2О 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,828 В |
К аноду - анионы ОН- и молекулы Н2О 2ОН- -2ē →½О2 + Н2О φ° = 0,401 В |
Анод (+) |
Суммарное уравнение электролиза: 2Н2О + 2ē → Н2 + 2ОН- 2ОН- -2ē →½О2 + Н2О Н2О
Потенциал разложения:
|
|||
В растворе серной кислоты (кислая среда, рН < 7) к катоду направятся катионы H+ и молекулы воды, а на анод - анионы SO42- и молекулы воды. Возможны следующие реакции:
Катод (-):
2Н+ + 2ē → Н2; φ° = 0,000 В 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
0,000 > -0,414 (перенапряжение в каждой из реакций одинаково 0,09 В) |
Анод (+):
Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В 2SO42- - 2ē → S2O82-; φ° = 2,01 В |
0,815 + 0,47(перенапряжение) < 2,01 |
Выбираем полуреакцию с наибольшим потенциалом на катоде и наименьшим потенциалом на аноде и составляем схему электролиза.
Уравнение диссоциации электролита: Н2SO4 → 2Н+ + SO42- |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
К катоду - катионы Н+ . Восстанавливаются ионы Н+: 2Н+ + 2ē → Н2; φ° = 0,000 В |
К аноду - анионы SO42- и молекулы Н2О. Окисляется вода: Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В
|
Анод (+) |
Суммарное уравнение электролиза: 2Н+ + 2ē → Н2 Н2О - 2ē → ½О2 + 2Н+ Н2О Н2 + ½О2 Потенциал разложения:
|
|||
Электролиз водных растворов щелочей и кислородсодержащих кислот приводит к образованию водорода на катоде и кислорода на аноде.
Пример 5. Рассмотрите процессы, протекающие при электролизе водных растворов следующих солей: Na2SO4, Cd(NO3)2, KBr, CuCl2 с платиновыми электродами.
Решение:
1) При электролизе раствора сульфата натрия (нейтральная среда) к катоду направятся катионы Na+, а к аноду - анионы SO42-. Возможны следующие электродные реакции:
Катод (-):
Na + + ē → Na; φ° = -2,77 В 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
-0,414 - 0,09(перенапряжение) > -2,77
|
Анод (+):
Н2О - 2ē → ½О2 + 2Н+; φ° = 1,23 В 2SO42- - 2ē → S2O82-; φ° = 2,01 В |
1,23 + 0,47(перенапряжение) < 2,01 |
Выбираем полуреакцию с наибольшим потенциалом на катоде и наименьшим потенциалом на аноде и составляем схему электролиза.
Уравнение диссоциации электролита: Na2SO4 → 2Na+ + SO42- |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
Восстанавливаются ионы Na+: 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
Окисляются молекулы Н2О: Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В
|
Анод (+) |
Суммарное уравнение электролиза: 2Н2О + 2ē → Н2 + 2ОН- Н2О - 2ē → ½О2 + 2Н+ 3Н2О Н2 + 2ОН- + ½О2 + 2Н+ Н2О Н2 + ½О2 Потенциал разложения:
|
|||
Принимая во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SO42– в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Na2SO4 + 3H2O ↔ H2↑ + 2NaOH + ½O2↑ + H2SO4.
у катода у анода
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
В случае, когда растворы катодного и анодного пространств перемешиваются, образующиеся в результате электролиза щелочь и кислота нейтрализуется и дают вновь соль (Na2SO4):
2NaOH + H2SO4 = Na2SO4 + 2H2O.
В итоге электролиз сводится к электрохимическому разложению воды:
Н2О Н2 + ½О2
2) При электролизе раствора Cd(NO3)2 к катоду направятся катионы Сd2+, а к аноду - анионы NO3-. Возможны следующие электродные реакции:
Катод (-):
Сd2+ + 2ē → Cd; φ° = -0,40 В 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
-0,414 - 0,09(перенапряжение) ≈ -0,40
|
Анод (+):
Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В 2NO3- - ē → N2O5 + ½O2-; φ° ≈ 2,1 В |
0,815 + 0,47(перенапряжение) < 2,1 |
Преобладание какой-либо из возможных катодных полуреакций определяется значением рН, который, в свою очередь, зависит от концентрации и степени гидролиза соли. При уменьшении рН в большей степени будет восстанавливаться вода. Для упрощения принимаем, что потенциалы обеих возможных реакций приблизительно одинаковы, поэтому равновероятны оба процесса.
Уравнение диссоциации электролита: Сd(NO3)2 → Сd2+ + 2NO3- |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
Сd2+ + 2ē → Cd; φ° = -0,40 В 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
Окисляются молекулы Н2О: Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В
|
Анод (+) |
Суммарное уравнение электролиза: Н2О + ē → ½Н2 + ОН- ½Сd2+ + ē → ½Cd Н2О - 2ē → ½О2 + 2Н+ 2Н2О + ½Сd2+ ½Н2 + ОН- + ½Cd + ½О2 + 2Н+ Н2О + ½Сd2+ ½Н2 + ½Cd + ½О2 + Н+ Потенциал разложения:
|
|||
В целом процесс выражается уравнением
Cd(NO3)2 + 2H2O Cd + Н2 + O2↑ + 2HNO3.
3) Электролиз водного раствора КВr.
Возможны следующие электродные реакции:
Катод (-):
К+ + ē → К; φ° = -2,93 В 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
-2,93 < -0,414 + 0,09(перенапряжение)
|
Анод (+):
Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В 2Br– – 2e = Br2-; φ° = 1,07 В |
1,07 < 0,815 + 0,47(перенапряжение) |
На катоде восстанавливается вода, а на аноде окисляются бромид-ионы.
Уравнение диссоциации электролита: КBr → К+ + Br– |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В |
2Br– – 2e = Br2-; φ° = 1,07 В |
Анод (+) |
Суммарное уравнение электролиза: 2Н2О + 2ē → Н2 + 2ОН- 2Br– – 2e = Br2 2Н2О + 2Br– Н2 + 2ОН- + Br2 Потенциал разложения:
|
|||
В целом процесс выражается уравнением:
2Н2О + 2КBr– Н2 + 2КОН + Br2
4. Электролиз водного раствора СuCl2.
Уравнение диссоциации электролита: CuCl2 « Cu2+ + 2Cl– |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
Сu2+ + 2e ® Сu .; φ° = 0,34 В
|
2Сl– - 2e® Сl2-; φ° = 1,36 В |
Анод (+) |
Суммарное уравнение электролиза: CuCl2 Сu + Сl2 Потенциал разложения:
|
|||
