
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«МУРМАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Электролиз
(общие вопросы, решение расчетных задач)
Методические указания по курсу «Химия» для студентов специальности
020804.65 «Геоэкология»
Мурманск
2010
Составитель – М.В. Васёха, канд.техн.наук., доцент кафедры химии МГТУ.
Методические указания рассмотрены и одобрены кафедрой 23.09.2010 года, протокол №1.
Рецензент – Т.А. Дякина, канд. хим. наук, доцент кафедры химии Мурманского государственного технического университета.
Методические указания содержат теоретические сведения об электролизе, примеры решения типовых задач. Предназначено для студентов специальности 020804.65 «Геоэкология».
Печатается в авторской редакции
Оглавление
Введение ………………………………………………………………..4
§1. Электролиз. Потенциал разложения вещества…………………...5
§2. Электролиз расплавов электролитов……………………………...9
§3. Электролиз водных растворов электролитов……………….……14
§4. Количественные характеристики электролиза……………….….24
Задачи для самостоятельного решения…………………………...….29
Приложение……………………………………………………………30
Библиографический список…………………………………………..34
Введение
Мысль о необходимости изучения химических и электрических явлений в их единстве впервые высказывалась М.В. Ломоносовым. Первые эксперименты в области электрохимии относятся к работам Л. Гальвани (1791 г.). В 1779 г. А. Вольта создал первый источник химической энергии – «вольтов столб», состоящий из ряда медных и цинковых кружков, разделенных суконными прокладками, смоченными кислотой.
В 1805 г. в России Т. Гротгусом были заложены основы теории электролиза. В значительной мере трудами российских ученых А.Н.Фрумкина, Л.И. Антропова, Я.М. Колотыркина, П.Ф. Антипина, Ю.К. Делимарского созданы современные представления теории электрохимии.
Электролиз широко применяется в различных отраслях промышленности. Этим способом получают такие важные продукты как хлор, щелочи, хлораты и перхлораты, надсерную кислоту, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и т. д.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Его применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности, для нанесения тонких покрытий металлов на поверхность изделий, для защиты их от коррозии, для придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
§1. Электролиз. Потенциал разложения вещества
Электролизом называется совокупность химических процессов, протекающих при пропускании постоянного электрического тока через растворы или расплавы электролитов. При электролизе химическая (окислительно-восстановительная) реакция протекает за счет энергии электрического тока
Представим себе элемент Даниэля - Якоби, который подключили к внешнему источнику постоянного тока, например, генератору (рис 1). Генератор - устройство, превращающее механическую работу в электрическую. При постепенном увеличении числа оборотов генератора, напряжение, которое он дает, достигнет значения ЭДС гальванического элемента. В этот момент реакция, ранее протекающая в элементе, прекратится. При дальнейшем повышении напряжения изменится направление движения электронов и реакция пойдет в другую сторону, начнется электролиз и гальванический элемент станет электролизером.
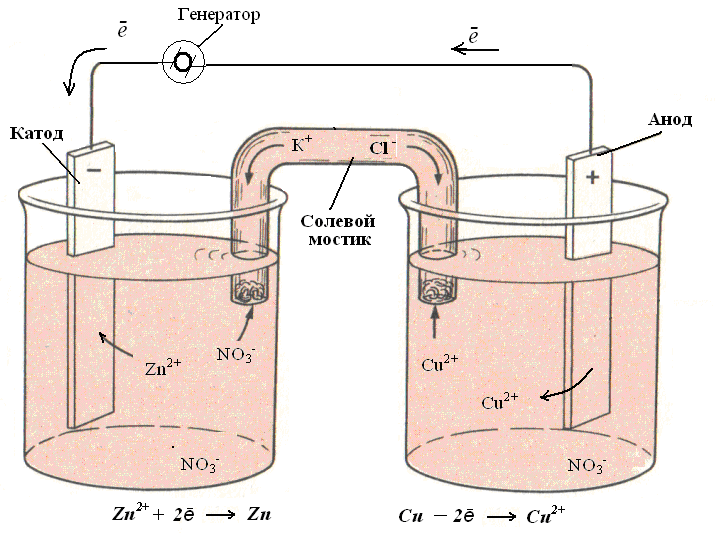
Рис. 1. Электролизер, полученный из гальванического элемента при подключении генератора электрического тока.
Направление реакции в гальваническом элементе можно изменить на противоположное, если приложить напряжение от внешнего источника большее, чем значение ЭДС гальванического элемента.
Электролиз - это совокупность окислительно-восстановительных процессов, происходящих на электродах, помещенных в электролит, при прохождении через него электрического тока от внешнего источника.
При изменении направления движения электронов, ионы цинка начали восстанавливаться, а медь окисляться. Процессы в электролизере стали противоположны процессам в гальваническом элементе, поэтому и заряды электродов стали обратными. В гальваническом элементе анод отрицательный, а катод положительный. В электролизере, наоборот, анод положительный (подключен к положительному полюсу источника тока), а катод отрицательный (соединен с отрицательным полюсом источника тока).
Но как бы ни работал элемент - как источник тока или как электролизер, - анодом всегда будет электрод, на котором происходит окисление, а катодом - электрод, на котором происходит восстановление. Восстановительное и окислительное действие тока значительно сильнее действия химических восстановителей и окислителей.
Таким образом, электролиз может происходить не при любой разности потенциалов, а при вполне определенной, называемой потенциалом разложения электролита. Эта величина равна ЭДС гальванического элемента с участием продуктов электролиза.
Потенциал разложения электролита представляет собой разность электродных потенциалов на аноде и катоде:
![]()
Если в процессе электролиза принимает участие только одно вещество, то потенциал разложения электролита при стандартных условиях можно вычислить по формуле:
![]() ,
,
где ΔfG°- стандартная свободная энергия образования вещества (энергия Гиббса) в Дж/моль;
n - наименьшее общее кратное чисел отданных и принятых электронов при участии в реакции электролиза одной формульной единицы вещества (число эквивалентности).
Электролиз каждого электролита начинается с определенного, характерного для него напряжения. Потенциалы разложения находят опытным путем. Для двухатомных молекул (HI, HBr, HCl) они почти совпадают с их стандартными потенциалами. Менее отчетливо это совпадение наблюдается в более сложных молекулах.
Пример 1. Вычислите потенциал разложения воды при электролизе.
Решение: Разложение воды происходит с образованием водорода на катоде и кислорода на аноде, как показано на рисунке 2.
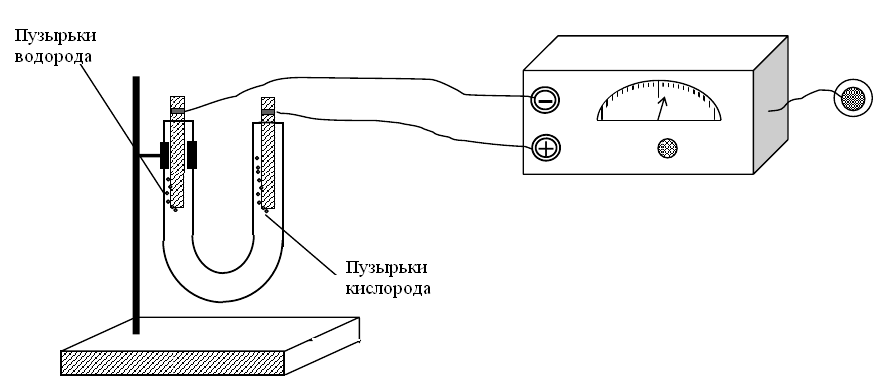
Рис. 2. Установка для электролитического разложения воды
Потенциал разложения воды можно вычислить двумя способами:
1 способ: Из таблицы (см. приложение) находим потенциалы процессов, происходящих на аноде и катоде.
Анод (+): Н2О - 2ē → ½О2 + 2Н+; φ° = 0,815 В
Катод (-): 2Н2О + 2ē → Н2 + 2ОН-; φ° = -0,414 В
![]()
2 способ: Ввиду того, что в процессе электролиза принимает участие только вода, можно воспользоваться формулой:
![]()
Для воды теоретический потенциал разложения с образованием газообразных водорода и кислорода равен 1,23 В, но экспериментально показано, что разложение происходит при напряжении 1,7 В. Разность между экспериментальным и теоретическим значением потенциала разложения называют перенапряжением. Для воды перенапряжение составляет 0,47 В. Оно обусловлено тем, что при электролизе часть энергии тратится на сопутствующие процессы (преодоление сопротивления электролита, перенос зарядов в пространстве и др.). Перенапряжение приводит к дополнительному расходу электроэнергии.
При электролизе воды вблизи электродов накапливаются кислород и водород. Возникает стремление Н2 и О2 к образованию воды. Иными словами, возникает водородно-кислородный гальванический элемент, дающий ЭДС направленную против напряжения, приложенного от внешнего источника. Такое явление называется поляризацией, которая является одной из причин возникновения перенапряжения.
Электролиз - это эффективный способ осуществления процессов окисления и восстановления. Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия самых сильных химических окислителей и восстановителей. В природе не существует химического окислителя более сильного, чем анод, и восстановителя более сильного, чем катод. Рассмотрим основные виды электролиза
