
§2. Электролиз расплавов электролитов
Электролиз расплавов широко используется для получения легких, тугоплавких и редких металлов, фтора, хлора и получения сплавов. Для электролиза расплавов характерно протекание процесса при высоких температурах в специально подготовленных для этого электролизерах с инертными электродами.
Например, при промышленном получении натрия проводят электролиз расплава хлорида натрия в электролизере Даунса.
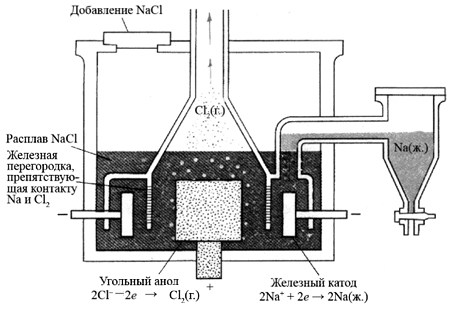
Рис. 3. Установка для электролитического получения натрия (электролизер Даунса). (Браун Т., Лемей Г.Ю. Химия - в центре наук: В 2-х частях. - М. Мир, 1983. - Ч.2.).
В электролизер при температуре более 800 °С помещают расплав хлорида натрия. В расплаве имеются ионы Na+ и Cl-. При подключении катода и анода к полюсам внешнего источника тока, в электролизере начинается направленное движение ионов. Катионы Na+ устремляются к катоду, где получают электроны и восстанавливаются до Na°, а анионы Cl- направляются к аноду, где теряют электроны и окисляются до газообразного хлора Сl2.
Процессы, происходящие при электролизе расплава хлорида натрия представим в виде схемы
Уравнение диссоциации электролита: NaCl
|
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
К катоду - катионы Na+ Na+ + ē → Na° катионы восстанавливаются |
К аноду - анионы Cl- Cl-– ē → ½Сl2 анионы окисляются |
Анод (+) |
Суммарное уравнение электролиза: NaCl
|
|||
По такой же схеме протекает электролиз расплавов всех галогенидов и гидридов щелочных и щелочноземельных металлов.
Пример 2. Вычислите напряжение, при котором начнется электролиз расплава хлорида натрия двумя способами.
Решение:
1 способ: Из таблицы (см. приложение) находим потенциалы процессов, происходящих на аноде и катоде.
Анод (+): Cl- – ē → ½Сl2; φ° = 1,359 В
Катод (-): Na+ + ē→ Na°; φ° = – 2,714 В
![]()
2 способ: Потенциал разложения вычислим исходя из стандартного значения свободной энергия образования вещества (энергии Гиббса) :
![]()
На практике широко применяют электролиз расплавов оксидов. Например, электролиз расплава Al2O3 при получении алюминия проводят в электролизере Холла. Оксид алюминия, растворенный в расплаве криолита при температуре около 1000 °С диссоциирует подобно соли, растворенной в воде. На катоде выделяется жидкий алюминий, а на аноде выделяется кислород.
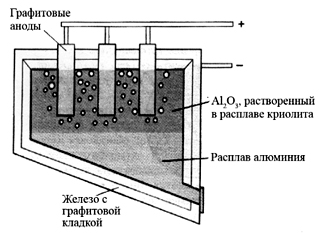
Рис. 4. Схема электролизера Холла для промышленного получения алюминия (Браун Т., Лемей Г.Ю. Химия - в центре наук: В 2-х частях. - М. Мир, 1983. - Ч.2.).
Оксид алюминия, растворенный в расплаве криолита при температуре около 1000 °С диссоциирует подобно соли, растворенной в воде. На катоде выделяется жидкий алюминий, а на аноде выделяется кислород.
Уравнение диссоциации электролита: Al2O3
|
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
К катоду - катионы Al3+ Al3+ + 3ē → Al ° | х 2 катионы восстанавливаются |
К аноду - анионы O2- O2- - 2ē → ½O2 | х 3 анионы окисляются |
Анод (+) |
Суммарное уравнение электролиза: Al2O3
|
|||
Пример 3. При получении алюминия в электролизер Холла помещают расплав, состоящий из расплавленных солей A1F3, NaF, Al2O3. Вычислите потенциалы разложения указанных веществ, пользуясь следующими значениями: ΔfG°(A1F3)= -1420; ΔfG°(NaF)=-536; ΔfG°(Al2O3)=-1580 кДж/моль и определите, какое вещество будет разлагаться при электролизе в первую очередь.
Решение: Вещество, обладающее наименьшим потенциалом разложения, будет разлагаться при электролизе при самом низком напряжении.
![]() ;
;
![]() ;
;
![]() .
.
Оксид алюминия при электролизе будет разлагаться первым с образованием алюминия и кислорода, т.к. потенциал разложения Al2O3 самый низкий.
Из нескольких возможных при электролизе процессов будет проходить тот, осуществление которого сопряжено с меньшими затратами энергии.
Электролиз расплавленных солей, содержащих анионы кислородсодержащих кислот (SO42-; CO32-; NO3- и др.) используется на практике значительно реже. Рассмотрим электролиз расплава сульфата калия.
Катодный процесс проходит также как и в примере с хлоридом натрия. Анодный процесс сопровождается окислением SO42- до анионов надсерной (или пероксодисерной) кислоты S2O82-, которые при высокой температуре разлагаются с образованием кислорода, оксида серы (IV) и сульфат-иона.
Уравнение диссоциации электролита: К2SO4 2К+ + SO42- |
|||
Катодный процесс |
Анодный процесс |
||
Катод (-) |
К катоду - катионы Na+ К+ + ē→ К° катионы восстанавливаются |
К аноду - анионы SO42- SO42- - ē → ½S2O82- анионы окисляются |
Анод (+) |
Продукты электролиза разлагаются: S2O82- → SO42- + SO3 + ½О2 |
|||
Суммарное уравнение электролиза: К2SO4 2К + ½S2O82- (½SO42- + ½SO3 + ¼О2) |
|||
В первом приближении можно считать, что анионы кислородсодержащих кислот при электролизе расплава окисляются на аноде до высшего оксида и кислорода.
