
Направление протекания химического процесса
1. Энергия Гиббса
Для процессов, происходящих в природе, известны две движущие силы: первая - стремление перейти в состояние с наибольшей энергией и выделить тепло при таком переходе, т.е. понизить энтальпию, и вторая - стремление перейти в наиболее вероятное состояние с максимально допустимой в данных условиях степенью беспорядка, максимальной энтропией, т.е. повысить энтропию. Если в процессе степень беспорядка не изменяется (∆S = 0), то направление процесса определяется изменением энтальпии и процесс происходит самопроизвольно в направлении уменьшения энтальпии
(∆H < 0).
Если в процессе не происходит энергетических изменений (∆Н = 0), то фактором, определяющим направление реакции, является энтропия и процесс пойдет самопроизвольно в направлении, при котором степень беспорядка возрастает, то есть в сторону увеличения энтропии.
Для количественного сопоставления этих противодействующих факторов необходимо их выразить в одинаковых: единицах.
Это
возможно сделать, если помножить ∆S на
Т-1(град
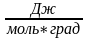 )
)
Таким образом, влияние энтальпийного фактора -представляется величиной ∆Н, а влияние энтропийного фактора - величиной Т*∆S , Предположим, что энтальпийный и энтропийный факторы компенсируют друг друга. Тогда имеет место равенство:
∆Н = Т*∆S, которое определяет состояние равновесия системы. Оно относится к равновесию между кипящей жидкостью и ее насыщенным паром и к равновесию между плавящимися кристаллами и отвердевающей жидкостью, и к другим видам фазовых превращений индивидуальных веществ. Иными словами, выше написанное уравнение характеризуется состоянием системы, когда скорости протекающих в ней противоположных процессов(например, испарения и конденсации, прямой и обратной химической реакции) становятся равными. Из этого уравнения возможно определить в равновесном процессе:
S
=
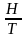 (16)
(16)
В общем случае суммарный эффект, отображающий влияние энтальпийного и энтропийного факторов в процессах, протекающих при посто¬янной температуре и давлении, определяется изменением изобарно - изотермического потенциала, или просто изобарного потенциала:
∆G = ∆Н - Т∙∆S. (17)
G - называют еще свободной энергией Гиббса в честь американского ученого Гиббса - одного из основателей современной химической термодинамики.
Значение выражается в -кДж/моль или ккал/моль. Характер изменения изобарного потенциала позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство: ∆G <0. Иными словами, если G в процессе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно. Увеличение же изобарного потенциала ∆G>0 свидетельствует о невозможности осуществления процесса в данных условиях. Если же ∆G = 0, то
система находится в состоянии химического равновесия. При расчетах широко используется значение∆G 298о образ. стандартного изобарно-изотермического потенциала образования, т.е. изменение изобарного потенциала при протекании реакции образования одного моля соединения из простых веществ при стандартных условиях. Подобно энтальпии образования изобарный потенциал образования простых веществ принимается равным нулю. Значения для многих простых веществ определены и сведены в таблицы. Стандартные изобарные потенциалы некоторых веществ приведены в таблице 2.
Вещество |
∆Go 298 обр. кДж/моль |
So 298 кДж/моль* град |
Вещество |
∆Go 298 обр. кДж/моль |
So 298 кДж/моль* град |
1 |
2 |
3 |
4 |
5 |
6 |
AgBr (к) AgCl (к) AgF (к) AgNO3 (к) AlCl3 (к) AlF3 (к) Al2O3 (к) BaSo4 (к) CaSo3 (к) CaCl2 (к) CaC2 (к) CaO (к) Ca(OH)2(к) HCl (г) CuCl (к) Cu(OH)2 (к) CuSO4 (к) FeCl2 (к) FeCl3 (к) Fe(OH)2 (к) Fe(OH)3 (к) Fe(SO)4 (к) FeO (к) Fe2O3 (к) MgCl2 (к) MgO (к) Mg(OH)2 (к) MgSO4 (к) MnO (к) MnO2 (к) NH3 (г) NH4Cl (к) NH4OH (ж) HNO3 (ж) NO (г) NO2 (г) N2O3 (г) N2O5 (к) H2O (ж) H2O (г) H2O2 (г) NaBr (к) NaCl (к) |
- 97.3 - 109.8 - 188.0 - 33.6 - 629.0 - 1432.1 - 1583.3 - 136З.2 - 1128.6 - 1011.5 - 64.9 - 604.4 - 899.2 - 95.4 - 171.5 - 359.6 - 662.2 - 302,6 - 334.2 -480.1 - 700.1 - 825.5 - 244.5 - 740.8 -592.2 - 569.8 - 834.2 -1148.3 - 363.6 - 467.0 - 16,3 - 203.3 - 254.4 - 80.9 + 80.6 + 51.6 + 140.6 + 114.2 -237.4 -228.8 -105.6 - 349.5 - 384.3 |
107.2 96.2 83.7 141.0 109.4 66.5 50.9 132.3 88.8 104.7 70.0 39.8 83.4 186.9 108.2 84.0 109.3 118.1 142.4 88 105 121.0 60.8 87.5 89.7 27.0 63,2 91.4 61.6 53.2 192.8 95.9 165.7 155.7 210.7 240.3 307.3 178.4 70.0 188.8 233.0 86.9 72.2
|
NaF (к) NaNO3 (к) NaOH (к) Na2CO3 (к) NaHSO4 (к) O3 (к) PCl3 (к) PCl5 (к) PH3 (к) PbCl2 (к) PbO (к) красн. PbO (к) желт. SO2 (г) SO3 (г) H2S (к) H2SO4 (ж) SnCl2 (к) SnCl4 (ж) SnCl4 (г)
C (графит) C (алмаз) CH4 (г) C2H2 (г) C2H4 (г) C2H6 (г) C3OH (ж) C2H5OH (ж) CH3COOCH3 (ж) CCl4 (ж) CHCl3 (ж) CH3COOH (ж) |
- 543.7 - 366.1 - 380.4 - 1048.8 — + 162.8 - 272.6 — + 25 .4 - 315.6 -189.2 - 188.3 - 300.4 - 371.4 - 33.8 - 690.8 — - 458.0 - 449.9
— — - 50.8 + 208.6 + 68.4 - 33.0 - 167.2 - 174.3 -155.5 - 64.7 - 71.9 - 389.6 |
51.3 116,6 64.5 138.9 — 239.0 217.3 199.3 210.3 136.1 66.2 68.9 248.2 256.9 193.3 157.0 — 259.2 365.1
— — 186.4 200.9 219.4 229.6 126.7 161.1 200.5 214.6 203.1 159.9 |
Изменение изобарного потенциала, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому, изменение изобарного потенциала в результате реакции равноправности между суммой изобарных потенциалов образования продуктов реакции и суммой изобарных потенциалов исходных веществ.
Для реакции аА + вВ + ... = дД+ еЕ + ... изменение стандартного изобарного потенциала определяется уравнением:
∆Go = [д(∆Go обр.)Д + е(∆Go обр.)Е+…]-[а(∆Go обр.)А + в(∆Go обр.)В +…] (18)
или в общем случае:
∆Go = Ʃ∆Goобр.прод.— Ʃ∆Goобр.исходных (19)
Пользуясь значениями стандартных изобарных потенциалов образования (табл.2), можно подсчитать ∆Go многих реакций, например:
NО(г) + ½O2(г) → NО(г), ∆Go298 = ?
∆Go298 = ∆Goобр.NO2 – (∆Goобр.NO + ½∆Goобр.O2)
По значениям изменения стандартного изобарного потенциала можно определить возможность протекания реакции в стандартных условиях, а также грубо оценить. ее возможность в других условиях.
Для большинства реакций можно принять, что, если ∆Go298 < 0, то процесс принципиально осуществим не только в стандартных, но и в других реальных условиях. Если же ∆Go298 > 0, то процесс в реальных условиях не пойдет.
Энтальпийный и энтропийный факторы и направление процесса.
Уравнение (18)позволяет рассмотреть вопрос о•направленности химических процессов в зависимости от характера изменений энтальпии и энтропии.
1.Если ∆Н < 0(уменьшение энтальпии, реакция с выделением тепла ) и ∆S > 0 (увеличение энтропии и степени беспорядка), то ∆G<0. Это значит, что экзотермическая реакция с увеличением энтропии возможна при всех температурах. Процессы, протекающие с уменьшением энтальпии и увеличением энтропии, необратимы. К необратимым процессам относится, например, разложение бертолетовой соли:
КСIO3(к) → КСl(к) + 3\2O2(г)
∆Нo298 = -44,7 кДж/моль, ∆Sо298 = 247,2 Дж/град ∙ моль
В данном случае ∆Hо298 < О, а ∆Sо298 > О, следовательно, возможна лишь прямая реакция. На это же указывает и высокое отрицательное значение ∆Gо298 = -118 кДж/моль.
2. Если ∆Н > 0(увеличение энтальпии, реакция с поглощением тепла) и ∆S < 0 (уменьшение энтропии, увеличение степени порядка), то в этом случае ∆G > 0 всегда. Это значит, что эндотермическая реакция с уменьшением энтропии не возможна ни при каких температурах.
3. В остальных случаях:
знак ∆G зависит от соотношения энтальпийного ∆Н и энтропийного (Т∙∆S) факторов. Реакция будет протекать только в случае, когда ∆G < 0.
Рассмотрим две следующие реакции:
1) 2А1(к) + 3/2 O2(г) → А12O3(к)
∆Нo298 = - 1676,8 кДж/моль
∆So298 = - 313,6 Дж/град ∙ моль
∆Gо298 = -1583,3 кДж/моль
½С(графит) +| ½СО2(г) → СО(г)
∆Нo1700 = + 87 кДж/моль
∆So1700 = + 82 Дж/град ∙ моль
∆G1700 = - 52 кДж/моль
Первая реакция экзотермическая, протекает с уменьшением объема. Возможность протекания этой реакции (∆G < 0) определяется энтальпийным фактором, который перекрывает противодействие энтропийного фактора.
Вторая реакция эндотермическая, протекает с увеличением объема. Возможность протекания ее (∆G < 0), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор (стремление к разъединению частиц) перекрывает энтальпийный фактор и реакция, начавшись, далее может протекать самопроизвольно.
Большое влияние энтропийного фактора на направление процессов может быть показано на примерах процессов растворения кристаллических веществ в жидкостях. Если растворение сопровождается выделением тепла, возможность процесса (∆G < 0) определяется уменьшением Н (∆Н < 0) и увеличением S(∆S > 0), если поглощением, то возможность процесса определяется только увеличением S (∆S > 0).
Изменение температуры оказывает влияние на величину энтропийного фактора, а, следовательно, и величину ∆G, что следует из уравнения ∆G = ∆Н - Т∙ ∆S.
Влияние температуры на ∆G определяется знаком и величиной ∆S При ∆S > 0 повышение температуры будет способствовать смещению ∆G в область отрицательных значений. При ∆S < 0 повышение температуры смещает в область положительных значений.
На рис.3 показана зависимость ∆G от температуры для ряда реакций, л Afr, кДж/моль
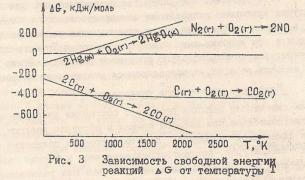
При ∆S > 0 кривые идут вниз, при ∆S < 0 - вверх. Иначе говоря, для реакций , протекающих с увеличением энтропии, например, 2С(графит) + О2(г) → 2СО(г), ∆S > 0 повышение температуры приводит к увеличению отрицательного значения ∆G. Следовательно, высокотемпературный режим благоприятствует протеканию процесса.Для реакций, протекающих с уменьшением энтропии, например, 2 Hg(ж) + О2(г) = 2HgO(кр.), ∆S < 0 с повышением температуры ∆G смещается в сторону положительных значений. Следовательно, в этом случае высокотемпературный режим препятствует протеканию процесса. При условиях, когда ∆G положительно, реакция будет протекать в обратном направлении. Как видно из рис. 3, изменение знака ∆G для рассматриваемой реакции достигается при 500°К. Следовательно, выше этой температуры реакция пойдет в обратном направлении. Для грубой оценки того, в каком направлении может протекать та или иная реакция при низких и высоких температурах, можно воспользоваться приближенными уравнениями изобарного потенциала реакции. При низких температурах множитель Т в уравнении ∆G= ∆Н - Т∙ ∆S мал и абсолютное произведение тоже мало. В этом случае для реакций, имеющих значительный тепловой эффект, ∆Н > Т∙ ∆S и вторым членом уравнения можно пренебречь. При этом получим ∆G ≈ ∆H. При достаточно высоких температурах (множитель Т велик) имеем обратное соотношение: ∆Н < Т∙ ∆S. Пренебрегая теперь первым членом в выражении изобарного потенциала, полупим ∆G ≈ - Т∙ ∆S. Эти приближенные равенства показывают, что при низких температурах критерием направления самопроизвольного протекания реакции в первом приближении может служить знак теплового эффекта реакции, а при высоких -знак изменения энтропии. То есть при низких температурах самопроизвольно протекают экзотермические реакции, при высоких – знак изменения энтропии. То есть при низких температурах самопроизвольно протекают экзотермические реакции, при высоких – реакции, сопровождающиеся увеличением энтропии.
