
Учебник Органическая химия Щеголев 2016
.pdf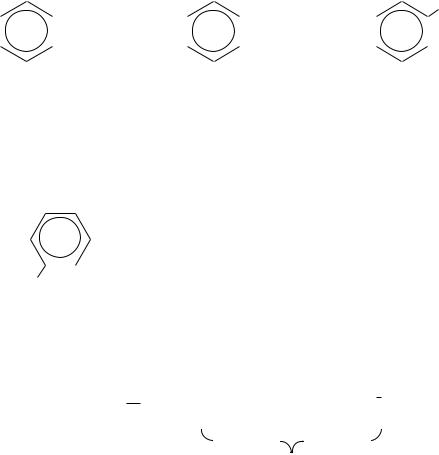

Некоторые сульфокислоты, а также некоторые производные сульфокислот имеют общеупотребительные тривиальные названия, например:
NH2 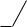
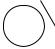
 SO3H — сульфаниловая кислота,
SO3H — сульфаниловая кислота,
H3C 
 SO2-O-R — (алкил)тозилаты (где R – алкил).
SO2-O-R — (алкил)тозилаты (где R – алкил).
10.3.2. СТРОЕНИЕ
Атом серы в сульфогруппе образует четыре - и две -связи.
-Связи образованы sp3-гибридными орбиталями, и сера, таким образом, |
|||||||
имеет тетраэдрическое строение. -Связи образованы |
|
|
|
|
|
O |
|
за счѐт d-орбиталей атома серы. |
|
|
|
|
|
||
|
|
|
|
|
O |
||
Сульфогруппа по отношению к бензольному |
|
|
|
|
|
||
|
|
||||||
|
|
|
|
|
S |
||
кольцу оказывает –I- и –M-эффекты. Сильный электро- |
|
|
|
|
|
|
|
|
|
|
|
|
|
O H |
|
|
|
|
|
|
|||
ноакцепторный индуктивный эффект вызван влиянием |
|
|
|
|
|
||
электроотрицательных атомов кислорода, с которыми связана сера. Мезомерный эффект должен быть обусловлен сопряжением -связи S=O с-электронной системой ароматического кольца. Но такое сопряжение невозможно, так как d-орбитали атома серы, участвующие в образовании - связей, непараллельны p-орбиталям атома углерода. Сопряжение возможно при перекрывании p-орбиталей атома углерода с вакантными d-орбиталями атома серы.
Результатом проявления сульфогруппой –I- и –M-эффектов является сильное понижение электронной плотности ароматического кольца, особенно в о- и п-положениях. Распределение электронов в системе вследствие проявления сульфогруппой –M-эффекта можно описать следующими граничными структурами:
H |
H |
H |
H |
H |
O |
O |
O |
O |
O |
O=S=O |
O=S O |
O=S O |
O=S O |
O=S=O |
|
+ |
|
+ |
|
+
492

Поэтому реакционная способность аренсульфокислот по отношению к электрофильным реагентам в значительной степени понижена по сравнению с незамещѐнным бензолом, причѐм вступление электрофила в молекулу сульфокислоты возможно только в мета-положение, где влияние мезомерного эффекта практически отсутствует.
Кроме того, присутствие у серы электроотрицательных атомов кислорода, связанных с ней кратными связями, сильно повышает кислотные свойства гидроксильной группы.
10.3.3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Аренсульфоновые кислоты — бесцветные кристаллические гигроскопичные вещества, растворимые в воде. Большинство производных сульфокислот являются также кристаллическими веществами (соли, амиды, эфиры), в воде растворимы амиды и хорошо растворимы соли (в том числе кальциевые и магниевые).
Химические свойства ароматических сульфокислот весьма разнообразны. Сульфогруппа — это сложная функциональная группа, поэтому возможны и реакции, протекающие по бензольному кольцу, и реакции замещения сульфогруппы, и реакции с участием самой сульфогруппы.
10.3.3.1.Электрофильное замещение атома водорода
вароматическом кольце
Аренсульфокислотам, как и любым ароматическим соединениям, должны быть свойственны реакции электрофильного замещения атома водорода в бензольном кольце. Однако за счѐт –I- и –M-эффектов электронная плотность на бензольном кольце сульфокислот сильно понижена по сравнению с незамещѐнным бензолом, и поэтому электрофильные реакции протекают, как правило, только с сильными электрофилами и в жѐстких условиях. Наиболее значительно электронная плотность понижена в о- и п-положениях (из-за действия акцепторного мезомерного эффекта). Поэтому электрофильное замещение направляется в м-положение к сульфогруппе. Например:
|
SO3H |
SO3H |
|
|
|
|
|
|
H2SO4+SO3, 333K
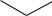
 SO3H
SO3H
С другой стороны, мета-ориентирующее действие сульфогруппы может быть объяснено и сравнением устойчивости образующихся - комплексов (гл. 10.1.2).
493
10.3.3.2. Электрофильное замещение сульфогруппы
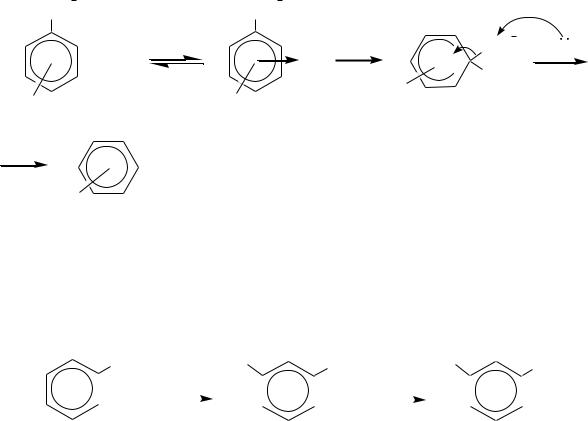
Взаимодействие с электрофилами может привести не только к замещению атома водорода в бензольном кольце, но и самой сульфогруппы. Наиболее важными такими реакциями являются замещение еѐ на водород, на нитрогруппу и на галоген.
Замещение сульфогруппы на водород — это реакция гидролиза аренсульфокислот (или десульфирования), электрофильной частицей является катион водорода. Общая схема реакции:
Ar-SO3Н + Н-OH Ar-H + H2SО4
Реакцию проводят при нагревании сульфокислот с водными растворами серной или соляной кислоты (обычно используют 60 70%-ю H2SO4 при температуре около 130 С). Сульфокислоты в присутствии воды диссоциированы, поэтому в реакцию с электрофилом вступают анионы сульфокислот:
SO3 |
|
SO3 |
|
|
|
|
|
+ |
|
+ |
|
SO3 |
H O |
+ H |
|
H |
|
|
+ |
2 |
|
|
|
|
|||
|
|
|
|
X |
H |
|
X |
|
X |
|
|
|
|
|
|
|
|
|
+ H2SO4
X
Для замещения сульфогруппы на нитрогруппу и на галоген в бензольном кольце помимо самой сульфогруппы должен быть сильный электронодонор (X). Тогда вслед за замещением атомов водорода на нитрогруппы (или на атомы галогена) может заместиться и сульфогруппа. Например:
X |
|
|
X |
|
|
X |
|
|
|||||||
|
|
SO3H |
|
O2N |
|
|
SO H |
|
O2N |
|
|
|
NO |
||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
NO2+ |
3 |
|
NO2+ |
|
|
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3H |
|
|
SO H |
|
|
NO |
2 |
|
|||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
||
При нитровании отщепление сульфогруппы будет происходить при участии молекул азотной кислоты:
494
|
NO2 |
|
NO2 |
|
|
|
||||
HO |
|
|
SO3H |
HO-NO2 |
|
|
+ |
|||
+ |
|
|
|
HO |
|
|
NO2 + H2SO4 + NO2 |
|||
|
NO2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
NO2 |
|
NO2 |
, |
||||||
а при бромировании — под действием бромид-ионов:
|
Br |
|
Br |
NH2 |
SO3H |
Br- |
Br + Br-SO3H |
+ |
NH2 |
||
|
|
|
|
|
Br |
|
|
|
Br |
|
Br |
10.3.3.3. Нуклеофильное замещение сульфогруппы в ароматическом кольце
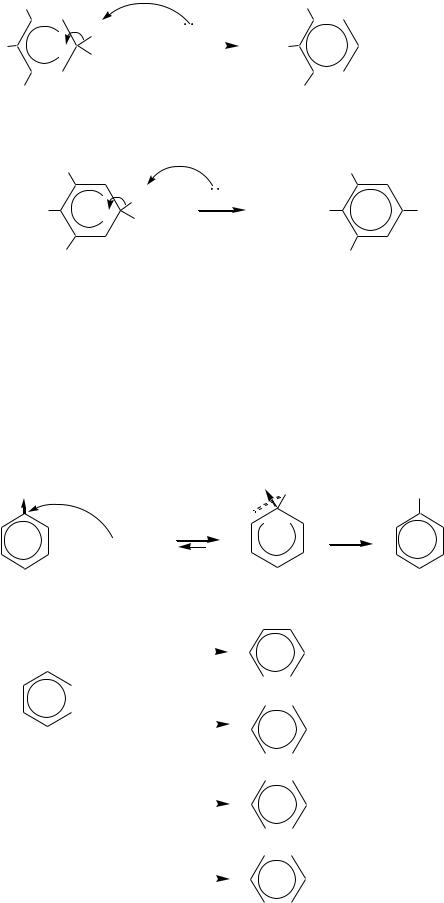
Сульфогруппа в бензольном кольце является сильным акцептором, в том числе и за счѐт индуктивного эффекта. Поэтому на атоме углерода, связанном с серой, имеется значительный положительный заряд и возможна нуклеофильная атака, как показано на схеме. Механизм реакции SN2ар, аналогично рассмотренному в главе 10.1.3.
SO3H |
HO3S Y |
Y |
|
|
|
+ :Y |
|
+ HSO3 |
Реакцию проводят при сплавлении сульфокислоты с реагентом:
|
SO3H |
|
2 NaOH |
|
|
|
|
|
|
|
|
OH |
+ Na2SO3 + H2O |
|||||||
|
|
2 NaNH2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
+ |
Na2SO3 |
+ |
NH3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||||||||
|
|
|
|
|
2 NaCN |
|
|
|
|
|
|
|
|
CN |
+ |
Na2SO3 |
+ |
HCN |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
NaSH |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
SH |
+ |
NaHSO3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
495 |
|
|
|
|
|
|
|
|
|
|
|
|
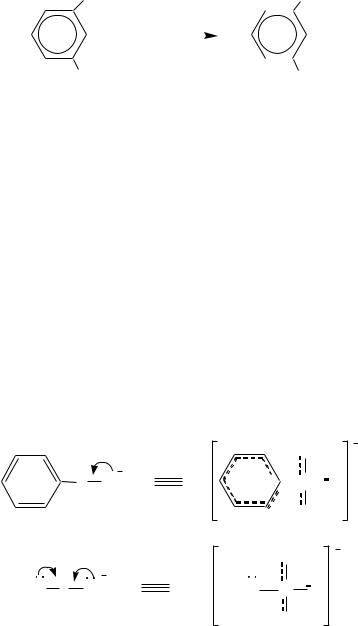
В анионе бензолсульфокислоты в делокализации отрицательного заряда принимает участие -электронная система ароматического кольца.
Электроноакцепторные заместители в ароматическом кольце бензолсульфокислоты увеличивают кислотные свойства за счѐт более полной делокализации отрицательного заряда в анионе; электронодонорные заместители, наоборот, уменьшают кислотные свойства, так как в этом случае их электронный эффект препятствует делокализации заряда аниона:
SO3 |
SO3 |
A |
D |
10.3.3.5. Нуклеофильное замещение в сульфогруппе
Нуклеофильное замещение в сульфогруппе — это замещение гидроксогруппы, и для него можно было бы привести такую схему:
O |
|
= |
|
Ar-S OH + :Y |
- |
= |
|
O |
|
Однако аренсульфокислоты не вступают в такие реакции ни со спиртами, ни с аммиаком и аминами (в отличие от карбоновых кислот).
Ar - SO2-OH |
+ |
ROH |
|
|
|
|
+ tO |
|||
|
- |
|||||||||
Ar - SO2-OH |
+ |
NH3 |
|
|
|
|||||
|
|
|
|
Ar - SO3 |
NH4 |
|
||||
|
|
|
|
|
||||||
Причинами такого отличия реакционной способности сульфокислот от карбоновых кислот являются: 1) стерический фактор — невозможность подхода нуклеофильных частиц к тетраэдрическому атому серы, окружѐнному электроотрицательными атомами кислорода; 2) высокие кислотные свойства сульфокислот, за счѐт чего легко происходит отрыв протона от сульфогруппы и присоединение его к нуклеофильной частице, но при этом она дезактивируется, и дальнейшая нуклеофильная атака становится невозможной.
Непосредственно из сульфокислот могут быть получены только галогенангидриды (сульфохлориды):
PCl5 / SOCl2
Ar-SO2-OH Ar-SO2-Cl
Реакция с участием пентахлорида фосфора начинается с атаки атомом кислорода сульфогруппы по атому фосфора катиона [PCl4]+ (вследствие ди-
497
Ar-H + SO3 Ar-SO3H
Подробно механизм сульфирования рассмотрен ранее (гл. 9.5.1.1). Сульфокислоты могут получаться и при гидролизе аренсульфохлори-
дов:
Ar-SO2Сl + H2O Ar-SO3H + HCl
Бензолсульфокислоту получают путѐм сульфирования бензола «купоросным маслом» (92 93%-я H2SO4) или моногидратом серной кислоты (98 100%-я H2SO4), которые берутся в двойном избытке (2 моля серной кислоты на 1 моль бензола). Сульфирование начинают при температуре 60 С, а заканчивают при температуре 105 С.
10.3.5. ПРОИЗВОДНЫЕ СУЛЬФОКИСЛОТ
Наиболее важные в практическом отношении производные сульфокислот — это галогенангидриды (в частности, сульфохлориды), сложные эфиры (алкилсульфонаты) и амиды.
10.3.5.1. Аренсульфохлориды
Аренсульфохлориды, или хлорангидриды аренсульфокислот могут быть получены из самих сульфокислот (гл. 10.3.3.5), при взаимодействии с PCl5, SOCl2 или некоторыми другими хлорирующими агентами.
Другим способом получения аренсульфохлоридов является прямое сульфохлорирование ароматических соединений, которое осуществляется действием избытка хлорсульфоновой кислоты ClSO3Н. Реакция протекает в две стадии: сначала образуется аренсульфокислота, которая на второй стадии подвергается хлорированию избытком хлорсульфоновой кислоты:
ClSO3 H |
ClSO3 H |
Ar-H Ar-SO3H |
Ar-SO2Cl |
Сульфохлориды в отличие от сульфокислот более активны в нуклеофильных реакциях по атому серы. Причины их высокой реакционной способности те же, что и для галогенангидридов карбоновых кислот (гл. 6.4.4),
— это незначительный эффект сопряжения атома хлора с сульфогруппой и высокая устойчивость уходящего хлорид-аниона.
В связи с малой доступностью тетраэдрического атома серы в сульфохлоридах механизм нуклеофильного замещения атома серы должен быть близок к мономолекулярному:
499






 S
S


 O
O

 O
O

 CH
CH
 O
O
 CH
CH
 CH
CH CH
CH