
Учебник Органическая химия Щеголев 2016
.pdf
Однако такая связь нереальна, так как она вдвое длиннее обычной -связи. Поэтому в граничных структурах Дьюара (III, IV, V) рz-электроны с противоположными спинами этих углеродных атомов обозначены точками ( ).
Все пять граничных структур как бы накладываются друг на друга (резонируют), что и определяет делокализацию -электронов. Принцип резонанса требует, чтобы граничные структуры отличались только распределением электронов при сохранении атомного скелета. Все пять структур представляют правильные шестиугольники. Однако структуры Кекуле и Дьюара обладают разной энергией и потому имеют разный вклад в истинную структуру молекулы бензола. Структуры, дающие наибольший вклад и имеющие наименьшую энергию, называются основными структурами. В данном случае это структуры Кекуле, вклад каждой из них составляет 39%; тогда как вклад каждой структуры Дьюара 7.3%.
В молекуле бензола порядок связи С–С, рассчитанный по методу валентных связей, составляет 1.463. Структура Кекуле не отражает истинного строения, а является лишь одной из предельных структур. Поэтому наряду с формулой Кекуле бензол может быть изображѐн следующим образом:
6
Энергия истинной молекулы бензола, обладающей ароматическим секстетом, меньше, чем энергия гипотетической молекулы циклогексатриена с тремя изолированными связями. Энергия делокализации -электронов бен-
зола называется энергией резонанса или мезомерии.
Эмпирическая энергия резонанса — это разность энергий гипотетического циклогекс-1,3,5-триена и истинной молекулы бензола с делокализованными -связями, она составляет:
ER = EЦГТ – EБенз 151 кДж/моль
Циклическая полиеновая система только тогда становится ароматической, когда для неѐ выполняются следующие условия: 1) молекула должна иметь плоское строение, то есть все атомы цикла должны находиться в sp2- гибридном состоянии, 2) необходимо наличие непрерывного (циклического) сопряжения, условием которого является строгая параллельность рz- орбиталей, расположенных друг от друга на одном межатомном расстоянии, 3) соблюдение правила Хюккеля.
Если в молекуле не соблюдается хотя бы одно условие, соединение не является ароматическим и проявляет свойства, типичные для алкенов. Так, в циклооктатетраене наблюдается чередование ординарных и двойных связей
431
и возможно циклическое сопряжение. Но это соединение не проявляет ароматических свойств, по крайней мере, по той причине, что если углеродные атомы этой молекулы были бы
расположены в вершинах правильного восьмиугольника, то углы между связями С–С–С составляли бы 135 , что вызвало
бы большое угловое напряжение. В неплоской конформации восемь рz- орбиталей не могут находиться в одной плоскости, и поэтому они не параллельны. В этом случае эффективного перекрывания рz-орбиталей не происходит и делокализация электронного облака становится невозможной. К тому же в циклооктатетраене не соблюдается правило Хюккеля.
9.2. НОМЕНКЛАТУРА И ИЗОМЕРИЯ АРЕНОВ
Первыми представителями ароматических углеводородов, кроме самого бензола, являются его метил- и диметилзамещѐнные, тривиальные названия которых — толуол и ксилолы. При этом для всех дизамещѐнных бензолов возможно существование трѐх структурных изомеров в зависимости от положения заместителей в бензольном кольце: орто-, мета- и пара- производные (сокращѐнно о-, м- и п-) или соответственно 1,2-, 1,3- и 1,4- замещѐнные бензолы
CH3 |
CH3 |
CH3 |
CH3 |
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
CH3 |
толуол |
о-ксилол |
м-ксилол |
п-ксилол |
Этим трѐм ксилолам изомерен ещѐ и этилбензол.
Основой названия по заместительной номенклатуре ИЮПАК является бензол, поэтому названия метил- и диметилзамещѐнных бензолов должны быть: метилбензол, 1,2-диметилбензол, 1,3-диметилбензол и 1,4-диметил- бензол соответственно.
Среди других алкилбензолов, имеющих широко распространѐнные тривиальные названия, необходимо отметить следующие:
CH3 - CH - CH3 |
|
|
CH3 |
|
|
|
CH=CH2 |
||||
CH3 |
|
|
CH3 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
кумол |
|
мезитилен |
|
стирол |
||||||
(изопропилбензол) |
(1,3,5-триметилбензол) |
(винилбензол) |
|||||||||
|
|
|
|
432 |
|
|
|
|
|
|
|
Другим вариантом названия аренов по заместительной номенклатуре является выделение в качестве родоначальной структуры боковой алкильной цепи, особенно если она сложна, разветвлѐнна, содержит кратные связи. Таким образом, стирол (см. выше) должен быть назван фенилэтен. Другие примеры:
|
CH3 |
|
|
CH-C-CH3 |
— 2,2-диметил-3-фенилбутан, |
|
|
|
CH3 CH3 |
|
|
CH=CH-CH=CH2 |
— 1-фенилбут-1,3-диен. |
|
Углеводородные радикалы, образованные от аренов, носят общее название арилы (Ar). Наиболее простые из них часто имеют тривиальные названия:
|
|
CH3 |
CH3 |
CH3 |
|
|
|
||
|
CH2 |
|
|
|
фенил |
бензил |
о-толил |
м-толил |
п-толил |
Названия двухвалентных остатков:

 CH
CH
бензилиден |
о-фенилен |
м-фенилен |
п-фенилен |
Кроме структурной изомерии, для аренов, содержащих двойные связи в боковой цепи, может быть характерна и геометрическая. Оптическая изомерия за счѐт асимметричных атомов углерода в боковых цепях аналогична алканам.
9.3. СТРОЕНИЕ АРЕНОВ
Взаимодействие алкильных заместителей в молекулах алкилбензолов с электронной системой ароматического кольца описывается при помощи теории электронных смещений (гл. 1.4). Возникающие при этом индуктивный и мезомерный эффекты насыщенных алкильных заместителей зависят от дли-
433

ны и разветвлѐнности углеродной цепи. При этом большое значение имеет разветвлѐнность -углеродного атома (т. е. атома углерода боковой цепи, связанного с бензольным кольцом). Здесь будут наблюдаться определѐнные различия во взаимодействии с бензольным кольцом заместителей, представленных первичным, вторичным и третичным углеводородными радикалами:
|
|
R" |
CH2-R |
CH-R |
C-R |
|
R' |
R' |
В частности, в представленном ряду алкилбензолов число -водородных атомов уменьшается от 2 до 0. Соответственно уменьшается и эффект сопряжения -связи C–H ( -углеродного атома) с -электронной системой бензольного кольца ( - -сопряжение или сверхсопряжение). В свою очередь индуктивный эффект заместителей в этом ряду алкилбензолов несколько увеличивается. Более подробно влияние алкильных групп на распределение электронной плотности в бензольном кольце рассмотрим на примере строения толуола и винилбензола.
9.3.1.СТРОЕНИЕ ТОЛУОЛА
Вмолекуле толуола электронная плотность -связей смещена от атома углерода метильной группы в сторону бензольного кольца из-за большей
электроотрицательности sp2-гибридизованного атома углерода |
|
CH3 |
|
по сравнению с sp3-гибридизованным. Поэтому индуктивный |
|
||
|
|
|
|
эффект CH3-группы как заместителя направлен в сторону ароматического кольца и является донорным (+I-эффект).
Однако повышение электронной плотности на бензольном кольце вследствие влияния метильной группы происходит не
только за счѐт индуктивного, но и мезомерного эффекта, так как -связи C–H метильной группы могут участвовать в - -сопряжении с -электронной системой бензольного кольца). При этом распределение электронов можно представить как промежуточное между пятью граничными структурами:
H |
H |
H |
H |
C |
H |
H |
C |
H |
H |
C |
H |
+ |
H H |
H |
|
C |
|
|
+ |
|
+ |
|
H |
C |
|
||||
|
|
|
|
|
H |
|
|
H |
- |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
434

В результате такого сопряжения образуется единая семицентровая -моле- кулярная орбиталь, на которой расположено 8 -электронов. Этому состоянию соответствует мезоформула
H H
C H+
H+
- 

 -
-
- ,
в которой отрицательный заряд сосредоточен в наибольшей степени в орто- и пара-положениях, как это следует из граничных структур. Другими словами, в результате взаимодействия СН3-группы с бензольным кольцом электронная плотность на нѐм повышается, причѐм главным образом в орто- и пара-положениях.
Результатом сверхсопряжения является также:
упрочнение С–С-связи между метильной группой и бензольным кольцом (за счѐт перекрывания взаимодействующих орбиталей);
повышение полярности С–Н-связи в метильной группе и, как следствие, возрастание еѐ кислотных свойств (это видно из рассмотрения граничных
структур толуола).
Однако необходимо иметь в виду, что оба донорных эффекта (индуктивный и мезомерный) достаточно слабые, повышение электронной плотности на ароматическом кольце невелико и не столь ярко выражено, как могло быть при наличии других функциональных групп, обладающих значительным донорным эффектом (см. далее в соответствующих главах).
При обсуждении геометрического строения толуола необходимо иметь
в виду, что атом углерода метильной группы боковой |
|
|
H |
|
|
|
|
|
|
цепи имеет тетраэдрическое строение в отличие от угле- |
|
|
C |
|
|
|
|||
родных атомов бензольного кольца. Однако валентные |
|
|
|
|
|
|
|
HH |
|
|
|
|||
углы ССН отличаются от таковых в молекуле метана. |
|
|
||
9.3.2.СТРОЕНИЕ ВИНИЛБЕНЗОЛА
Вмолекуле винилбензола углеводородный заместитель, представляющий систему с -связью, взаимодействует с -электронным секстетом ароматического кольца посредством, прежде всего, мезомерного эффекта: в дан-
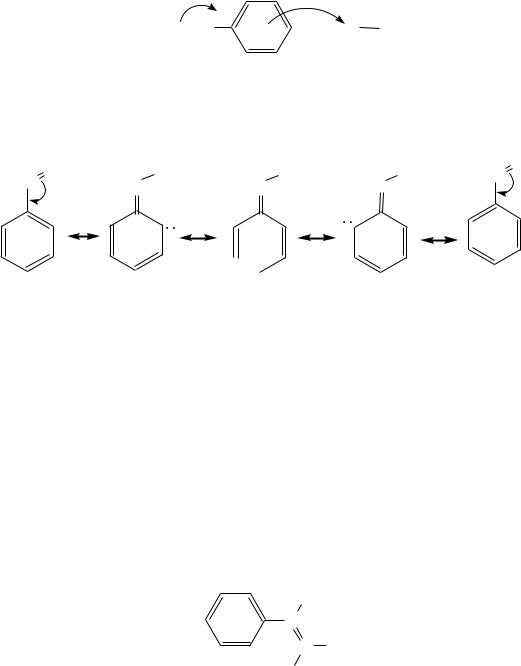
ном случае наблюдается неполярное - -сопряжение. Вследствие высокой подвижности -электронной плотности молекула винилбензола легко поляризуема и под действием катионов или полярных молекул облака электронов сильно смещаются в сторону поляризующего агента:
435
|
1 |
+ |
|
H2C=CH |
X |
Y |
Следовательно, можно изобразить граничные структуры, полученные при смещении таким образом электронной плотности от винильного радикала к бензольному кольцу
|
CH2 |
|
+ |
|
+ |
|
+ |
|
CH2 |
CH |
HC |
CH2 |
|
CH2 |
|
CH2 |
CH |
||
HC |
HC |
|
|||||||
|
|
|
|
|
|
||||
|
|
|
- |
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
 -
-
Граничные структуры, полученные при обратной поляризации (например, при взаимодействии винилбензола с отрицательно заряженными ионами), значительно менее вероятны, поэтому здесь не приводятся.
Индуктивный эффект заместителя в этой молекуле не наблюдается, так как смещение -электронов С –С1-связи, вызванное различием электроотрицательностей атомов углерода, не происходит — все углеродные атомы находятся в sp2-гибридном состоянии.
Геометрия винилбензола определяется валентным состоянием углеродных атомов и наличием - -сопряжения. В связи с этим все атомы данной молекулы лежат в одной плоскости. Оси восьми р-орбиталей, входящих в сопряжѐнную систему, перпендикулярны этой плоскости. Все валентные углы близки к 120 :
H
C
C H
H
В молекуле винилбензола, так же, как и в молекуле толуола и других замещѐнных бензолов, нет строгой выравненности длин и порядков связей в ароматическом кольце.
9.4. ФИЗИЧЕСКИЕ СВОЙСТВА
Бензол и большинство алкилбензолов — жидкости, незначительно растворимые в воде, но хорошо растворимые в неполярных органических рас-
436

творителях. Температура плавления в большой степени определяется симметрией молекулы. Например, п-ксилол плавится при более высокой температуре (13 С), чем его о- и м-изомеры (-29 С и -53 С соответственно), что определяется более плотной упаковкой в кристалле последнего. Температуры кипения увеличиваются по мере увеличения молекулярных масс.
Алкилбензолы — малополярные соединения; причѐм дипольный момент симметричных соединений близок нулю, а большинства несимметричных — лежит в пределах от 0.4 до 0.6 D.
9.5. ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства бензола и его алкилзамещѐнных должны определяться, с одной стороны, возможностью протекания реакций по ароматическому кольцу, а с другой стороны — способностью к взаимодействиям, связанным с наличием боковых углеводородных цепей.
9.5.1. ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
Для бензола, обладающего устойчивой циклической -электронной системой, должны быть характерны в первую очередь реакции с электрофилами, но не реакции присоединения, как это характерно для этиленовых и полиеновых систем, а реакции замещения с сохранением устойчивой ароматической системы кольца.
Среди других реакций бензола можно отметить реакции присоединения, окисления и изомеризации. Но они менее характерны и протекают в жѐстких условиях и/или с низким выходом.
9.5.1.1. Реакции электрофильного замещения
Для незамещѐнного бензола характерны прежде всего наиболее типичные SE-реакции: нитрование, сульфирование, галогенирование, алкилирование и ацилирование.
Механизм реакции электрофильного замещения атома водорода в бензольном кольце включает несколько стадий:
1) образование -комплекса за счѐт взаимодействия -электронной системы бензола с вакантными (или частично вакантными) орбиталями электрофильной частицы
+ E + |
E + |
|
437 |
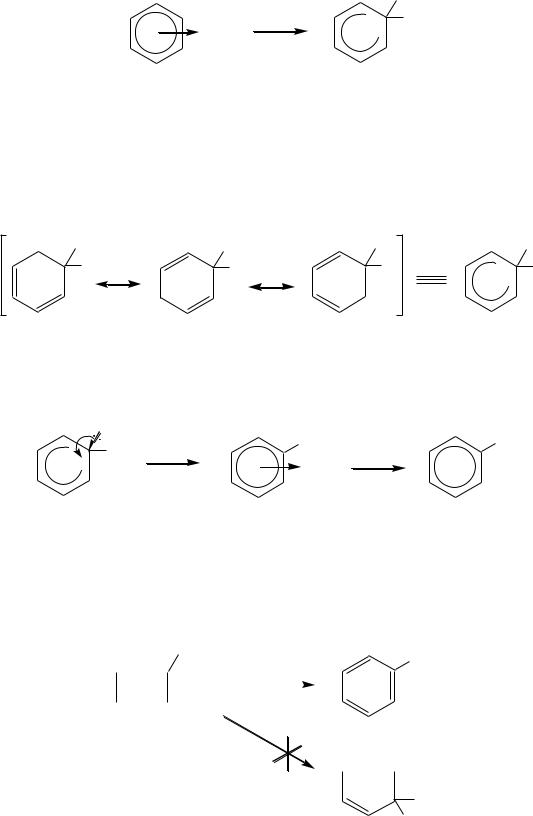
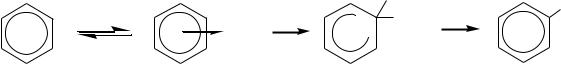
Таким образом, в большинстве случаев (реакции нитрования, галогенирования, алкилирования и ацилирования) самой медленной стадией является стадия образования -комплекса, который быстро превращается в продукт электрофильного замещения. Однако в случае сульфирования лимитирующей стадией является отщепление протона. Это можно считать одной из причин обратимости реакции сульфирования.
Рассмотрим частные случаи этих реакций.
Нитрование
Механизм реакции нитрования бензола можно представить следующим образом:
+ |
|
H |
|
NO2 |
|
|
|
||
+ NO2 |
+ |
|
NO |
|
|
NO2 |
+ |
2 |
+ |
|
|
|||
|
|
|
|
|
|
|
|
- H |
|
|
-комплекс |
-комплекс |
|
нитробензол |
Для нитрования бензола используются концентрированная азотная кислота или смеси азотной и серной кислот различных концентраций (нитрующие смеси).
Необходимая для реакции нитрования электрофильная частица, нитро- ний-катион NO2+, образуется по одной из возможных схем. В концентрированной азотной кислоте:
3 HNO3 NO2+ + H3O+ + 2 NO3
В смеси концентрированных азотной и серной кислот:
HNO3 + 2 H2SO4 NO2+ + H3O+ + 2 HSO4¯
Вместо серной кислоты могут быть использованы фтороводородная, селеновая или хлорная кислоты.
Для получения нитробензола используют нитрующую смесь в количестве, соответствующем 0.97 1.01 моля азотной кислоты на 1 моль бензола. Нитрование протекает гладко при 50 С. При нитровании азотной кислотой (без серной) концентрация азотной кислоты должна быть около 60%.
Добавление воды к нитрующей смеси и уменьшение доли серной кислоты приводит к уменьшению скорости реакции. При содержании в нитрующей смеси 90% серной кислоты и 10% азотной кислоты степень превращения HNO3 в NO2+ составляет 100%, а в чистой азотной кислоте эта вели-
чина — 1.2%.
439
Сульфирование
Сульфирование — это реакция введения в молекулу органического соединения сульфогруппы, протекающая по схеме:
|
|
|
|
|
|
|
SO3H |
+ H2SO4 |
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
бензолсульфокислота |
||
Электрофильными частицами реакции сульфирования могут быть катион
H3SO4+ или полисерные кислоты H2S2O7, H2S3O10, H2S4O13 и т.д., хлорсульфоновая кислота ClSO3H, а также триоксид серы (серный ангидрид) SO3 и его
комплексы с электронодонором (например, с диоксаном, с пиридином – гл. 3.4.4, 12.2.3.2, 12.4.3.1).
Катион H3SO4+ образуется в серной кислоте концентрации около 80% по схеме:
2 H2SO4 H3SO4+ + HSO4
В водном растворе с концентрацией серной кислоты существенно ниже 80% сульфирующая частица не образуется вследствие того, что кислота практически полностью диссоциирована:
H2SO4 + H2O H3O+ + HSO4 ,
поэтому разбавленная кислота не сульфирует.
При более высокой концентрации серной кислоты в интервале 85 98% основной сульфирующей частицей является дисерная кислота H2S2O7, которая образуется по схеме:
3 H2SO4 H2S2O7 + H3O+ + HSO4
В 100%-й серной кислоте и в олеуме (раствор SO3 в H2SO4) сульфирование происходит H2S2O7, другими полисерными кислотами и несвязанным в комплекс SO3. Сульфирование с участием SO3 протекает также при использовании его растворов в SO2 или в CH2Cl2. (Описание механизма сульфирования с участием катиона HSO3+ является достаточно условным. Этот катион можно представить как протонированную молекулу SO3 или как катионную часть дисерной кислоты H2S2O7 = [HSO3]+ [HSO4] .)
Механизм реакции с участием катиона H3SO4+ можно представить следующим образом:
440

 E
E +
+
 E
E