
Учебник Органическая химия Щеголев 2016
.pdf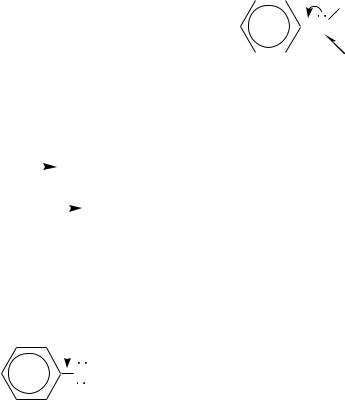
Взаимодействие ароматических аминов с солями диазония будет рассмотрено далее, в свойствах диазосоединений.
10.6.3.2. Кислотно-оснόвные свойства
Для аминов в целом (и ароматических, и алифатических) характерны слабые кислотные свойства. Это NH-кислоты, и поэтому отщепление катиона водорода происходит труднее, чем в случае OH-кислот, из-за меньшей электроотрицательности атома азота по сравнению с кислородом.
В молекулах ароматических аминов по причине р- -сопряжения и сильного смещения электронной плотности с атома азота на бензольное
кольцо N–H-связь более полярна, чем в алифатических |
|
|
|
H |
|
||||
аминах. Поэтому кислотность ароматических аминов |
|
|
|
N |
несколько выше, однако она остаѐтся достаточно низ- |
|
|
|
|
|
|
|
|
|
кой, и кислотные свойства проявляются только по отно- |
|
|
|
H |
шению к таким реагентам, как активные металлы, металлорганические соединения или же металлические производные аммиака и алифатических аминов. Например:
Ar-NH |
+ Li |
|
|
|
|
|
|
|
1 |
|
|
||||
|
|
|
|
[Ar-NH] |
|
Li + + |
H |
2 |
|||||||
|
|
|
|
2 |
|||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
+ |
|
|
+ |
|
|
|
||||||
|
|
|
|
|
|
||||||||||
Ar-NH2 + |
NH2 Na |
|
|
|
[Ar-NH] Na |
+ |
NH3 |
||||||||
|
|
|
|||||||||||||
Бóльшую кислотность ароматических аминов по сравнению с алифатическими можно объяснить также устойчивостью образующегося аниона, в котором отрицательный заряд делокализован с участием -электронной системы бензольного кольца:
 -
-
NH
Оснóвные свойства у ароматических аминов, наоборот, слабее выражены, чем у алифатических аналогов. Причина этого та же, что и в случае кислотных свойств: участие неподелѐнной электронной пары атома азота в сопряжении с -электронной системой бензольного кольца и, как следствие, пониженная электронная плотность на атоме азота по сравнению с аммиаком и алифатическими аминами. Так, значение константы основности для метиламина CH3NH2 примерно в 107 раз выше константы основности анилина: рКb метиламина равно 2.3, анилина — 9.4 (для сравнения: рКb аммиака равно
4.8).
Таким образом, ароматические амины дают соли только с сильными кислотами, например:
551

Ar-NH2 + H2SO4 [Ar-NH3]+ HSO4
Однако такие соли, являющиеся солями сильных кислот и слабых оснований, легко гидролизуются.
Введение заместителей в ароматическое кольцо влияет на оснóвные свойства ароматических аминов. Электроноакцепторные заместители за счѐт более полной делокализации неподелѐнной электронной пары атома азота ещѐ сильнее уменьшают оснóвные свойства, а электронодонорные заместители, наоборот, повышают основность ароматических аминов, так как в этом случае их электронный эффект препятствует делокализации неподелѐнной пары электронов азота. Особенно сильно такое влияние проявляется в орто- и пара-положениях бензольного кольца.
NH2 |
NH2 |
A |
D |
10.6.3.3. Нуклеофильные свойства
Ароматические амины, как и алифатические, могут проявлять нуклеофильные свойства за счѐт атома азота. Однако по сравнению с алифатическими аминами у них нуклеофильность будет понижена вследствие сопряжения, так же как и понижены оснóвные свойства. Тем не менее, аналогично алифатическим аминам анилин и его производные вступают в реакции алкилирования, ацилирования, взаимодействия с азотистой кислотой, в изонитрильную реакцию. Кроме того, для ароматических аминов протекают реакции арилирования и образования оснований Шиффа*.
Алкилирование. В данной реакции субстратами могут являться галогеналканы, диалкилсульфаты, п-толуолсульфонаты, реже — спирты. Во всех случаях это типичная реакция нуклеофильного замещения у насыщенного атома углерода, механизм которой приведѐн в главе 3.1.1. Различия наблюдаются только в природе уходящей группы. Например, для метилирования можно использовать метилйодид, диметилсульфат или метил-п-толуол- сульфонат в щелочной среде, как показано в этих некоторых схемах:
|
|
|
|
|
|
OH |
- |
|
|
|
|
|
|
|
|
|
|
|
|||
Ar-NH2 + |
CH3 |
|
I |
|
|
|
- |
Ar-NH-CH3 |
|
. . . |
|
|
|||||||||
|
- H2O, - I |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
Ar-NH-CH3 |
|
. . . |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Ar-NH2 + CH3 |
|
O-SO2- |
|
|
|
|
|
CH3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
- H2O, |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
552 |
|
- CH3C6H4SO3 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Алкилирование обычно идѐт дальше с образованием смеси вторичных, третичных аминов и солей четвертичного аммония.
В случаях алкилирования спиртами реакцию проводят в газовой фазе в присутствии кислот. При этом обычно получаются третичные амины:
Ar-NH2 + 2ROH |
HCl, p, to |
+ 2H2O |
Ar-NR2 |
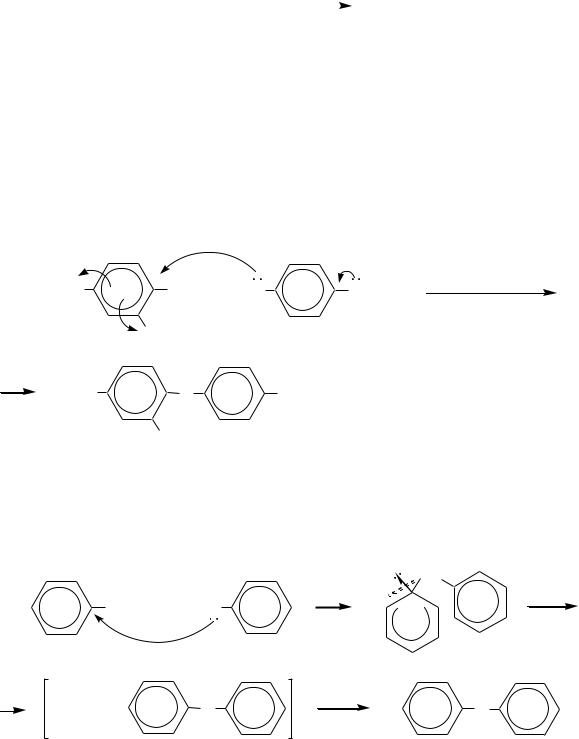
Арилирование. Эти реакции должны протекать в более жѐстких условиях, чем реакции алкилирования, так как предполагается замещение галогена в ароматическом кольце, а это означает протекание реакции по ариновому механизму (или механизму SN2аром, если субстрат активирован). Однако достаточно легко реакции могут протекать в тех случаях, когда в ароматическом кольце амина имеются электронодонорные заместители (в орто- и пара- положениях), повышающие его нуклеофильность, а в молекуле арилгалогенида (также в орто- и пара-положениях) — электроноакцепторные группы. Например:
O2N |
|
Cl + H2N |
OCH3 |
351K (C2H5OH) |
|
||||
|
- HCl |
|||
|
|
|
|
|
|
NO2 |
|
|
|
O2N |
|
N |
OCH3 |
|
|
|
H |
|
|
|
NO2 |
|
|
|
При нагревании до 230 С анилина с его солянокислой солью получают дифениламин. Эта реакция становится возможной за счѐт наличия в субстрате очень сильного электроноакцептора аммонийной группы:
|
|
|
|
+ |
+ |
|
|
|
|
H3N |
NH |
+ |
+ |
|
|
|
2 |
|
t |
o |
|
||
|
|
|
|
||
|
NH3 + |
H2N |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
NH3 |
+ |
+H |
|
|
N |
N |
-NH+4 |
||||
|
|
H |
H |
||
553
Ацилирование. Реакции ацилирования ароматических аминов — это реакции взаимодействия этих соединений с карбоновыми кислотами и их производными, являющимися ацильными агентами. Такие реакции производных карбоновых кислот рассматривались в главе 6.4.4.2. В данном случае ацилирование проводят ангидридами, хлорангидридами кислот и самими карбоновыми кислотами, продуктами при этом являются N-ариламиды:
|
O |
|
O |
||
|
= |
|
|
|
|
Ar-NH2 + |
C-R |
|
Ar-NH-C-R |
||
- HX |
|||||
|
|
|
|
||
|
X |
|
|
|
|
В целом ацилирование ариламинов протекает медленнее, чем ацилирование алифатических аминов.
Взаимодействие аминов с хлорангидридами аренсульфокислот — реакции, аналогичные ацилированию. Действие арилсульфохлоридов на первичные, вторичные и третичные амины приводит к разным продуктам. Так, первичные и вторичные амины легко образуют сульфамиды, третичные — в реакцию не вступают:
Ar-NH2 + Cl-SO2- |
|
|
|
|
|
CH |
3 |
|
Ar-NH-SO - |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
2 |
3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar-NH-R + Cl-SO2- |
|
|
|
CH |
|
|
Ar-N-SO - |
|
|
|
CH |
|
|
|
|
|
|
|
|||||||
|
3 |
|
|
2 |
3 |
|||||||
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
При этом аренсульфамид, полученный из первичного амина, обладает ярко выраженной NH-кислотностью и потому растворяется в водных растворах щелочей:
Ar-NH-SO2- |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
Ar-N-SO2- |
|
|
|
CH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
3 |
|
-H2O |
|
|
|
3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
А сульфамид, образованный из вторичного амина и не содержащий атомов водорода в амидной группе, в щелочах не растворяется. Такое различное отношение первичных, вторичных и третичных аминов к аренсульфохлоридам лежит в основе разделения смеси аминов — проба Хинсберга (гл. 10.3.5.3).
Образование оснований Шиффа. Первичные ароматические амины при взаимодействии с ароматическими альдегидами образуют основания Шиффа
(называемые также анилами, или шиффовыми основаниями):
554

|
O |
|
|
|
OH |
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
Ar-NH2 + |
C-Ar' |
|
|
|
Ar-NH-C-Ar' |
|
|
|
Ar-N=CH-Ar' |
|
|
|
|
||||||
|
|
- H2O |
|||||||
|
H |
|
|
|
H |
|
|
||
|
|
|
|
|
|
|
|
||
Механизм реакции нуклеофильного присоединения аминов к карбонильным соединениям рассмотрен в главе 6.1.4.1. Образующиеся в общем случае при таком присоединении азометины малоустойчивы и могут гидролизоваться с образованием исходных веществ, в данном случае шиффовы основания стабилизированы сопряжением -электронных систем двух ароматических колец и -связи между этими кольцами ( - - -сопряжение). Поэтому такие соединения устойчивы к щелочам, но могут гидролизоваться в кислой среде.
В биохимических процессах образование оснований Шиффа играет существенную роль. Например, через их образование осуществляется биосинтез аминокислоты триптофана, осуществляется связывание ретиналя с белком опсином — механизм зрения, а также и другие процессы.
Взаимодействие с азотистой кислотой. Как и для алифатических аминов, взаимодействие ариламинов с азотистой кислотой приводит к разным продуктам для первичных, вторичных и третичных аминов, поэтому данную реакцию можно использовать для различия этих аминов. Механизм нитрозирования аминов с участием азотистой кислоты подробно рассмотрен в главах 3.7.3.5 и 10.7.2. При этом из первичных аминов образуются соли арендиазония:
|
O |
+ |
|
|
|
|
+ |
+ |
|
|
|||
|
= |
|
|
|
|
|
H |
|
|
||||
Ar-NH2 + |
N |
|
|
Ar- |
NH-N-O |
|
|
. . . |
-HX |
Ar-N |
|
N |
|
|
|
|
|
|
|||||||||
|
|
|
|||||||||||
|
X |
|
H X |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
-H2O |
, |
||||||
|
|
|
|
|
|
|
|
|
|
||||
из вторичных аминов — N-нитрозамины:
|
O |
+ |
|
|
|
|
|
|
|
||||
|
= |
|
|
|
|
|
|
|
|
||||
Ar-NHR + |
|
|
Ar-NR-N-O |
|
|
|
|
Ar-N-N=O |
|
||||
N |
|
|
|
-HX |
|
||||||||
|
|
|
|
|
|
H X |
|
|
|
|
|||
|
X |
|
|
|
|
R |
, |
||||||
|
|
|
|
|
|
|
|
||||||
а из третичных аминов — п-нитрозосоединения:
R |
|
|
|
O |
|
|
|
|
N |
= |
|
H2N |
NO |
||
R |
|
+ N |
|
-HX |
|||
|
|
X |
|
|
. |
||
|
|
|
|
|
|
||
Однако реакция нитрозирования третичных аминов — это проявление нуклеофильных свойств за счѐт ароматического кольца, и по отношению к ами-
555

ну данная реакция является электрофильным замещением атома водорода в ароматическом кольце.
Изонитрильная реакция. Как и алифатические амины, первичные ароматические амины дают изонитрильную реакцию (гл. 3.7.3.6), заключающуюся во взаимодействии аминов с хлороформом в присутствии щѐлочи:
|
|
|
|
|
|
|
+ |
|
|
- |
Ar-NH2 |
+ CHCl3 |
OH |
|
|
||||||
|
|
|
|
|
Ar-N |
|
C |
|
||
- H2O |
|
|
||||||||
|
|
|||||||||
|
|
|
|
|
|
|||||
|
|
- Cl |
|
|
|
|
|
|
||
Протекание реакции сопровождается неприятным запахом образующегося карбиламина (арилизоцианида), поэтому первичные амины могут быть обнаружены с помощью этой реакции.
10.6.3.4. Окисление
При взаимодействии ариламинов с сильными окислителями (например, NaOCl, CrO3) происходит отрыв электрона и образование катион-радикалов, которые далее превращаются в красители:
Ar-NH2 |
[O] / X- |
+ |
- |
|
[Ar-NH2] X |
||
- e- |
Аминогруппу также можно окислить до нитрозогруппы, применяя пероксисерную кислоту (кислоту Каро) H2SO5, и до нитрогруппы — трифторпероксиуксусной кислотой CF3COOOH, азотной кислотой или перманганатом калия:
Ar-NH2 |
[O] |
Ar-N=O |
|
[O] |
Ar-NO |
|
|
|
|||
|
|
|
|
|
2 |
Данную реакцию можно использовать как способ получения нитрозоили нитросоединений соответственно.
10.6.4. СПОСОБЫ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ АМИНОВ
Существует несколько способов получения первичных, вторичных и третичных ароматических аминов. Бóльшая часть этих способов рассматривалась ранее в свойствах соответствующих классов соединений.
Первичные амины могут быть получены следующими способами.
1.Восстановление нитросоединений (гл. 10.4.3.3);
2.Аминирование арилгалогенидов (гл. 10.2.4.2). Этим же способом могут быть получены вторичные и третичные амины, если в качестве нуклеофильного агента вместо аммиака в реакции использовать амины (первичные или вторичные);
556

3. Перегруппировка амидов по Гофману (гл. 6.4.4.5).
Для получения вторичных и третичных аминов используются также:
4.Реакции алкилирования и арилирования первичных аминов (гл.
10.6.3.3);
5.Восстановление оснований Шиффа:
Ar-N=CH-Ar' [H] Ar-NH-CH2-Ar'
Ar-NH-CH2-Ar'
10.6.5. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ АРОМАТИЧЕСКИХ АМИНОВ
Анилин — бесцветная жидкость со своеобразным запахом; температура плавления -6 С; малорастворим в воде.
В промышленности анилин получают главным образом каталитическим восстановлением нитробензола водородом над NiS Al2O3 или
Al2O3 или
Cu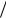 SiO2 .
SiO2 .
Его применяют для получения полиуретанов, производных бензотиазола (ускорителей вулканизации), для синтеза антиоксидантов, красителей, лекарственных веществ.
N,N-Диметиланилин — бесцветная жидкость со своеобразным запахом; температура плавления 2.5 С, кипения — 193 С; малорастворим в воде.
Его получают алкилированием анилина метанолом в присутствии серной кислоты. Используют для синтеза красителей и взрывчатых веществ.
Сульфаниловая кислота (п-аминобензолсульфоновая кислота) — белое кристаллическое вещество; температура разложения 180 С; малорастворима в воде.
Еѐ получают сульфированием анилина серной кислотой. Применяется в синтезе азокрасителей.
Важное практическое значение имеет амид сульфаниловой кислоты (сульфаниламид)
H2N |
SO2-NH2 |
|
, |
производные которого являются эффективными антибактериальными средствами для лечения инфекционных заболеваний.
10.6.6.ПРОДУКТЫ НЕПОЛНОГО ВОССТАНОВЛЕНИЯ НИТРОСОЕДИНЕНИЙ
Кпроизводным ароматических аминов и одновременно к производным нитросоединений могут быть отнесены такие классы веществ, как нитрозоа-
557

|
+ |
+ |
. |
HN NH |
H2N |
NH2 |
+NH2 |
|
+2H+ |
|
2 |
|
|
|
+ |
+ |
|
|
|
NH2 |
NH |
|
|
|
|
2 |
|
|
|
|
2 OH |
- |
H2N |
NH2 |
|
-2H2O |
|||
|
|
|
||
H |
H |
|
|
|
|
|
|
|
бензидин |
Как установлено, в ходе протекания этой реакции катион-радикалы не образуются, а осуществляется внутримолекулярная перегруппировка.
В общем случае, для гидразоаренов, если заняты п-положения, протекает семидиновая (неполная) перегруппировка:
N |
N |
R |
H+ |
HN |
R |
H2N |
|||||
H |
H |
|
|
|
|
или
|
|
|
|
|
R' |
|
R' |
N |
N |
R |
H |
+ |
R |
|
HN |
|||||
|
H |
H |
|
|
|
|
|
|
|
|
|
NH2 |
|
10.6.6.4. Азобензол и азоксибензол
Азобензол существует в виде двух геометрических изомеров:
N N |
to |
|
N N |
|
h |
560

 O O
O O N
N
 N
N +
+ Ar-NO
Ar-NO
 N
N  N
N 
 NH
NH