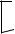Учебник Органическая химия Щеголев 2016
.pdf
+ |
|
H |
OH |
|
SO3H |
||
+ |
|
S O H |
|||||
+ H3SO4 |
|
|
|||||
H3SO4 |
+ |
+ |
|||||
|
|
OH |
|
||||
|
|
|
|
|
|
||
|
|
|
O |
|
-H3O |
|
|
|
|
|
|
|
|
||
|
-комплекс |
|
-комплекс |
бензолсульфокислота |
|||
а при сульфировании дисерной кислотой —
|
OH |
H |
OH |
|
SO3H |
|
|
|
|
|
|||
+ H2S2O7 |
S |
O |
+ |
S O |
|
+ |
|
|
- |
|
|
|
|
|
|
|
|
-H |
|
|
|
|
O-SO3H -HSO4 |
|
O |
|
|
|
O |
|
|
|
||
|
|
|
|
|
|
|
При этом отрыв протона в последнем случае происходит либо гидросульфатионом HSO4 , либо молекулой серной кислоты (в зависимости от содержания в среде воды). При сульфировании с участием SO3 механизм можно представить в следующем виде:
|
O |
|
|
H |
O- |
|
+ SO3 |
|
|
S |
O H + |
||
S |
O |
+ |
||||
|
|
|
||||
|
|
|
|
|
||
|
O |
|
|
O |
|
|
|
|
|
|
|
|
H OH |
|
SO3H |
|
|
H2SO4 |
|
|
S O |
+ |
|
+ |
|
+ H3SO4 |
|
|
|
||
|
O |
|
|
Существенным отличием реакции сульфирования от других реакций электрофильного замещения является еѐ обратимость, хотя и некоторые другие SE-реакции могут протекать в обратном направлении. Причины обратимости сульфирования связаны с возможностью электрофильного замещения сульфогруппы на атом водорода — гл. 10.3.3.2.
Побочными реакциями в процессах сульфирования могут быть: 1) образование сульфонов (в избытке субстрата)
SO3H |
SO2 |
+H2SO4 |
+ C6H6 |
- H2O |
- H2O |
|
дифенилсульфон |
2)окисление субстрата (серной кислотой или олеумом);
3)реакция десульфирования, то есть гидролиз арилсульфокислот — протекание реакции, обратной сульфированию
441

SO3H
+H2O
- H2SO4
Галогенирование
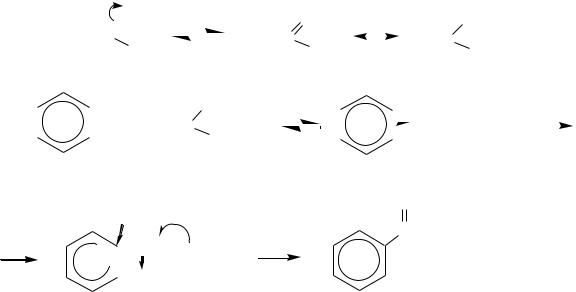
Из всех реакций галогенирования наиболее широко используются хлорирование, бромирование и йодирование, причѐм наиболее активно протекает хлорирование. Прямое фторирование практически не используется вследствие очень высокого теплового эффекта реакции, и фторозамещенные бензолы получают косвенным путѐм.
Хлорирование и бромирование ароматических соединений в ядро представляет собой типичную реакцию электрофильного замещения, но протекающую в достаточно жѐстких условиях и поэтому требующую применения катализаторов. В качестве последних часто используют кислоты Льюиса, такие как галогениды железа (III), цинка и алюминия. Активность металлического железа, например, используемого в качестве катализатора, объясняется наличием в среде хлорида или бромида железа (III):
Fe + Cl2 FeCl3
Катализирующее действие кислот Льюиса может быть представлено следующей схемой:
FeCl3 + Cl2 FeCl4 + Cl+,
но так как хлороний-катион Cl+ не выделен, то принято считать, что образуется комплекс
Cl . . . Cl ־. . . FeCl3 ,
который и является хлорирующим агентом. Поэтому механизм реакции можно представить в следующем виде:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
+ Cl . . . Cl . . . FeCl3 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl . . . Cl . . . FeCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-комплекс |
|
|||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
+ HCl + FeCl3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
+ |
|
|
|
|
|
|
|
FeCl4 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-комплекс |
|
|
|
|
хлорбензол |
|
|||||||||||||||
442

|
CH |
|
CH3 |
||
+ |
3 |
|
|
|
|
|
|
|
+C-CH2-CH3 |
||
CH2-C-CH3 |
|
|
|||
|
|
||||
|
|
|
|||
|
CH3 |
|
CH3 |
||
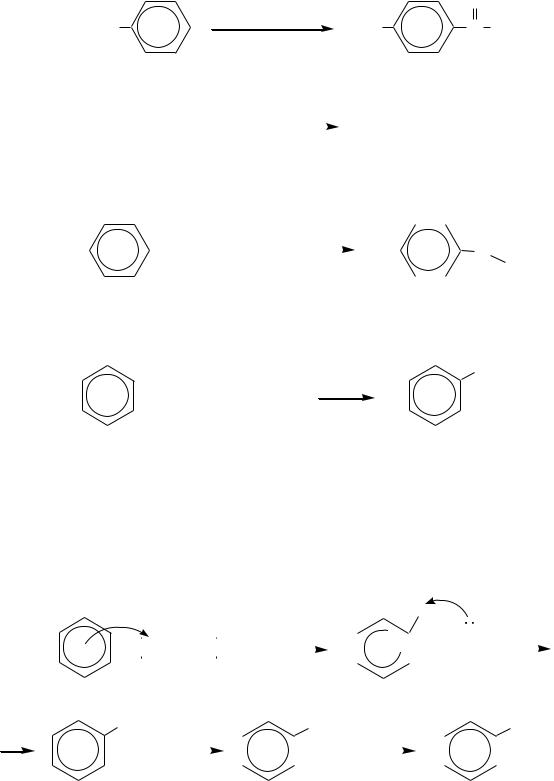
Однако если в качестве катализатора используется FeCl3, то основным продуктом является неопентилбензол, образующийся из неизомеризованного иона.
Следует иметь в виду, что реакцию алкилирования трудно остановить на стадии моноалкилирования, образуются ди- и полиалкилпроизводные. Это объясняется тем, что продукты моноалкилирования, алкилбензолы, вступают в эту реакцию легче, чем сам бензол (см. далее, в главе 9.5.2.1). Поэтому для получения моноалкилбензолов обычно используют избыток бензола.
В некоторых случаях реакции алкилирования могут быть обратимы. Это выражается в возможности электрофильного замещения алкильной группы на другую функциональную группу (например, при реакциях нитрования ароматических соединений). Однако такие случаи достаточно редки (гл. 10.5.3.3), причѐм замещаемая алкильная группа должна быть пространственно доступна, а уходящий алкильный катион должен быть достаточно стабильным.
9.5.1.2. Реакции присоединения Гидрирование
В отличие от алкенов бензол присоединяет водород в жѐстких условиях при высокой температуре (100 200 С) и давлении (3 10 МПа) с использованием в качестве катализатора пористого никеля (так называемого никеля Ренея), при этом происходит разрушение ароматической системы и исчерпывающее гидрирование всего соединения.
+ H2 |
|
|
|
|
|
+ H2 |
|
|
|
|
|
|
+ H2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В реакции каталитического гидрирования молекулярным кислородом удаѐтся выделить только конечный продукт — циклогексан. Выделить промежуточные продукты (циклогексадиен, циклогексен) не удаѐтся, так как они гидрируются быстрее, чем бензол. Это обусловлено тем, что поглощение первого моля водорода протекает со значительно бóльшими энергетическими затратами из-за необходимости нарушения ароматического секстета, тогда как остальные два моля водорода присоединяются почти мгновенно с выделением энергии.
446
Однако восстановлением по Бѐрчу* можно получить циклогекс-1,4- диен. Это восстановление щелочными металлами (обычно натрием), растворѐнными в жидком аммиаке (или амине), в присутствии спирта. Механизм реакции включает образование на первой стадии анион-радикала, который затем селективно протонируется в том месте, где электронная плотность наиболее высокая:
|
|
|
|
H- |
H- |
|
|
|
|
|
|
. |
|
ROH |
|
+ |
. Na |
|
|
|
|
||
-Na |
+ |
|
|
-RO |
- |
||
|
|
|
|
|
|||
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
H H |
|
H |
H |
H |
H |
|
|
|
. Na |
|
|
ROH |
|
|
|
. |
-Na+ |
|
- |
-RO- |
|
|
|
|
|
|
|
|
|
||
|
|
H |
H |
H |
|
|
|
|
|
|
|
|
|
||
циклогекс-1,4-диен
Присоединение хлора
Хлор присоединяется к бензолу только при интенсивном облучении светом. Присоединяются сразу три моля хлора:
|
|
H |
Cl H |
H |
||||
|
|
|
||||||
+ 3 Cl2 |
h |
Cl |
|
|
|
|
Cl |
|
|
|
|
||||||
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
Cl |
ClH |
|
Cl |
|||
|
|
|
|
|
|
|||
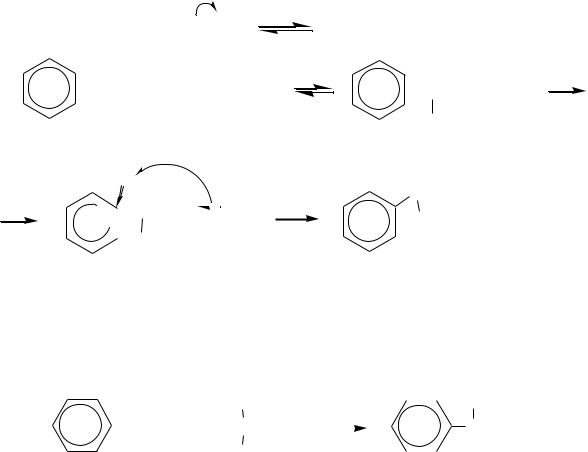
Реакция имеет радикальный механизм (АR), при этом образуется несколько геометрических изомеров, соответствующих приведѐнной структуре, один из них — гексахлоран, обладающий сильными инсектицидными свойствами.
В эту реакцию не вступают производные бензола. Присоединение хлора характерно только для незамещѐнного бензольного кольца.
9.5.1.3. Фотохимическая изомеризация
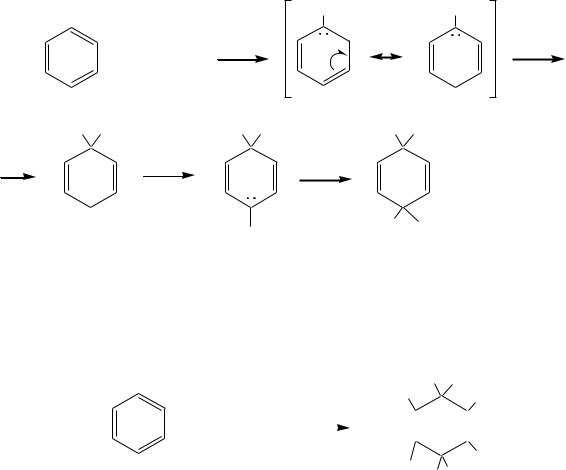
При ультрафиолетовом облучении бензол изомеризуется, теряя ароматические свойства и превращаясь в бензвален, дьюаровский бензол, призман и фульвен. Все эти углеводороды очень неустойчивы и легко переходят обратно в бензол.
447
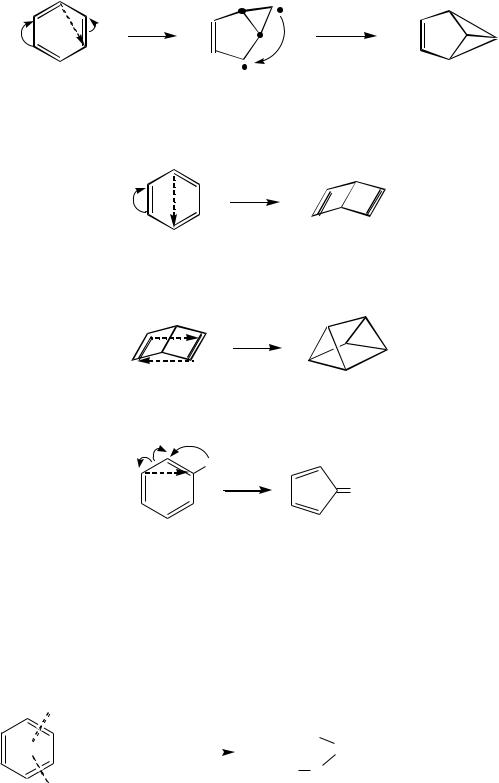
Бензвален (или бензол Хюккеля) образуется с выходом 1% при длительном облучении жидкого бензола светом длиной волны 254 нм:
h
бензвален
Бензол Дьюара получают при быстром облучении бензола светом длиной волны 206 нм:
h
бензол Дьюара
Призман (бензол Ладенбурга*) — продукт внутримолекулярного циклоприсоединения бензола Дьюара:
h
призман
Образование фульвена можно представить следующим образом:
H |
|
h |
CH2 |
|
|
|
фульвен |
9.5.1.4. Реакции окисления
Бензол устойчив к окислителям при комнатной температуре. При действии на бензол кислорода воздуха в присутствии оксида ванадия (V) при температуре 400 С происходит разрушение бензольного кольца с образованием малеинового ангидрида. В этой реакции бензол проявляет свойства непредельных углеводородов:
|
|
|
|
|
|
|
O |
|
|
|
|
= |
|
||||
|
|
V2O5 |
CH |
|
|
C |
O + 2 CO |
|
|
|
|
|
|
||||
+ 4,5 O2 |
|
= |
|
|
|
+ 2 H O |
||
|
|
|
|
|
||||
|
|
|
CH |
C |
2 |
2 |
||
|
|
|
= |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
Это промышленный способ получения малеинового ангидрида.
448
9.5.2. ХИМИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Для углеводородов, содержащих в бензольном цикле алкильные заместители, химическое поведение определяется наличием как одного, так и другого структурного фрагмента. Как показано в химических свойствах бензола, для ароматического цикла характерны реакции электрофильного замещения (SE). С другой стороны, предельные или непредельные алифатические заместители проявляют свойства соответствующих предельных и непредельных углеводородов.
9.5.2.1. Реакции электрофильного замещения
Для алкилбензолов характерны те же электрофильные реакции, что и для незамещѐнного бензола. Это, прежде всего нитрование, сульфирование, галогенирование, алкилирование и ацилирование. Продуктами этих реакций могут быть различные функциональные производные аренов, в связи с чем такие реакции могут использоваться как способы получения разнообразных ароматических соединений.
Однако при рассмотрении реакций электрофильного замещения необходимо иметь в виду, что, так как алкильные группы обладают электронодонорными эффектами по отношению к бензольному кольцу, то взаимодействие таких соединений с электрофилами будет протекать легче, чем незамещѐнного бензола. Это выражается в возрастании скорости реакции и замещении, как правило, не одного, а нескольких водородных атомов кольца. Кроме того, следует иметь в виду, что в молекулах алкилбензолов электронная плотность распределена неравномерно по бензольному кольцу. Поэтому подвергаться электрофильной атаке будут атомы углерода кольца с повышенной электронной плотностью.
|
R |
|
|
|
|
|
R |
|
|
|
|
|
|
R |
H |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
+ E |
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
+ |
|
|
. . . |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
-комплекс |
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
E |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-комплекс |
|
|
|
|
|
|
||||||
Если в реакцию вступает моноалкилзамещѐнный бензол, то в результате электрофильного замещения образуются о- и п-дизамещѐнные бензолы, а при протекании реакции до конца — продукт исчерпывающего замещения:
450

 CH-CH
CH-CH H
H O
O O
O