
Учебник Органическая химия Щеголев 2016
.pdf
Однако этот способ нельзя применять, используя в качестве исходных галогенозамещѐнный бензол и алкилмагния галогенид из-за низкой реакционной способности галогенобензолов (гл. 10.2.4.2).
8. Алкилирование бензола и его гомологов (алкилирование по Фриде- лю–Крафтсу) — эти реакции рассмотрены в химических свойствах (гл. 9.5.1.1, 9.5.2.1). Для алкилирования могут использоваться галогеналканы, спирты, алкены.
9. Восстановление арилкетонов
O |
[H] |
|
|
C-R |
CH2-R |
||
|
,
проводимое активными металлами (Mg, Zn) в кислой среде. Карбонильные соединения, в свою очередь, для этих целей обычно получают ацилированием бензола и его гомологов.
9.7. ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ АРЕНОВ
Жидкие ароматические углеводороды при контакте со слизистыми оболочками вызывают местное раздражение и оказывают сосудорасширяющее действие. Обладая сродством к тканям с высоким содержанием липидов, ароматические углеводороды при остром воздействии поражают главным образом центральную нервную систему, вызывая наркотический эффект вплоть до комы и остановки дыхания вследствие паралича дыхательного центра. В условиях хронической интоксикации бензол и его гомологи оказывают на организм политропное действие, поражая ряд органов и систем. Особое место занимает бензол, обладающий выраженным миелотоксическим эффектом. Хроническая бензольная интоксикация характеризуется в основном поражением крови и кроветворных органов и в меньшей степени — нервной системы.
При окислении ароматических углеводородов в результате ароматического гидроксилирования образуются фенолы. Первой стадией этой реакции окисления также является образование эпоксидов:
OH |
OH |
O |
+ |
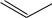
 OH
OH
461
Для ароматических углеводородов в процессе гидроксилирования характерна структурная избирательность, зависящая от свойств субстрата. Так, при метаболизме толуола образуются только о- и п-крезолы:
|
HO |
|
|
H3C |
H3C |
+ H3C |
OH |
|
о-крезол |
п-крезол |
|
Бензол — бесцветная жидкость со своеобразным запахом и температурой кипения 81 С. Легче воды и малорастворим в воде.
Используется в качестве растворителя: растворяет жиры, масла, нефтепродукты, полимеры. Главным источником бензола являются продукты сухой перегонки каменного угля. Бензол служит исходным сырьѐм для химической промышленности.
Толуол — бесцветная жидкость со своеобразным запахом и температурой кипения 111 С. Незначительно растворим в воде. Его получают из продуктов сухой перегонки каменного угля и в процессе дегидрирования гептана.
Толуол применяется в качестве растворителя в переработке пластмасс, в производстве лаков, типографских красок, резины и в качестве компонента для высокооктановых бензинов.
Ксилолы (орто-, мета-, пара-) — бесцветные жидкости со своеобразным запахом. Незначительно растворимы в воде. Смесь ксилолов получают из продуктов сухой перегонки каменного угля, а также в процессе дегидрирования октанов. Смесь изомеров разделяют на чистые ксилолы различными методами.
Смесь ксилолов используют в качестве растворителя в лакокрасочной промышленности и в качестве компонента высокооктановых бензинов. Нитрованием ксилолов получают исходное сырьѐ для производства красителей. В химической промышленности широко используют о- и п-изомеры для получения соответствующих карбоновых кислот.
Кумол — бесцветная жидкость со своеобразным запахом и температурой кипения 153 С. Незначительно растворим в воде. Получают алкилированием бензола пропеном.
Кумол является важным промежуточным продуктом для получения фенола и ацетона.
Стирол (винилбензол) — бесцветная жидкость с приятным запахом, легче воды; температура кипения 145 С. При комнатной температуре самопроизвольно полимеризуется в отсутствие катализатора с образованием полистирола — прекрасного электроизоляционного материала. Его также используют для получения ионообменных смол.
462
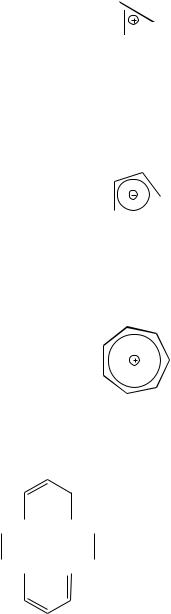
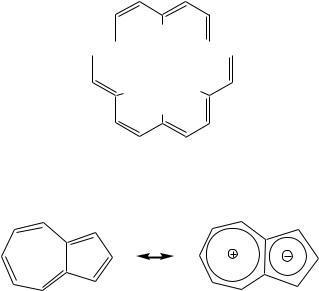
у которого в циклическом сопряжении четырнадцать рz-орбиталей, число-электронов — тоже 14, что соответствует правилу Хюккеля (4n+2) при n = 3;
[18]-аннулен
H
 H H
H H 
H H
H
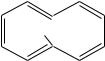
азулен — конденсированная система, состоящая из циклопентадиена и циклогептатриена
,
здесь в каждом из циклов в сопряжении 6 -электронов.
Главной особенностью циклических замкнутых сопряжѐнных систем является их стабильность, что определяется циклической делокализацией-электронов. Поэтому наиболее точно такие системы могут быть охарактеризованы энергией делокализации (энергией резонанса). Например, для азулена она равна 189 кДж/моль — это довольно большая величина, но по сравнению с бензолом азулен менее стабилен: в пересчѐте на один-электрон энергия резонанса азулена составляет 19 кДж, а бензола —
25 кДж.
Ароматический циклопропенилий-катион оказывается более устойчивым, чем его ациклический аналог аллил-катион +СН2-СН=СН2.
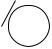
Стабильность [14]-аннулена относительно невелика ввиду внутримолекулярного отталкивания атомов водорода внутри цикла, что делает молекулу непланарной. Его аналог [10]-аннулен, согласно правилу Э. Хюккеля, должен быть ароматичен, если бы он был плоский. Все изомерные циклодекапентаены имеют значительное напряжение, которое препятствует образованию плоской конформации. Даже в наиболее стабильном из них транс- цис-транс-цис-цис-изомере с минимальным угловым напряжением имеет место сильное отталкивание между внутренними атомами водорода (трансаннулярное напряжение), что делает его неплоским:
464
H  H
H
транс-цис-транс-цис-цис-[10]-аннулен
Другие геометрические изомеры дестабилизированы угловым напряжением и не являются плоскими. В результате ни один из изомерных [10]- аннуленов не является ароматическим углеводородом. Отсутствие ароматичности здесь является следствием неплоской структуры, а не отклонением от правила Хюккеля.
В настоящее время получены и существуют [14]-аннулен и [18]- аннулены, соли замещѐнного циклопропенилия (например, перхлорат 1,2,3- три-трет-бутилциклопропенилия), соли тропилия (например, бромид тропилия), циклопентадиениды щелочных металлов и др.
Кроме того, в структуру ароматических циклов помимо атомов углерода могут входить гетероатомы. Эти соединения рассматриваются в главе 12.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Как вы понимаете термин «ароматичность» и какими физическими и химическими свойствами можете подтвердить ароматические свойства бензола и его производных?
2.Перечислите все электрофильные частицы и сравните их активность в реакциях а) нитрования, б) сульфирования, в) галогенирования, г) ацилирования, д) алкилирования.
3.Сравните свойства, проявляемые гомологами бензола по ароматическому кольцу и по алифатической цепи. В чѐм заключается их принципиальное отличие?
4.Сравните свойства, проявляемые аренами с непредельными боковыми цепями по ароматическому кольцу и по алифатической цепи. В чѐм можно найти сходство, а в чѐм заключается отличие?
5.Из бензола и изопропилхлорида в присутствии хлорида алюминия получите монозамещѐнный гомолог бензола. Приведите механизм этой реакции. Для полученного алкилбензола приведите схемы превращений при а)
окислении KMnO4, б) бромировании в присутствии железа, в) бромировании при нагревании на свету.
6.Из бензола получите этилбензол, используя в качестве реагента 1) этилен, 2) этанол. Для одного из взятых реагентов (1) или (2) рассмотрите механизм реакции. Для этилбензола напишите схемы реакций: а) окисления, б) сульфирования, в) бромирования в условиях радикального замещения.
7.Какие углеводороды получатся при алкилировании толуола пропиловым
465
спиртом в присутствии серной кислоты? Объясните, почему группа -СН3 обладает активирующим действием и является преимущественно орто- и пара-ориентантом. Для одного из диалкилзамещѐнных бензола приведите схему окисления перманганатом калия.
8.Приведите механизм алкилирования толуола изобутилхлоридом в присутствии хлорида алюминия. Какое соединение будет основным продуктом этой реакции?
9.Какое превращение будет протекать при нагревании изобутилбензола на
хлориде алюминия при 200 С? Приведите его механизм и поясните. 10.Установите в каждом случае структуру исходного ароматического угле-
водорода, если при его озонолизе была получена смесь карбонильных соединений следующего состава (в скобках указаны их мольные соотношения): а) бутандион, 2-оксопропаналь, этандиаль (1:2:3); б) бутандион, 2-оксопропаналь, этандиаль (1:4:1); в) пентан-2,3-дион, 2-оксобутаналь, этандиаль (1:1:1); г) 2-оксопропандиаль, 2,3-диоксобутаналь, 2-оксо- пропаналь, этандиаль, этаналь (1:1:1:3:2).
466

Глава 10. ПРОИЗВОДНЫЕ БЕНЗОЛА
В бензольном кольце в качестве заместителей могут быть самые разные атомы и атомные группировки. Такими заместителями могут быть атомы галогенов (-F, -Cl, -Br, -I), сульфо- (-SO3H), нитро- (-NO2), аминогруппы (-NH2), гидроксильная и алкоксильная группы (-OH, -OR), карбонильная и карбоксильная группы (-COR, -COOH) и другие.
Общую формулу монозамещѐнных бензолов можно представить в следующем виде:
 X
X
Однако в общем случае молекулы ароматических соединений могут содержать характеристические группы как в ароматическом кольце, так и в боковой алифатической цепи. Такие вещества, проявляющие свойства и ароматических соединений, и алифатических производных, также здесь будут рассмотрены.
10.1. ОБЩНОСТЬ СТРОЕНИЯ И СВОЙСТВ МОНОЗАМЕЩЁННЫХ БЕНЗОЛОВ
Заместители в бензольном кольце в соответствии со своей природой оказывают как электронное, так и пространственное влияние на строение всего соединения в целом и на его химическое поведение. Поэтому в распределении электронной плотности в молекулах монозамещѐнных бензолов и в реакционной способности этих веществ можно отметить много общего.
10.1.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Индуктивные эффекты таких заместителей, как галогены, аминогруппа, гидроксильная и другие группы, будут действовать в направлении понижения электронной плотности ароматической системы, поскольку атомы, непосредственно связанные с кольцом, более электроотрицательны, чем углерод, с которым они связаны:
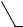
 X
X
467
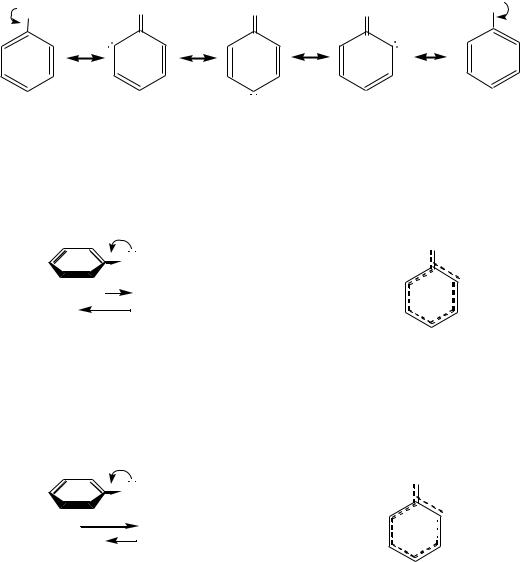
С другой стороны, непосредственно связанные с кольцом атомы галогенов, кислорода или азота, содержат неподелѐнные пары электронов, которые могут взаимодействовать с делокализованными -электронами кольца, в результате чего возникает сопряжение -электронной системы ароматического фрагмента с р-орбиталью первого атома заместителя. Это можно показать при помощи резонансных структур:
:X |
+X |
+X |
+X |
X: |
|
- |
|
|
- |
|
|
|
|
|
|
|
- |
|
|
Для заместителей -OH, -OR, -NH2, -NR2 и т.д. величина электронодонорного мезомерного эффекта больше (по модулю) значения акцепторного индуктивного эффекта. Электронная плотность на кольце при этом возрастает. Такие
заместители являются в целом электронодонорами.
|
|
|
X '+ |
|
X |
|
- |
- |
|
-I |
+M > -I |
|||
|
|
|||
+M |
|
|
- |
|
|
|
|
Атомы галогенов, проявляющие такие же по направлению индуктивный и мезомерный эффекты по отношению к бензольному кольцу, напротив, являются в целом электроноакцепторами за счѐт бóльшего (по модулю) индуктивного эффекта по сравнению с мезомерным:
Hal -
Hal
-I |
+M < -I |
|
|
||
|
||
|
|
|
|
|
|
|
|
|
|
|
+M
Причины такого влияния атомов галогенов на бензольное кольцо изложены далее (гл. 10.2.2).
Однако если атом в заместителе, непосредственно соединѐнный с кольцом, связан кратной связью с ещѐ более электроотрицательным атомом, возникает сопряжение, приводящее к уменьшению электронной плотности кольца:
468
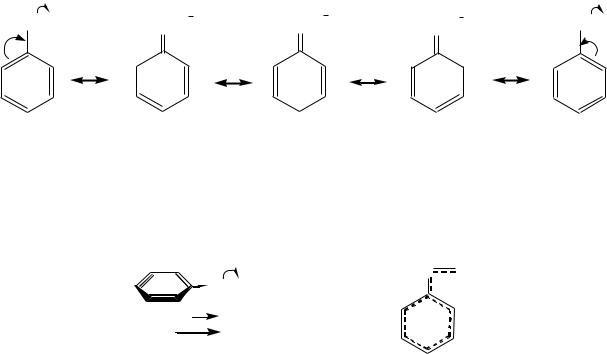
X=Y |
X-Y |
X-Y |
X-Y |
X=Y |
|
+ |
|
|
+ |
+
Это характерно для таких заместителей, как например -СHO, -COOH, -SO3H, -CN, -NO2. Индуктивный эффект, проявляемый этими заместителями,
— тоже акцепторный. Такие заместители являются в целом электроно-
акцепторами. Электронная плотность на кольце понижается:
|
X |
'- |
X=Y |
Y |
|
|
|
|
-I |
|
|
|
|
|
-M |
|
|
|
|
|
Таким образом, все заместители в бензольном кольце условно можно разделить на две большие группы: электронодоноры и электроноакцепторы.
Кроме перечисленных здесь к донорным заместителям относятся и алкильные радикалы в молекулах аренов. Но величина суммарного донорного эффекта (индуктивный эффект и эффект сверхсопряжения, как, например, в толуоле) невелика по сравнению с электронодонорным мезомерным эффектом, обусловленным р- -сопряжением таких групп, как например -OH, -NH2.
Таким образом, в порядке уменьшения суммарного электронного эффекта электронодоноры можно расположить в следующий ряд (приведены некоторые, наиболее типичные заместители):
-NH2 (-NHR, -NR2) > -OH (-OR) > -NHCOR > -R
Электроноакцепторные заместители также по-разному влияют на ароматическое кольцо, уменьшая электронную плотность на нѐм в разной степени. По силе акцепторного влияния такие заместители в бензольном кольце можно выстроить в следующий ряд:
-NR3+ > -NO2 > -CN > -SO3H > -CHO > -CRO > -COOH > -COOR > -CONH2
У галогенов, как акцепторных заместителей, имеются свои особенности влияния на распределение электронной плотности бензольного кольца, и в общий ряд акцепторов поэтому они не включены.
469

Относительную силу влияния заместителей можно ориентировочно определить по величине дипольного момента ароматического соединения, содержащего этот заместитель (табл. 10.1).
Таблица 10.1
Направление и величины дипольных моментов некоторых монозамещѐнных бензолов
Заместитель |
Дипольный |
Направление |
|||||
X |
момент , D |
|
диполя |
||||
-N(СH3)2 |
1.6 |
|
|
|
|
|
|
|
|
|
|
|
|
||
-OH |
1.6 |
|
|
|
|
X |
|
-NH2 |
1.5 |
|
|
|
|
||
|
|
|
|
|
|
||
-OCH3 |
1.2 |
|
|
|
|
|
|
-CH3 |
0.3 |
|
|
|
|
|
|
H |
0 |
|
|
|
|
|
|
-COOH |
1.0 |
|
|
|
|
|
|
-I |
1.3 |
|
|
|
|
|
|
-Br |
1.5 |
|
|
|
|
|
|
-Cl |
1.6 |
|
|
|
|
|
X |
-COOR |
1.9 |
|
|
|
|
||
|
|
|
|
|
|
||
-CHO |
2.8 |
|
|
|
|
|
|
|
|
|
|
|
|
||
-SO3H |
3.8 |
|
|
|
|
|
|
-CN |
3.9 |
|
|
|
|
|
|
-NO2 |
4.0 |
|
|
|
|
|
|
Для всех ароматических соединений должны быть характерны реак-
ции электрофильного замещения (SE). Заместители, обладающие донор-
ными или акцепторными электронными эффектами разной силы, могут облегчать взаимодействие с электрофилами или, наоборот, затруднять его, влияя, таким образом, на скорость реакции, а также на условия еѐ протекания и полноту превращения.
Кроме того, наличие в бензольном кольце акцепторных заместителей может привести к понижению электронной плотности на атомах углерода настолько, что становятся возможными и реакции нуклеофильного замещения (SN).
10.1.2. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
Взаимодействие монозамещѐнного бензола с электрофильной частицей должно протекать по механизму, рассмотренному на примере бензола
470

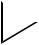 ,
, ,
, H H
H H 
 H H
H H