
Учебник Органическая химия Щеголев 2016
.pdf
Однако вследствие влияния большего по величине индуктивного эффекта электронная плотность на кольце в целом понижена; в наибольшей степени она оказывается понижена в мета-положении, так как в орто- и па- ра-положениях происходит частичная компенсация дефицита электронной плотности за счѐт +М-эффекта. Поэтому в целом распределение электронной плотности в молекуле хлорбензола можно представить следующим образом:
Cl "'-
-I
"+ 



 "+
"+
+ |
|
+ |
|
'+ |
|
+M |
, причѐм + > '+, "+ |
В молекулах других галогенобензолов взаимодействие ароматического кольца с атомами галогенов осуществляется за счѐт тех же электронных эффектов: индуктивного и мезомерного. Однако существенного повышения или понижения электронной плотности на ароматическом кольце этих галогенопроизводных (в ряду фторбензол—йодбензол) не наблюдается, так как одновременно с уменьшением –I-эффекта атома галогена (от фтора к йоду) происходит и уменьшение +М-эффекта. Уменьшение индуктивного эффекта связано с понижением электроотрицательности в ряду галогенов (фтор— йод); уменьшение электронодонорного мезомерного эффекта связано с возрастанием несоответствия геометрической конфигурации внешних р-орби- талей атомов углерода и галогена (также от фтора к йоду).
10.2.3. ФИЗИЧЕСКИЕ СВОЙСТВА
Среди галогенопроизводных ароматических углеводородов преобладающее большинство — жидкости. Температуры кипения зависят от природы галогена и увеличиваются от фторопроизводных к йодопроизводным, так как с увеличением геометрических размеров молекул и их поляризуемости возрастают силы сцепления между молекулами. Плотность галогенопроизводных больше 1 г/мл и при увеличении числа атомов галогена в кольце заметно увеличивается. Все галогенопроизводные, как правило, нерастворимы в воде, но растворяются в органических растворителях. Соединения с атомом галогена в -положении боковой цепи обладают сильным слезоточивым запахом.
481
10.2.4. ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства рассматриваемых соединений должны определяться, с одной стороны, возможностью протекания реакций по ароматическому кольцу (как для любых замещѐнных бензолов), а с другой стороны — способностью к взаимодействиям с участием атома галогена.
10.2.4.1. Электрофильное замещение в ароматическом кольце арилгалогенидов
За счѐт электроноакцепторного индуктивного эффекта галогена электронная плотность на бензольном кольце понижена по сравнению с незамещѐнным бензолом, и поэтому электрофильные реакции затруднены. Реакции нитрования, сульфирования и галогенирования протекают в более жѐстких условиях и с меньшей скоростью, чем для бензола.
Атомы галогенов в этих реакциях ориентируют вступающие группы в о- и п-положения, что обусловлено проявлением этими атомами +М-эффекта по отношению к бензольному кольцу, который усиливается благодаря временной поляризации молекулы субстрата при приближении электрофила:
Cl |
E+ |
|
Поэтому механизм взаимодействия хлорбензола с электрофильной частицей можно представить следующим образом:
Cl |
|
Cl |
|
Cl |
H |
Cl |
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
+ E |
+ |
E |
+ |
+ |
|
E |
|
|
|
- H + |
|||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
- H + |
|
|
|
|
|
|
|
|
|
|
H |
E |
|
E |
|
|
|
|
|
|
Примеры реакций электрофильного замещения в молекуле хлорбензола:
482
|
Cl |
Cl |
|
|
HNO3/H2SO4 |
NO2 |
|
Cl |
+ |
||
- H2O |
|||
|
|
||
|
NO2 |
|
|
|
Cl |
Cl |
|
|
H2SO4+SO3 |
SO3H |
|
|
+ |
||
|
|
||
|
SO3H |
|
|
|
Cl |
Cl |
|
|
|
Cl |
|
|
Cl2/FeCl3 |
+ |
|
|
- HCl |
||
|
|
Cl
При этом преимущественное направление реакции (в о- или п-положение) и относительные количества орто- и пара-изомеров определяются различными факторами (гл. 10.1.2).
10.2.4.2. Нуклеофильное замещение в ароматическом кольце арилгалогенидов
Реакционная способность по отношению к нуклеофилам у арилгалогенидов низкая. Для замещения их галогена требуются жѐсткие условия, активные реагенты либо наличие активирующих функциональных групп, особенно в орто- и пара-положениях относительно галогена. Как правило, взаимодействие протекает при температурах выше 180 С. Это является следствием того, что атом галогена в этих соединениях менее подвижен, чем в алкилгалогенидах. Наиболее типичные случаи замещения атома галогена в бензольном кольце приведены на схеме:
483
|
|
NaOH |
Ar-OH |
Ar-Cl |
|
- NaCl |
|
|
|
||
|
NaOR |
Ar-OR |
|
|
|
||
|
|
- NaCl |
|
|
|
|
NaNH2
- NaCl  Ar-NH2
Ar-NH2
NaCN
- NaCl Ar-CN
NaSH
- NaCl 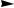 Ar-SH
Ar-SH
|
NaI |
Ar-I |
|
|
- NaCl |
||
|
|
||
|
KF |
|
Ar-F |
|
- KCl |
||
|
|
||
Эти реакции могут быть использованы для получения различных функциональных производных аренов.
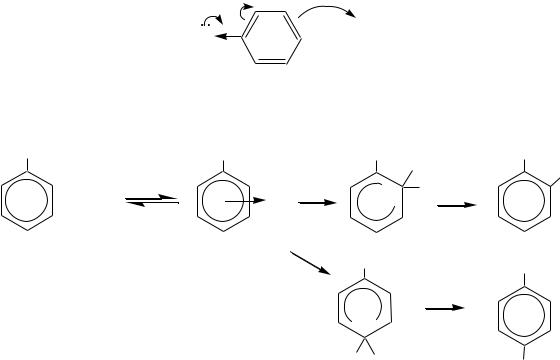
Если в молекуле галогенобензола нет других заместителей или содержится алкильный заместитель, то такие соединения называют неактивированными. Нуклеофильное замещение в молекулах таких арилгалогенидов возможно, например, при взаимодействии хлорбензола с 40%-м водным раствором NaОH при температуре 330 380 С и давлении 30 МПа, а также при взаимодействии того же хлорбензола (а также бромбензола, йодбензола) с амидами щелочных металлов (NaNH2, KNH2) в жидком аммиаке.
Неактивированные субстраты вступают в реакции нуклеофильного замещения по ариновому механизму (механизм отщепления-присоединения). На первой, медленной, стадии происходит отщепление частиц Н+ и Сl ; затем на второй стадии — быстрое присоединение нуклеофильного реагента:
Cl |
- |
|
|
Cl |
|
|
|
|
|
||
|
|
|
|
|
|
H |
+ :NH2 |
- NH3 |
|
- Cl |
- |
|
- |
|
|||
|
|
|
|
||
|
|
|
|
|
дегидробензол |
|
|
|
|
NH2 |
|
|
|
+ :NH3 |
|
|
|
|
|
|
|
H |
|
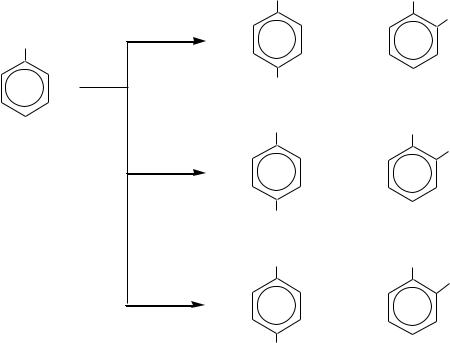
В общем случае при использовании галогенаренов возможно образование двух изомерных продуктов примерно в равных количествах. Например,
484
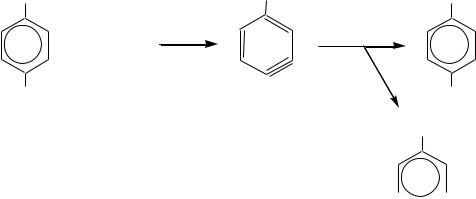
из п-хлортолуола в результате замещения хлора гидроксид-ионом образуются м- и п-крезолы:
CH |
|
CH3 |
CH |
3 |
|
|
3 |
|
- |
|
+ H2O |
+ |
:OH |
|
|
|
|
||
|
- H O |
п-крезол |
|
|
2 |
- |
|
|
- Cl |
|
|
Cl |
|
|
OH |
CH3
м-крезол
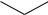
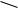 OH
OH
Если в бензольном кольце исходной молекулы галогенарена имеются дополнительные заместители, то они могут сильно влиять на подвижность атома галогена. Присутствие сильных электронодонорных заместителей (-ОН, -NН2 и др.) делает эту реакцию неосуществимой из-за высокой электронной плотности на бензольном кольце и невозможности подхода нуклеофила. Напротив, сильные электроноакцепторные заместители в бензольном кольце (-NO2, -CN и др.) будут активировать молекулу арилгалогенида в реакции нуклеофильного замещения. Такие соединения (с дополнительными акцепторными группами) называют активированными для нуклеофильной атаки.
Арилгалогениды с сильными электроноакцепторными заместителями могут вступать во взаимодействие с нуклеофилами по механизму бимолекулярного нуклеофильного замещения (механизм присоединения-отщепления). Для того чтобы наблюдался такой механизм, достаточно в структуре арилгалогенида хотя бы одного сильного электроноакцепторного заместителя в орто- или пара-положении к замещаемой группе, так как именно в этих положениях заместители, обладающие –М-эффектом, понижают электронную плотность. При этом увеличивается положительный заряд на атоме углерода, связанном с галогеном, и становится возможной нуклеофильная атака по нему. Первая стадия протекания реакции (медленная и обратимая) — присоединение нуклеофильной частицы к молекуле субстрата за счѐт образования новой -связи, а вторая стадия — отрыв галогенид-иона (быстрая и необратимая):
485
Hal |
Hal Y |
Y |
|
|
+ :Y - |
- |
+ :Hal- |
NO |
2 |
NO |
NO2 |
|
2 |
|
|
-комплекс
Примером протекания реакции по механизму SN2ар является щелочной гидролиз п-нитрохлорбензола:
Cl |
OH |
|
+ OH - |
+ |
Cl - |
NO2 |
NO2 |
, |
который протекает в водном растворе при температуре 150 С и давлении 0.6 МПа. Для орто-изомера аналогичная реакция протекает в более мягких условиях (130 С и 0.3 МПа) из-за сильного –I-эффекта нитрогруппы, который сказывается главным образом на ближайших атомах (т.е. в орто- положении). Так получают о-нитроанизол при нагревании в автоклаве при 110 С о-нитрохлорбензола с 80 90%-м метиловым спиртом и щѐлочью в течение 4 5 часов:
Cl |
OCH3 |
NO2 |
NO2 |
|
CH3OH, NaOH, p, T |
о-нитроанизол
о-Нитроанизол служит для получения о-анизидина, а последний используется для синтеза гваякола и лекарственных препаратов на его основе.
В отличие от орто- и пара-нитрохлорбензолов для м-изомера щелочной гидролиз протекает в значительно более жѐстких условиях — это соединение реагирует, вероятнее всего, по ариновому механизму.
Реакционная способность арилгалогенидов определяется величиной частичного положительного заряда на атоме углерода, связанном с галогеном. Поэтому наиболее легко будет замещаться атом фтора за счѐт большого индуктивного эффекта этого атома во фторбензолах, а труднее всего — атом йода. Наличие нескольких электроноакцепторных заместителей в орто- и пара-положениях также будет существенно увеличивать реакционную способность арилгалогенидов. Однако скорость реакции определяется не только
486

Магний реагирует с арилгалогенидами в условиях, обычных для образования магнийорганических соединений – в среде диэтилового эфира:
Ar-Br + Mg ArMgBr
Образующиеся в этой реакции магнийорганические соединения относятся к реактивам Гриньяра и могут использоваться в различных органических синтезах, в частности для введения ароматического радикала (т.е. для арилиро-
вания).
10.2.4.4. Реакции галогенаренов с атомом галогена в боковой цепи
На реакции электрофильного замещения в ароматическом кольце атом
галогена, |
находящийся в боковой алкильной цепи, будет влиять только за |
|||||
|
H |
|
счѐт своего индуктивного эффекта. При этом наиболее |
|||
|
Cl |
сильное влияние оказывает атом (или атомы) галогена в |
||||
H |
|
|
|
|||
C |
I |
-положении боковой цепи. Так, в -хлорметилтолуоле |
||||
|
||||||
|
|
|
||||
|
|
|
|
+M |
за счѐт этого будут затруднены электрофильные реак- |
|
|
|
|
|
|||
|
|
|
|
ции в кольцо, однако ориентация электрофильного за- |
||
|
|
|
|
|
||
|
|
|
|
|
мещения будет такая же, как и в толуоле, — в орто- и |
|
|
|
|
|
|
||
|
|
|
|
|
пара-положения. При наличии у -углеродного атома |
|
нескольких атомов галогена значительно увеличивается суммарный акцеп-
торный эффект и меняется ориентация замещения. Так, |
|
Cl |
Cl |
|||||
например, группировка -CCl3 сильно дезактивирует |
Cl |
|
|
|||||
C |
|
|
|
|
|
|||
кольцо и ориентирует вступающий электрофил исклю- |
|
|
|
|
I |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
|
||||||
чительно в мета-положение за счѐт обратного сверхсо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|||
пряжения. А такой заместитель, как -CНCl2, будет ори- |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
ентировать во все положения кольца, но преимущест- |
|
|
|
|
|
|
|
|
венно в м-положение. |
|
|
|
|
|
|
|
|
Наличие атома галогена у -углеродного атома и далее ( -, -) в угле- |
||||||||
родной цепи мало сказывается на скорости и направлении электрофильного замещения. Такие соединения ведут себя аналогично аренам. Акцепторное влияние атома галогена на скорость замещения будет уменьшаться по мере его удаления от бензольного кольца.
Нуклеофильное замещение атома галогена в боковой цепи в значительной мере зависит от природы атома углерода, связанного с галогеном. - Галогенозамещѐнные арены отличаются высокой активностью в реакциях нуклеофильного замещения по механизму SN1:
|
+ |
CH2-Cl |
CH2 |
|
- Cl |
488
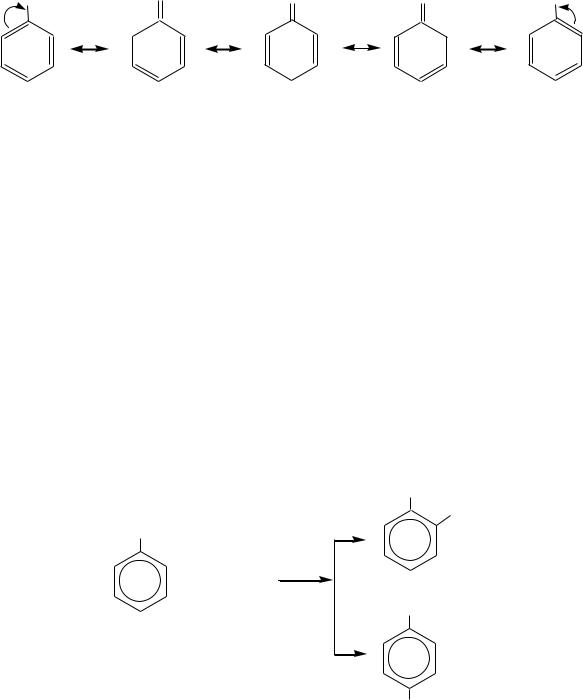
Такая лѐгкость протекания реакции связана с образованием устойчивого катиона бензильного типа, в котором положительный заряд делокализован с участием -электронной системы кольца (за счѐт р- -сопряжения):
+ |
CH2 |
CH2 |
CH2 |
+ |
CH |
CH |
|||
2 |
|
|
|
2 |
|
+ |
|
+ |
|
|
|
|
|
+
Реакционная способность соединений, в которых атом галогена находится у-углеродного атома и далее ( -, -) в углеродной цепи, по отношению к нуклеофилам близка реакционной способности соответствующих галогеналканов. Скорость и механизм замещения определяются в соответствии с факторами, рассмотренными для нуклеофильного замещения в галогеналканах
(гл. 3.1.1).
10.2.5.СПОСОБЫ ПОЛУЧЕНИЯ
1.Важнейшим методом получения многих галогенаренов является непосредственное галогенирование ароматических углеводородов. При этом в зависимости от условий хлорирование (или бромирование) можно провести в ароматическое кольцо или в боковую цепь:
а) галогенирование на катализаторе, как правило, без нагревания и в жидкой фазе приводит к арилгалогенидам (гл. 9.5.1.1, 9.5.2.1):
R
Cl
R
FeCl3
+ Cl2 - HCl
R
Cl
б) галогенирование в боковую цепь (по -углеродному атому) проводится при нагревании, облучении ультрафиолетом и в отсутствие даже следов катализатора (гл. 9.5.2.2):
489
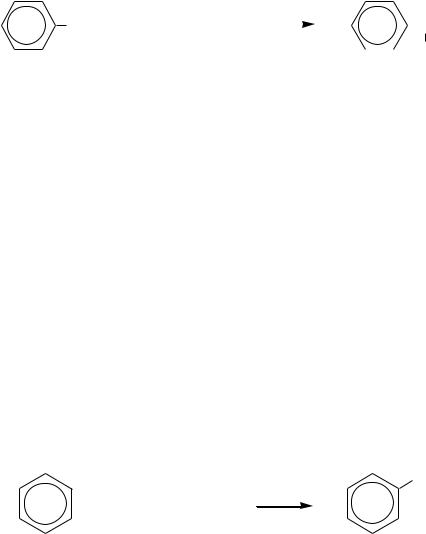
CH2-CH3 + Cl2 |
|
|
|
|
|
|
CH-CH3 |
|
- HCl |
|
|
|
|
||
|
|
|
|
|
Cl |
||
|
|
|
|
|
|
||
|
|
|
|
|
|||
2. Второй способ получения основан на нуклеофильном замещении одних галогенов на другие. Он применяется для получения соединений, содержащих атомы фтора и йода в ароматическом кольце:
Ar-Cl + KF Ar- F + KCl
Кроме KF, могут быть использованы CsF, SbF5. Возможные механизмы замещений рассмотрены выше. Нуклеофильное замещение может быть использовано и для получения галогенозамещѐнных соединений в боковой цепи — реакция протекает как для галогенопроизводных алифатического ряда.
3. Арилгалогениды могут быть получены при замене первичной аминогруппы в ароматическом кольце (через образование диазосоединений — гл. 10.7.2, 10.7.4.1):
HNO2 HCl |
+ |
|
KI |
Ar-NH2 |
[Ar-N2] Cl |
|
Ar-I + KCl + N2 |
4. Одним из способов получения замещѐнных бензилгалогенидов является реакция галогенометилирования (реакция Блана — гл. 9.5.1.1):
CH2Cl
ZnCl2
+ H2CO + HCl
10.2.6. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Хлорбензол — бесцветная жидкость со своеобразным запахом и температурой кипения 179 С. Его используют в качестве растворителя и как исходное сырьѐ для промышленного органического синтеза.
Дихлорбензолы — растворители и полупродукты органического синтеза. п-Дихлорбензол используется как дезодорант и как средство борьбы с молью.
Дихлордифенилтрихлорметилметан (ДДТ) — бесцветное кристалличе-
ское вещество, хорошо растворимое в органических растворителях. Представляет собой сильнодействующий универсальный инсектицид. Долгие годы он успешно использовался в сельском хозяйстве при борьбе с вредными насекомыми. В настоящее время запрещѐн к применению из-за способности накапливаться в почве, живых организмах и вызывать отравления.
490

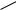 Cl
Cl