
охт (6sem) / методички митхт / GCT practicum 2013
.pdf81
воды, затраченные на образование всех продуктов
электролиза ( изр. и изр. );
е) Масса гидроксида натрия, пошедшая на побочные реакции (2.2.10), является разностью между теоретической и практической массой гидроксида натрия;
ж) По уравнению (2.2.10), учитывая массу гидроксида натрия, пошедшего на побочную реакцию, рассчитываем массу образовавшихся хлорида натрия и
гипохлорита натрия, а также воды: поб. , поб. и
поб. ;
з) Масса воды в католите ( ) определяется
как разность между массой воды, введенной с электролитом, и массой воды, пошедшей на основную реакцию (воду, образовавшуюся по побочной реакции тоже нужно учесть):
ост. |
= |
|
− |
изр. |
поб. |
|
|
|
+ |
||
|
|
|
|
Вода, унесенная с газами (хлором и водородом), не учитывается
е) Масса хлорида натрия ост. |
в католите |
|
|
определяется как разность между массой хлорида натрия, введенного с электролитом, и массой хлоридом натрия, пошедшего на основную реакцию (с
учётом поб. |
): |
|
|
|
|
|
|
|
|
|
ост. |
|
изр. |
поб. |
|
|
= |
− |
+ |
|
|
|
|
|
82
Таблица 2.2.3
Материальный баланс процесса электролиза.
Базис _______
Введено |
|
Получено |
|
||
|
|
|
|
|
|
Исходные |
Масса, |
% |
Продукты |
Масса, |
% |
вещества |
г |
масс. |
электролиза |
г |
масс. |
|
|
|
|
|
|
Электролит: |
|
|
Католит: |
|
|
NaCl |
|
|
NaCl |
|
|
|
|
|
NaOH |
|
|
H2O |
|
|
H2O |
|
|
|
|
|
NaClO |
|
|
|
|
|
Анодный |
|
|
|
|
|
газ: |
|
|
|
|
|
Cl2 |
|
|
|
|
|
Катодный |
|
|
|
|
|
газ: |
|
|
|
|
|
H2 |
|
|
|
|
|
Невязка |
|
|
|
|
|
|
|
|
Всего |
|
100 |
Всего |
|
100 |
|
|
|
|
|
|
Расчет технологических показателей.
После расчета материального баланса на основании экспериментальных данных (№№ проб указывает преподаватель) рассчитывают по формулам
(2.2.15), (2.2.23), (2.2.25), (2.2.27) выход по току гидроксида натрия ( Э), удельный расход электроэнергии (Wуд.), коэффициент использования энергии (N), степень превращения хлорида натрия (X). Результаты расчетов заносятся в табл. 2.2.4.
83
Таблица 2.2.4
Технологические показатели процесса электролиза.
№№ |
Э, % |
Wуд., |
N, |
Концентрация |
Х, |
Примечание |
пробы |
(по NaOH) |
Вт·ч |
% |
NaOH в |
% |
|
|
|
кг |
|
католите |
|
|
|
|
|
|
г/л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2.6.Задание
1. Определить постоянство протекаемости электролита через диафрагму
2.Провести электролиз раствора хлорида натрия
сзаданной силой тока с записью всех экспериментальных данных по прилагаемой форме.
3. |
Провести |
анализ электролитической |
щелочи |
|||
(3 - 4 пробы). |
|
|
|
|
|
|
4. |
Составить |
приближенный |
материальный |
баланс |
||
процесса электролиза (табл. 2.2.3). |
|
|
||||
4. |
По |
полученным |
данным |
рассчитать |
||
технологические показатели электролиза для 2 - 3 проб (по указанию преподавателя) и результаты свести в табл. 2.2.4.
2.2.5.Техника безопасности.
1.Не прикасаться к клеммам выпрямителя.
2.Включать ток только после заполнения электролизера необходимым объемом электролита.
3.Выполнять работу на установке, смонтированной в вытяжном шкафу с хорошей вытяжной вентиляцией (не забыть включить вентилятор кнопкой на щите до начала работы).
4.В случае появления признаков отравления хлором, вывести пострадавшего на свежий воздух, дать молоко и обеспечить медицинскую помощь.
84
5. Вблизи включенного электролизера запрещается работать с открытым огнем (на катоде выделяется водород).
|
Библиографический список |
|
|
1. |
Скорчеллетти |
В.В. |
Теоретическая |
электрохимия. – Л.:Химия, 1974. - 568 с.
2.Якименко Л.М. Производство водорода, кислорода, хлора и щелочей. – М.: Химия, 1981. – 280 с.
3.Файнштейн С.Я. Производство хлора методом
диафрагменного электролиза. – М.: Химия, 1984. –
304с.
4.Кубасов В.Л., Банников В.В.
Электрохимическая технология неорганических веществ. – М.: Химия, 1989. – 288 с.

85
2.3.Контактное окисление оксида серы(IV).
2.3.1.Цель работы. Ознакомить с закономерностями простого, обратимого, экзотермического, гетерогенно-каталитического
процесса окисления SO2 в SO3 на ванадиевом катализаторе, который является основной стадией производства серной кислоты; провести характерные для этого процесса технологические расчеты.
2.3.2.Введение.
Процесс получения оксида серы(VI) является одним из немногочисленных простых химикотехнологических процессов, осуществляемых в промышленном масштабе, а конечный продукт производства - серная кислота – один из базовых продуктов химической промышленности. Объем и эффективность производства серной кислоты непрерывно возрастают при одновременном совершенствовании технологических схем, росте единичных мощностей установок, сокращении энергозатрат, решении экологических проблем. Получение в больших масштабах серной кислоты осуществляют контактным методом, включающим в себя: получение SO2 путем обжига колчедана или сжигания серы; контактное окисление SO2 в SO3 и абсорбцию оксида серы(VI) с получением концентрированной серной кислоты или олеума.
Стадия |
окисления |
SO2 в |
SO3 |
на |
оксидном |
|
катализаторе |
является |
типичным |
примером |
|||
гетерогенно-каталитического процесса. |
|
|||||
2.3.3. Теоретические основы процесса.
Химизм, равновесие и кинетика.
Реакция окисления
SO2 + 1/2 O2  SO3
SO3
86
протекает с уменьшением объема и выделением тепла. Изменение стандартной молярной энтальпии реакции
∆ |
= -98,9 |
кДж/моль. Константа равновесия, |
|||||||
рассчитанная по уравнению |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
, |
|
||
|
|
|
|
|
∙ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
PSO |
,PSO ,PO – равновесные парциальные давления |
|||||||
|
3 |
2 |
2 |
|
|
|
|
|
|
SO3, SO2 и O2, имеет значения в диапазоне |
103 - 10 |
||||||||
в интервале температур 400-600°С. |
|
||||||||
Для газовой смеси, используемой в процессе |
|||||||||
окисления |
SO2 |
в |
качестве |
исходной и содержащей |
|||||
7% SO2, 11% О2 и 82% N2 (по объему), при давлении |
|||||||||
0,1 МПа равновесная степень превращения |
SO2 (X*) |
||||||||
имеет следующие значения: |
|
|
|
|
|||||
Таблица 2.3.1 Зависимость равновесной степени превращения от температуры.
t, oC |
400 |
440 |
480 |
520 |
560 |
590 |
|
650 |
Х*, % |
99,2 |
98,0 |
95,4 |
90,7 |
82,5 |
75,0 |
|
58,5 |
В интервале температур 400 – 1000°С реакция |
||||||||
окисления |
SO2 |
обратима. |
При |
температурах |
ниже |
|||
400°С равновесие почти полностью смещено в сторону SO3, при температурах выше 1000°С – в сторону исходных веществ. На равновесную степень превращения в соответствии с принципом Ле-Шателье положительно влияют понижение температуры, повышение давления, увеличение концентрации кислорода и вывод SO3 из зоны реакции.
Реакция не протекает без катализатора из-за
высокого |
значения |
энергии |
активации |
(Еа = ~280 |
кДж/моль). Процесс |
окисления с |
заметной |
87
скоростью начинается при определенной температуре для различных катализаторов - температуре зажигания. Реакция ускоряется в присутствии платины (Еа = 70 кДж/моль) при температуре не ниже 25О°С, оксида железа(III) (Еа = 150 кДж/моль) при температуре не ниже 55О°С; катализаторы на основе оксида ванадия(V) проявляют активность при
температуре не ниже 400°С (Еа = 90 кДж/моль). Платиновый катализатор обладает наибольшей
активностью, однако дорог и быстро отравляется ядами (мышьяком, селеном, хлором и др.). Оксид железа(III) - малоактивный катализатор. В настоящее время в производстве серной кислоты применяются только ванадиевые катализаторы.
Активными |
компонентами |
ванадиевых |
|
катализаторов |
являются |
сульфо- |
и |
пиросульфованадаты калия, которые в условиях проведения реакции находятся в расплавленном
состоянии |
на |
поверхности |
кремнеземистого |
носителя. |
Формы |
контактной |
массы - гранулы, |
кольца. Рабочий интервал температур 400 - 600°С.
При |
температурах |
выше |
600°С |
активность |
|
катализатора |
уменьшается |
из-за |
разрушения |
||
активного комплекса |
V2О5 ∙ K2S2O7 и взаимодействия |
||||
компонентов контактной массы с носителем. При температурах ниже 400°С возможно образование каталитически неактивного соединения - сульфата
ванадила VOSO4. |
|
|
|
|
|
|
|||
Процесс |
гетерогенного |
катализа |
на |
||||||
пористом |
|
катализаторе |
|
многостадиен. |
В |
общем |
|||
виде |
различаются следующие стадии: |
|
|
||||||
1). |
Перенос |
газообразных |
веществ |
из |
|||||
объема |
к |
поверхности |
катализатора (внешняя |
||||||
диффузия); |
|
|
|
|
|
|
|
||
2). |
Диффузия |
реагирующих |
веществ |
внутри |
|||||
пор |
катализатора (внутренняя диффузия); |
|
|
||||||
3). Адсорбция O2 и SO2 на катализаторе; |
|
||||||||
4). |
Химическое |
взаимодействие |
исходных |
||||||
веществ с участием катализатора; |
|
|
|
||||||
88
5). Десорбция SO3;
6). Диффузия SO3 внутри зерна катализатора к его поверхности (внутренняя диффузия);
7). Перенос продукта реакции в газовую фазу (внешняя диффузия).
Скорость всего процесса определяется скоростью наиболее медленной стадии. В зависимости от выбранных условий скорость образования SO3 определяется скоростью внешней или внутренней диффузии или же скоростью химического взаимодействия.
При промышленных скоростях газового потока и при использовании катализатора с диаметром гранул не более 0,5 см и с размером пор 5·10-5 см процесс окисления оксида серы(IV) протекает в кинетической области.
Г.К. установил, что скорость окисления ванадиевом катализаторе приближенно описывается уравнением
|
|
|
|
|
|
|
0 ,8 |
|
|
|
|
|
|||
r k C |
|
|
C SO2 |
C SO2 |
|
|
|
O2 |
|
|
|
(2.3.1) |
|||
|
|
C SO |
|
|
|||
|
|
|
|||||
|
|
3 |
|
||||
|
|
|
|
|
|
|
|
где С - текущие концентрации веществ; CSO2 - равновесная концентрация сернистого ангидрида при данной температуре;
k - константа скорости.
Из уравнения 2.3.1 следует, что скорость реакции уменьшается с приближением к равновесию.
Константа скорости возрастает в пределах температур работы катализатора 400-600°С согласно закону Аррениуса. При изменении температуры с 400 до 500°С она увеличивается в 30 раз, однако
89
при этом наблюдается падение значения движущей
силы |
процесса |
(C |
SO |
|
C |
). |
Движущая |
сила |
|
|
|
2 |
SO |
2 |
|
|
|
|
|
|
|
|
|
|
уменьшается, так как с ростом температуры равновесие реакции смещается влево и растет
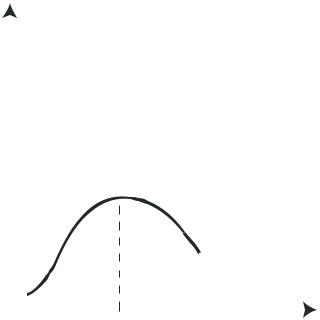
значение CSO2 . Поэтому зависимость скорости процесса от температуры, при прочих постоянных условиях (Р, С, τ), представляет собой кривую с максимумом (рис.2.3.1): до оптимальной температуры скорость растет за счет значительного возрастания k, а затем понижается в силу того, что начинает преимущественно сказываться уменьшение движущей силы из-за приближения к равновесию. Поскольку наибольшее влияние на величину движущей силы процесса оказывает концентрация кислорода
(высокий порядок PO2 в кинетическом уравнении),
то можно считать, что адсорбция кислорода поверхностью катализатора лимитирует скорость окисления и k является константой скорости хемосорбции кислорода.
Скорость образования SO3
toопт. t,o С
Рис. 2.3.1 Влияние температуры на скорость реакции образования оксида серы(VI) при постоянном времени контактирования.
90
2.3.4. Выбор технологического режима.
Температура. Выбор температурного режима, обеспечивающего высокую скорость и выход обратимой экзотермической реакции, довольно сложен, так как изменение температуры противоположным образом влияет на величину равновесного выхода продукта и скорость превращения SO2 в SO3. Налицо противоречие между кинетикой и термодинамикой процесса.
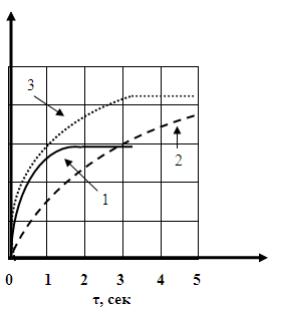
Процесс окисления SO2 в SO3 обратимый, экзотермический, поэтому для получения 100%-го выхода оксида серы (VI) необходима температура не выше, чем 400 - 425°С. Однако скорость процесса при этой температуре мала даже при наличии катализатора (рис.2.3.2).
X, %
100
80
60
40
20
Рис.2.3.2 Изменение степени превращения оксида серы(IV) при различных температурных режимах: 1- 600°С, 2 – 450°С, 3 – 600-400°С
Если вести процесс при постоянной температуре 600°С, то начальная скорость реакции будет высокой, но, в соответствии с состоянием равновесия, процесс заканчивается при достижении значительно меньшей степени превращения, чем при
