
охт (6sem) / методички митхт / GCT practicum 2013
.pdf101
Раздел 3
Технология органических веществ
102
3.1. Получение метаналя (формальдегида) окислительным дегидрированием метанола.
3.1.1. Цель работы.
Ознакомление с основными закономерностями гетерогеннокаталитического процесса, включающего параллельные и последовательные побочные реакции,
срациональным проведением высокотемпературного
экзотермического |
процесса |
в |
автотермическом |
режиме. |
|
|
|
|
3.1.2. Введение. |
|
|
Формальдегид |
(метаналь) |
CH2O |
представляет |
собой бесцветный газ с острым раздражающим запахом (tконд = 19ОС при атмосферном давлении). Формальдегид хорошо растворяется в воде, спирте, эфире, легко полимеризуется и вступает в реакции конденсации. Промышленность выпускает формальдегид в форме
формалина |
- |
|
37 % масс. водного раствора. В |
|||
нем |
формальдегид |
присутствует в |
виде |
гидрата |
||
CH2O |
|
H2O |
и |
низкомолекулярных |
полимеров |
|
(полиоксиметиленгликолей): |
|
|
||||
|
|
nCH2O + H2O = H-(OCH2)n-OH, |
где n<8. |
|||
Во избежание более глубокой полимеризации и выпадения осадка к формалину добавляют 7 - 12 % масс. метанола в качестве стабилизатора.
Формальдегид является одним из наиболее крупнотоннажных продуктов органического синтеза. Ежегодно в мире производится около 7 млн. т. Его применяют для производства пластических масс (феноло-, карбамидо-, и меламино-формальдегидных полимеров, полиформальдегидов), изопрена и на его основе полиизопренового каучука, лекарственных препаратов (уротропина), взрывчатых веществ (пентрита) и т.д.
Впромышленности формальдегид получают из
метанола |
окислительным |
дегидрированием |
на |

103
металлических катализаторах (600 – 720о) или окислением избытком воздуха на молибдате железа при 250 – 400о. Первый способ преобладает.
3.1.3. Теоретические основы процесса.
Химия процесса. Формальдегид при катализе металлами образуется по двум реакциям: мягким окислением и дегидрированием метанола (указаны величины тепловых эффектов):
CH3OH + 0,5O2 CH2O + H2O |
147,4 |
кДж/моль |
(3.1.1) |
|
CH3OH |
CH2O + H2 |
- 93,4 кДж/моль |
(3.1.2) |
|
Наряду с основными протекают побочные реакции: |
||||
CH3OH + 1,5O2 CO2 + 2H2O |
575 |
кДж/моль |
(3.1.3) |
|
CH2O + 0,5O2 HCOOH |
270,4 |
кДж/моль |
(3.1.4) |
|
HCOOH + 0,5O2 CO2 + H2O |
14,5 |
кДж/моль |
(3.1.5) |
|
CH2О CO + H2 |
1,9 |
кДж/моль |
(3.1.6) |
|
2CO CO2 + C |
172 кДж/моль |
(3.1.7) |
||
Следовательно, синтез |
формальдегида |
относится |
||
к сложным процессам. |
|
|
|
|
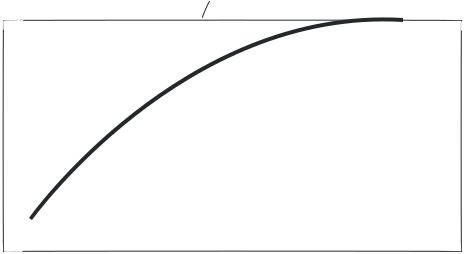
Равновесие основных реакций. На рис. 3.1.1
приведена зависимость равновесного выхода * формальдегида от температуры для реакции окисления
и дегидрирования. |
|
|
|
|
Равновесие |
экзотермической |
|
реакции |
|
окисления |
(3.1.1) в широком диапазоне температур |
|||
полностью |
смещено |
в правую сторону, |
* |
100%, |
т.е. реакция (3.1.1) необратима. Равновесие эндотермической реакции дегидрирования (3.1.2), согласно принципу Ле Шателье, при повышении температуры смещается вправо, равновесный выход
растет |
и |
достигает |
практически |
100% |
при |
температуре > 700ОС ( |
= 96,5%; |
= 98,9%). |
|||
|
|
|
|
|
|
104
Кинетика процесса. Метанол может превращаться по различным направлениям: (3.1.1), (3.1.2), (3.1.3). Проведение процесса при высокой температуре приводит к значительному ускорению реакции глубокого окисления метанола до оксида углерода(IV) (3.1.3), так как энергия активации этой реакции больше энергии активации реакций превращения метанола в формальдегид. Для ускорения основных реакций (3.1.1), (3.1.2) необходимо проводить процесс с участием избирательно действующего катализатора. В качестве катализатора можно использовать металлы IБ подгруппы Периодической системы элементов: Ag, Au, Cu. Промышленным катализатором является серебро, ибо оно проявляет наиболее высокую селективность.
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
,% |
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
200 |
400 |
600 |
800 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
t,oС |
|
|
|
|
|
Рис. 3.1.1 Зависимость равновесных выходов формальдегида от температуры: 1 - по реакции окисления, 2 - по реакции дегидрирования.
Механизм химических взаимодействий на серебряном катализаторе включает в себя ряд последовательных превращений. Метанол не адсорбируется на серебре в отсутствие кислорода. Кислород, адсорбируясь на серебряном катализаторе,
105
образует с серебром различные поверхностные соединения. Эти соединения являются действительными катализаторами протекающих процессов. Считается, что реакции (3.1.1) и (3.1.2) катализируют соединения, в которых кислород связан относительно прочно, а побочные процессы глубокого окисления метанола связаны с наличием на поверхности соединений с непрочно связанным кислородом. Доля последних возрастает при избытке кислорода в системе. В результате изучения взаимодействия метанола и кислорода с медными и серебряными катализаторами был предложен следующий механизм реакции:
СН3ОН(газ) + О(адс) СН3О(адс) + ОН(адс) СН3ОН(газ) + ОН(адс) СН3О(адс) + Н2О(адс) СН3О(адс) СНОН(адс) + Н(адс)
2Н(адс) Н2(газ)
Н2О(адс) Н2О (газ)
СНОН(адс) СН2О (газ)
Из этого механизма следует, что реакции дегидрирования и окисления сопряжены между собой и протекают с участием одних и тех же кислородных центров на поверхности катализатора.
В процессах, протекающих в гетерофазных системах, в частности, в рамках гетерогеннокаталитических процессов, к которым относится
синтез |
формальдегида, |
важную |
роль играют |
массообменные процессы. |
|
|
|
Эти |
процессы |
включают |
несколько |
последовательных стадий: |
|
|
|
1)диффузия газообразных (или жидких) реагентов из потока через пограничный газовый (или жидкий) слой к внешней поверхности катализатора (внешняя диффузия);
2)внутренняя диффузия газообразных (или жидких) реагентов в порах твердого вещества катализатора к внутренней поверхности;
106
3)адсорбция реагентов, химическая реакция на поверхности, десорбция продуктов;
4)внутренняя диффузия газообразных (или жидких) продуктов реакции в обратном направлении;
5)внешняя диффузия газообразных (или жидких) продуктов через пограничный слой в поток.
В зависимости от соотношения скоростей этих стадий гетерогенные процессы могут протекать в диффузионной, переходной или кинетической области.
В качестве примера рассмотрим некий гетерогенно-каталитический процесс с участием газообразного реагента. Выражения для скоростей
внешней (через пограничный газовый слой толщиной у поверхности катализатора) и внутренней (в порах к внутренней поверхности катализатора) диффузии запишем по закону Фика уравнениями (3.1.8) и (3.1.9), соответственно.
Внешняя диффузия: |
|
rU D( CU CF ) / ( CU CF ) |
(3.1.8) |
Внутренняя диффузия |
|
rF Dэф ( CF CS ) / Rз ' ( CF CS ) |
(3.1.9) |
Примем, что скорость химического превращения на поверхности катализатора пропорциональна концентрации реагента (3.1.10):
|
|
r kCS |
(3.1.10) |
||
где |
CU, CF, CS |
- концентрации |
газообразного |
||
реагента в объеме потока, у внешней |
поверхности |
и |
|||
у |
внутренней |
поверхности |
катализатора, |
||
соответственно. |
|
|
|
|
|
- |
коэффициент |
массоотдачи ( = |
D/ , |
D |
- |
коэффициент диффузии, - толщина ламинарной газового слоя вокруг твёрдой частицы);

107 |
|
k - константа скорости химической реакции; |
|
' - коэффициент массоотдачи в твердой фазе |
( ' |
=Dэф/Rз , Dэф - эффективный коэффициент диффузии, Rз |
|
– радиус зерна катализатора). |
|
Поскольку концентрации у внешней и внутренней |
|
поверхности катализатора трудно измерить и |
они, |
как правило, не известны, выразим скорость реакции в стационарном режиме (скорости всех последовательных стадий, перечисленных выше, равны между собой) через известную концентрацию реагента в объеме. Приравняв скорости внешней, внутренней диффузии и химической реакции (r = rU = rF) и проведя простые преобразования для исключения
неизвестных концентраций |
|
CF и |
CS, получим |
|||
(3.1.11). |
|
|
|
|
|
|
|
r / CU |
CF |
|
|||
|
r / ' C |
F |
C |
S |
|
|
|
|
|
|
|||
|
r / k CS |
|
|
|
||
r( 1 / 1 / ' 1 / k ) C |
(3.1.11) |
|||||
|
|
|
|
|
U |
|
r |
1 |
|
|
CU |
(3.1.12) |
|
|
||||||
( 1 / 1 / ' 1 / k ) |
||||||
r kнаблСU
k |
набл |
1 /( 1 / 1 / ' 1 / k ) |
(3.1.13) |
|
|
|
где r - скорость гетерогенного процесса;
kнабл - эффективная константа скорости гетерогенного процесса;
1/k, 1/ , 1/ ' - сопротивления химической реакции, внешней и внутренней диффузии, соответственно.
Если сопротивление на одной из стадий значительно превышает сопротивление двух других
108
стадий, то эффективная константа скорости с достаточно хорошим приближением будет равна константе скорости этой стадии. Эта стадия
называется |
лимитирующей |
(или |
скорость |
|||
определяющей) |
и |
характеризуется |
следующими |
|||
особенностями: |
|
|
|
|
|
|
- |
обладает |
максимальным |
сопротивлением |
и, |
||
следовательно, |
|
минимальным |
коэффициентом |
|||
интенсивности в уравнении скорости (k, или '); |
|
|||||
- на лимитирующей стадии происходит максимально возможное изменение концентрации газообразного реагента от CU до нуля (для необратимых реакций) или от CU до CU* (для обратимых реакций);
- скорость гетерогенного процесса может быть рассчитана как скорость лимитирующей стадии.
Гетерогенные процессы протекают в кинетической области, если велика скорость массообмена и относительно мала скорость химической реакции. Для кинетической области характерно сильное влияние
температуры |
на |
скорость |
процесса |
(энергия |
||
активации |
для |
большинства |
реакций |
достаточно |
||
велика |
и составляет 40 - |
280 кДж/моль). Это обычно |
||||
бывает |
при |
низких температурах и |
давлениях, |
|||
больших скоростях газового потока и при высокой пористости или отсутствии слоя «золы» (для процессов с участием твердых реагентов, например,
различные |
виды |
обжига и |
выщелачивания). При этом |
|
>> k, |
' >> |
k и r k |
CU (для реакций первого |
|
порядка). |
|
|
|
|
Для |
интенсификации |
процесса |
необходимо |
|
повышать температуру (если наблюдаемая энергия
активации |
имеет |
положительную |
величину) |
и |
|||
концентрации (парциальные давления) реагентов. |
|
||||||
|
Если скорость процесса массопереноса из потока |
||||||
к |
поверхности |
значительно |
меньше |
скорости |
|||
химической реакции и внутренней диффузии, то процесс протекает во внешней диффузионной области.
Величина |
энергии |
активации |
составляет |
8-20 |
кДж/моль. При этом << k, << '. |
Для интенсификации |
|||
109
процессов, протекающих во внешнедиффузионной области, необходимо увеличивать скорость потока, а также проводить процесс при интенсивном перемешивании.
Если выполняются условия |
’ << |
k, ' << , |
||
процесс |
лимитируется |
|
внутридиффузионным |
|
торможением. |
Увеличение |
скорости |
внутренней |
|
диффузии возможно, главным образом, за счет уменьшения размера зерна катализатора (или частиц твердого реагента, участвующего в процессе).
В переходной области наблюдается примерно одинаковое влияние кинетики химической реакции и процессов массопереноса на скорость гетерогенного
процесса, а коэффициенты интенсивности k, и ' и, соответственно, сопротивления на каждой стадии соизмеримы по величине.
Как следует из экспериментальных данных, образование формальдегида на серебряном катализаторе при линейной скорости газового потока
W 2 м/сек и температурах ниже 300 ОС протекает в кинетической области, при 300 - 500 ОС - в переходной и выше 500 ОС - во внешнедиффузионной области.
3.1.4. Выбор оптимального технологического режима.
Синтез формальдегида осложнен побочными реакциями, среди которых велика роль последовательных превращений формальдегида: (3.1.4), (3.1.6). Для получения высокого выхода формальдегида необходимо создать такие условия, которые обеспечивают большую скорость основных реакций (3.1.1), (3.1.2) и сводят к минимуму скорость побочных.
Катализатор. В промышленности используют серебряные катализаторы, так как на золотых и медных катализаторах интенсивнее, чем на серебряных, идут реакции глубокого окисления метанола до муравьиной кислоты и оксида
110
углерода(IV). Серебро применяют в виде сеток, гранул и, чаще всего, нанесенным на различные носители. Количество нанесенного серебра составляет обычно 20 - 40% от массы катализатора и зависит от природы носителя и способа приготовления катализатора. Носители должны обладать достаточной механической и термической прочностью, а также химической инертностью. Наличие мелких пор (большая удельная поверхность) затрудняет отвод формальдегида с поверхности катализатора и способствует последовательным превращениям СН2О. Поэтому наиболее эффективными являются носители с крупными порами (10 - 70 мкм) и малой удельной поверхностью (0,01- 4 м2/г). В настоящее время в качестве носителей используется природная пемза, корунд, алюмосиликаты (размер пор не менее 15 мкм, удельная поверхность не более 4
м2/г).
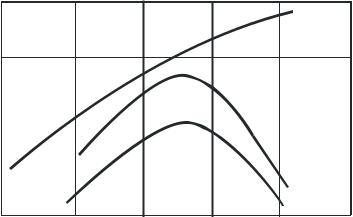
Температура. Степень превращения метанола с повышением температуры увеличивается (рис. 3.1.2), так как растут скорости основных и побочных реакций.
%
100
Рис.3.1.2
1
90 Зависимость степени превращения спирта
|
|
|
3 |
|
Х, выхода |
|
|
|
|
|
|
||
80 |
|
|
|
|
формальдегида на |
|
|
|
|
|
|||
|
|
|
2 |
|
метанол и |
|
|
|
|
|
|
|
|
70 |
|
|
|
|
селективности |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
образования СН2О на |
|
60 |
|
|
|
|
метанол |
от |
|
|
|
|
температуры |
||
500 |
600 |
700 |
800 |
|||
|
|
|
t,oС |
|
процесса: 1 - Х, |
|
|
|
|
|
|
2 - , 3 |
- |
