
охт (6sem) / методички митхт / GCT practicum 2013
.pdf11
|
|
|
|
|
|
|
∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
= |
|
|
= |
|
|
|
|
|
= ∙ |
|
(1.10) |
|
|
|
|
|
|
|
||||||
|
|
|
|
∙ |
|
|
|
|||||
|
|
∙ |
|
∙ |
∙ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
Поскольку при |
расчете по формулам (1.2) и |
|||||||||||
(1.3) |
получают |
|
значение |
|
термодинамической |
|||||||
константы |
равновесия |
Ка, |
а |
|
для |
расчета |
||||||
равновесного |
|
выхода |
|
необходимо |
значение |
|||||||
определяемой экспериментально константы КP, то |
||||||||||||
необходимо |
для |
процессов, |
протекающих |
под |
||||||||
давлением, рассчитывать Кγ, так как эта величина в этом случае будет отличаться от единицы. Для
оценки Кγ используют |
различные |
подходы, |
описанные |
|||
в литературе по химической |
термодинамике. |
|
|
|||
Таким |
образом, |
на |
величину |
константы |
||
равновесия |
реакции |
влияет |
температура |
в |
||
зависимости |
от знака |
теплового |
эффекта. Давление |
|||
может влиять на величину КP только через изменение Кγ. На величину равновесного выхода влияют температура (через значение КP), общее давление и соотношение концентраций (парциальных
давлений |
веществ). |
Избыток |
одного |
реагента |
||
приводит |
к |
увеличению |
степени |
превращения |
||
другого(-их) реагента(-ов) и к уменьшению степени превращения реагента, находящегося в избытке.
Большая величина константы равновесия и отсутствие термодинамических ограничений (Хравн. = 1)
необходимое, |
но |
не |
достаточное |
условие |
практической |
реализации ХТП. |
|
|
|
Очень большое значение для выбора условий проведения ХТП имеют кинетические закономерности
целевой и побочных реакций (т.е. закономерности протекания процесса во времени или зависимость скорости от концентраций веществ, температуры, наличия катализатора и его характеристик).
Столкновение двух молекул исходных реагентов, обладающих достаточной энергией для преодоления энергетического барьера, приводит к получению
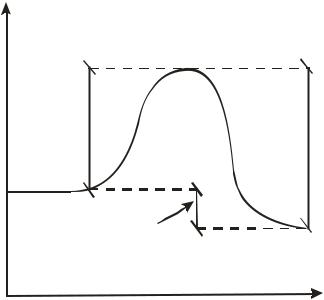
12
продуктов (промежуточных или конечных) реакции и называется элементарным актом химического взаимодействия (рис.1.1). Точку на вершине энергетического барьера называют переходным состоянием или активированным комплексом (это термины из соответствующих теорий элементарных реакций, см. курс «Физическая химия»).
Ea,прям
Ea,обр
E
A + B
C + D
- H 
Координата реакции
Рис. 1.1 Энергетическая диаграмма элементарной реакции.
Совокупность одинаковых элементарных актов – элементарная реакция (1.13).
аА + вВ → сС + dD |
(1.13) |
Элементарную реакцию от сложной (по механизму) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции может быть описана законом действия масс. Для реакции (1.13) уравнение (1.14).
|
= |
|
∙ |
|
(1.14) |
|
|
|
|||||
|
|
|
|
Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их

13
стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции. Зависимость константы скорости элементарной реакции от температуры описывают уравнением Аррениуса (1.15).
− |
|
= |
(1.15) |
где А – предэкспоненциальный член, Е – энергия активации, R – газовая постоянная, Т – абсолютная температура.
Показатель степени концентрации (или
парциального давления) в кинетическом уравнении называют порядком по данному реагенту. Для элементарной реакции порядок совпадает со стехиометрическим коэффициентом данного вещества (и должен быть положительным, целочисленным и не превышать двух). Сумма показателей степени для концентраций реагентов – суммарный порядок. Для элементарной реакции суммарный порядок совпадает с молекулярностью (числом молекул реагентов, участвующих в элементарной реакции) и не превышает двух. Одновременное столкновение более двух
молекул – маловероятно. |
|
|
||
Сложные |
по |
механизму |
реакции |
включают |
несколько элементарных реакций. На энергетической диаграмме сложной по механизму реакции (1.16), (1.17) будет соответствовать кривая потенциальной энергии с несколькими минимумами и максимумами
(рис. 1.2)
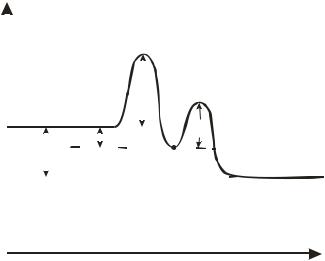
14 |
|
A B X |
(1.16) |
X C P |
(1.17) |
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
A + В + С |
|
|
|
Ea,1 |
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ea,2 |
|
|
|||||||||||||||||||||
|
|
|
H |
|
|
|
|
H1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х + С |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Координата реакции
Рис. 1.2. Энергетическая диаграмма сложной по механизму реакции (Х – промежуточный продукт).
Скорость сложной по механизму реакции часто можно описать эмпирическим уравнением, по форме совпадающим с уравнением закона действия масс (например, 1.14). Но в случае сложной по механизму реакции порядки по реагентам могут быть нецелочисленными, переменными, отрицательными, большими по абсолютной величине.
С точки зрения организации ХТП кинетические порядки основной и побочных реакций по реагентам важны, так как они отражают степень чувствительности скоростей образования целевых и побочных продуктов (а, следовательно, и показателей процесса, см. ниже) к изменению концентраций (парциальных давлений) веществ – участников ХТП. Чем выше порядок по данному веществу, тем сильнее влияет изменение его концентрации на скорость.
Зависимость наблюдаемой константы скорости (kэфф) от температуры может описываться уравнением, по форме совпадающим с уравнением Аррениуса, но
15
значения предэкспоненты и энергии активации могут быть любыми (в отличие от определенного диапазона значений этих параметров, характерных для элементарных реакций). Например, наблюдаемая
энергия активации сложной |
реакции |
может |
быть |
отрицательна, т.е. скорость |
сложной |
реакции |
может |
уменьшаться с увеличением температуры из-за |
того, |
||
что в kэфф входят константы равновесия экзотермических стадий (реакций), значения которых уменьшаются с увеличением температуры.
С технологической точки зрения знак и величина наблюдаемой энергии активации отражают чувствительность скоростей реакций ХТП к изменению температуры. Чем больше наблюдаемая энергия активации данной реакции, тем сильнее влияет изменение температуры на скорость этой реакции. Скорость реакции, имеющей более высокое положительное значение энергии активации, растет быстрее при увеличении температуры, чем скорость реакции с меньшей величиной Еа. При понижении температуры быстрее уменьшается скорость реакции, имеющей большую энергию активации.
В подавляющем большинстве промышленных ХТП используют катализаторы. Функция катализатора – селективное ускорение основной реакции. Как правило, катализатор обеспечивает возможность снижения наблюдаемой энергии активации и, вследствие этого, ускорение основной реакции при той же температуре или возможность снизить температуру (и тем самым подавить побочные реакции) при сохранении приемлемого значения скорости образования целевого продукта.
Тип |
катализатора |
и |
его |
характеристики |
|||
определяют, |
как |
правило, |
выбор |
условий |
и |
||
показатели ХТП. В связи с этим ХТП делят на каталитические и некаталитические. А каталитические ХТП подразделяют в зависимости от
16
типа используемого катализатора на гомогеннокаталитические (катализатор находится в той же газовой или, чаще, жидкой фазе, в которой находятся реагенты и протекает каталитический процесс) и гетерогенно-каталитические. В гетерогенно-каталитических процессах используют твердые (гетерогенные) катализаторы, а реагенты находятся в газообразном или жидком состоянии. Процесс протекает на поверхности катализатора.
Для способа организации ХТП важна фазовая характеристика системы, в которой протекает ХТП. С
этой точки зрения системы делят на гомофазные (все вещества находятся в одной фазе, отсутствуют границы раздела фаз) и гетерофазные (система, в которой протекает ХТП, включает хотя бы одну границу раздела фаз). Границей раздела фаз может быть поверхность твердого катализатора в газофазном или жидкофазном процессе. Поэтому все гетерогенно-каталитические процессы всегда протекают в гетерофазных системах, а гомогеннокаталитические могут реализоваться как в гомофазных, так и гетерофазных системах.
ХТП в гетерофазных системах часто осложняются процессами массо- и теплопереноса, поэтому для интенсификации процессов в таких системах необходимо выбирать условия с учётом этого обстоятельства.
1.2. Основные технологические критерии эффективности.
Для оценки качества ХТП используют количественные технологические показатели: степень превращения сырья, селективность образования и выход продукта, производительность реактора или установки, интенсивность работы реактора или катализатора, расходные коэффициенты по реагентам,
17
другим веществам (в ходе ХТП расходуются катализаторы, инерты и т.д.) и энергии. Эти показатели характеризуют степень совершенства ХТП.
Рассмотрим основные показатели на примере реакции (1.18), которую будем считать основной реакцией ХТП.
aA + bB = pP |
(1.18) |
1.2.1Степень превращения (степень конверсии)
реагента (Х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
Количества реагента могут быть выражены в единицах массы, молях, в мольных потоках (количество молей вещества, поступающее в реактор или выходящее из реактора в единицу времени) и, даже, в единицах объема, взятых при одинаковых условиях (температуре и давлении).
|
|
|
|
|
( − ) |
|
|
|
( |
− ) |
|
|
||
|
|
= |
|
|
; |
= |
|
|
|
|
|
(1.19) |
||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
|
|
|
и |
GA |
- |
массы |
введенного |
и |
||||
|
|
|
GA |
|
|
|
|
|
|
|
|
|||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
непрореагировавшего реагента А, соответственно; |
|
|||||||||||||
N A |
и N A |
– те же величины, выраженные в молях. |
|
|||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если объем реакционной системы остается |
|||||||||||||
постоянным |
в ходе |
ХТП, то |
|
во |
всех |
расчетах |
||||||||
количества |
|
веществ |
|
могут |
|
быть |
|
заменены |
их |
|||||
молярными |
|
|
концентрациями. |
|
При |
|
использовании |
|||||||
формул (1.19) степень превращения получают в долях
|
|
|
18 |
|
единицы. |
Умножив полученное значение на сто |
|||
процентов, получим |
величину Х в процентах. |
|||
1.2.2 |
Выходом |
продукта по данному |
реагенту |
|
называют |
отношение |
количества |
реагента, |
|
превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
Эквивалентная формулировка: - Выход продукта
по данному реагенту – это отношение количества продукта, полученного практически, к количеству этого продукта, которое должно быть получено из
введенного количества |
данного реагента в |
соответствии с уравнением реакции. |
|
Обе формулировки |
выражаются одной формулой. |
Для уравнения (1.18) выходы продукта Р на реагенты А и В выражаются формулами (1.20):
|
|
|
|
|
= |
∙ |
; |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1.20) |
|
|
|
|
|
|
∙ |
|
|
|
|
|
|
|
|
= |
|
|
, |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
∙ |
|
||
|
|
|
|
|
|
|
|
|
|
|
где N |
, N A |
и NB |
количества молей |
продукта |
||||
|
|
P |
0 |
0 |
|
|
|
|
|
Р, |
полученное |
в |
реакции |
(1.18), и реагентов А и |
|||||
В, |
введенные |
в |
|
реакционную |
систему, |
||||
соответственно, а, b и p – стехиометрические коэффициенты реакции (1.18).
Для уточнения связи формулы (1.20) с двумя формулировками определения выхода перепишем ее для реагента А в двух видах: (1.21) – для первой формулировки, (1.22) – для второй.

19
|
|
|
|
|
|
∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
= |
|
|
|
|
|
|
(1.21) |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
(1.22) |
||||
|
|
|
|
∙ |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
Выражение |
( |
∙ |
|
) |
в формуле |
(1.21) – это |
||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
количество |
молей |
|
реагента |
|
|
|
|
А, |
из которого |
|||
образуется NP молей продукта Р в соответствии с уравнением (1.18) и т.д.
Выход можно рассчитывать для каждого из
продуктов |
по |
любому |
из реагентов (а если |
необходимо, |
то |
и по |
всем реагентам основной |
реакции). Чаще выход рассчитывают для наиболее ценного (целевого) продукта на наиболее дорогой из реагентов.
Например, в синтезе метанола из синтез-газа наряду с основной (1.23) идут побочные реакции
(1.24 - 1.26).
СО + 2Н2 = СН3ОН |
(1.23) |
|
2СО + 2Н2 = СН4 + СО2 |
(1.24) |
|
СО + 3Н2 = СН4 + Н2О |
(1.25) |
|
2СН3ОН = СН3ОСН3 + Н2О |
(1.26) |
|
Выход метанола (ηCH3OH) |
в |
соответствии со |
стехиометрией уравнения |
(1.23) по оксиду |
|
углерода(II) рассчитывают по формуле (1.27), а по водороду – по формуле (1.28).
=
=
|
|
|
(1.27) |
∙ (1.28)
20
где |
|
– |
полученное количество |
молей |
||
|
|
|
|
|
||
|
|
|
|
|
|
|
метанола, |
|
и |
|
– введенные в |
систему |
|
|
|
|
|
|
|
|
количества молей СО и Н2.
Аналогичным образом может быть рассчитан выход по каждому из побочных продуктов. Очевидно, что практический выход не может превышать равновесный выход при условиях проведения процесса.
Для процессов, в которых нельзя выделить одну стехиометрическую реакцию образования целевого продукта и поэтому нельзя рассчитать выход описанным способом, определяют показатель, который также называют выходом или массовым выходом и который представляет собой отношение массы полученного продукта к массе затраченного сырья. Например, выход этилена для процесса пиролиза фракций нефти находят как отношение массы этилена
кмассе поступившей в реактор фракции нефти.
1.2.3Селективность – важнейший показатель сложного ХТП, характеризующий эффективность превращения сырья в целевой продукт.
Селективность образования продукта по реагенту (φ) – это отношение количества этого реагента, превратившегося в продукт, к общему количеству превратившегося реагента.
В отличие от выхода, селективность учитывает только превратившийся реагент, поэтому этот показатель более чувствителен к соотношению различных направлений химического превращения. Для реакции (1.18) селективность образования продукта Р по реагентам А и В выразится формулами (1.29) и (1.30), в знаменателе которых, в отличие от формул для выхода (1.21) и (1.22), количество превращенного реагента. Символом N обозначены
