
охт (6sem) / методички митхт / GCT practicum 2013
.pdf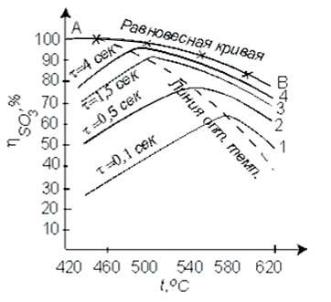
91
400°С. Для обеспечения и высокой интенсивности процесса, и высокого выхода необходимо проводить окисление оксида серы (IV) при переменных условиях (режим работы по Линии Оптимальных Температур - ЛОТ).
На рис.2.3.3 приведен график зависимости равновесного и практического выхода от температуры при различных временах контактирования. С увеличением времени контактирования максимум на кривых смещается в сторону более низких температур. Кривую, соединяющую максимумы на различных кривых, называют линией оптимальных температур.
ЛОТ – в данном случае это режим проведения процесса с понижением температуры и увеличением времени контактирования. При проведении процесса по линии оптимальных температур окисление оксида серы(IV) протекает с максимально возможными скоростями в каждый момент. Понижение температуры к концу процесса с 600 до 400°С позволяет получить высокий выход продукта при достаточной производительности процесса. Схема организации этого процесса приведена на рис.2.3.4
Рис.2.3.3 |
Зависимость |
выхода |
продукта |
η |
от |
температуры при различном времени контактирования. |
|
||||
92
Соотношение исходных компонентов. Состав исходной газовой смеси также влияет на величину равновесного выхода и скорость окисления (Табл. 2.3.2). Процесс ведут с избытком кислорода относительно стехиометрического. При этом возрастает скорость процесса и увеличивается равновесный выход продукта.
Таблица 2.3.2 Зависимость равновесного выхода η* от состава исходной газовой смеси.
Состав газа, |
Объемное |
Равновесный |
|
% объемн. |
отношение |
выход |
|
|
|
O 2 : SO2 |
η* |
|
|
|
(при 475°С и |
О2 |
SO2 |
|
|
|
0,1 МПа) |
||
|
|
|
|
|
|
|
|
16,7 |
3,0 |
5,57 |
97,16 |
13,9 |
5,0 |
2,78 |
96,75 |
11,0 |
7,0 |
1,57 |
96,07 |
8,15 |
9,0 |
0,9 |
94,61 |
5,5 |
11,0 |
0,5 |
92,20 |
|
|
|
|
Газ, поступающий в реакционный аппарат, предназначенный для окисления SO2, имеет примерный состав: 7% SO2, 11% О2 и 82% N2. При таком соотношении О2 и SO2 окисление оксида серы(IV) протекает достаточно полно и автотермично за счет тепла, выделяющегося в ходе окисления, что облегчает создание оптимального температурного режима в первом слое катализатора; при более высокой концентрации SO2 (8 - 8,5%) перегрев катализатора может привести его к дезактивации. Дальнейшее увеличение отношения О2 к SO2 путем разбавления газа воздухом при незначительном увеличении выхода приводит к снижению концентрации
93
SO2 в газе и к увеличению объема поступающего на контактирование газа.
Объемное отношение О2 к SO2 может быть увеличено путем разбавления поступающего (из
реактора |
для окисления серы |
или из |
обжиговых |
печей, |
в которых обжигают |
колчедан) |
газа |
воздухом, обогащенным кислородом. Это значительно интенсифицирует процесс, но удорожает и усложняет его.
Давление. В зависимости от выбранной температуры эффективность воздействия давления различна. При низких температурах, когда равновесные степени превращения оксида серы(IV) высоки, давление незначительно сказывается на смещении равновесия (Табл.2.3.3). При высоких
температурах, когда |
окисление |
происходит |
далеко |
|
не |
полностью, |
давление |
может стать |
одним |
из решающих факторов, обеспечивающих высокую
степень превращения. |
|
|
|
При |
применении |
повышенного |
давления |
уменьшаются объемы перерабатываемых газов и, следовательно, размеры аппаратов; увеличивается степень превращения и улучшается кинетика процесса; снижается металлоемкость и сокращаются производственные площади; появляется возможность концентрирования энергии и ее утилизации. Все это имеет большое значение для агрегатов большой единичной мощности.
Но применение повышенного давления ведет к усложнению аппаратуры, более высоким энергетическим затратам. Поэтому выбор давления определяется оптимизацией на основе экономических критериев эффективности процесса.
Внастоящее время в промышленности процесс
окисления SO2 в SO3 проводится при атмосферном давлении.
94
Зависимость равновесного выхода SO* |
3 |
от температуры |
|||||
|
|
|
|
|
|
|
|
|
|
при различном давлении |
|
||||
|
|
|
|
|
|
|
|
t,°C |
Равновесный выход SO3 % при давлении |
||||||
|
|
|
|
|
|
|
|
|
0,1 |
0,5 |
1 |
2.5 |
|
5,0 |
10,0 |
400 |
99,2 |
99,6 |
99,7 |
99,9 |
|
99,9 |
99,9 |
500 |
93,8 |
96,9 |
97,9 |
98,6 |
|
99,0 |
99,3 |
600 |
73,4 |
85,8 |
89,5 |
93,3 |
|
95,0 |
96,4 |
|
|
|
|
|
|
|
|
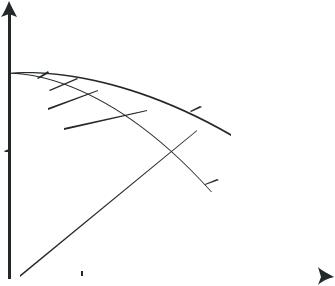
Организация проведения процесса по ЛОТ.
Конструкция контактного аппарата должна обеспечивать возможность проведения каталитического окисления оксида серы(IV) в условиях оптимального технологического режима.
Вданном случае особенно важно обеспечить
снижение температуры по высоте аппарата от первого слоя к последнему в соответствии с линией оптимальных температур (рис.2.3.4).
|
100 |
8 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
Равновесная |
|||
|
|
|
|
|
|
|
|
||||
|
|
5 |
|
|
4 |
|
|||||
,% |
80 |
|
|
|
|
|
|
6 |
|
кривая |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
3 |
|
|
|
||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
SO |
60 |
|
|
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
||||
|
1 |
|
ЛОТ |
||||
40 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
400 |
500 |
600 |
|||||
t,oC
Рис.2.3.4 Диаграмма η – t пятиступенчатого процесса контактирования с промежуточным теплообменом.
95
Исходный газ, поступающий в контактный аппарат, нагревают до температуры, несколько превышающей температуру зажигания ванадиевого катализатора (400 - 440°С) и направляют в первый катализаторный слой. Процесс окисления проводится как в первом слое, так и в последующих, в адиабатическом
режиме |
(без |
отвода тепла) - прямые 1, 3, 5, |
||||
7, 9. |
|
При |
окислении SO2 |
|
выделяется |
|
тепло, |
за |
счет |
|
которого |
|
повышается |
температура |
газовой |
смеси |
по |
линейной |
||
зависимости. Угол наклона прямой при этом зависит от концентрации SO2, поскольку с увеличением концентрации SO2 выделяется больше тепла и, следовательно, в большей степени повышается температура. В первом слое (прямая 1) процесс окисления ведут таким образом, чтобы температура газовой смеси на выходе не превышала предельную температуру активности катализатора. Затем, перед поступлением на второй и последующие слои
катализатора, |
газовая |
смесь |
охлаждается |
в |
выносных теплообменниках |
– линии 2, 4, 6, |
8. |
||
Выход при этом остается постоянным. На рис. 2.3.4 видно, что при проведении процесса в неподвижном слое катализатора наблюдается значительное отклонение состояния системы от линии оптимальных температур, которое допускается в промышленности
не более чем на 20%. |
|
|
|
При |
проведении |
процесса в |
псевдоожиженном |
слое |
катализатора |
скорость |
теплоотдачи |
возрастает. Движение в кипящем слое не только потока газов, но и твердых частиц дополнительно способствует выравниванию температуры по всему слою. Это позволяет проводить реакцию в каждом слое при практически постоянной температуре, т.е. при более «правильном» температурном режиме, чем
вслучае неподвижного слоя. Соответственно и
отклонения от линии оптимальных температур меньше.
96
Газ, поступая из одного слоя в другой, быстро принимает температуру данного слоя. Избыточное тепло - тепло реакции и физическое тепло поступающего газа - отводится помещенными в слои катализатора теплообменниками. Однако, эти аппараты не нашли широкого применения из-за большого уноса катализатора и запыления газа.
2.3.5. Расчетная часть.
Исходные данные
Расход воздуха при лабораторных
условиях |
|
_____мл/мин |
|
Объемная концентрация оксида |
серы (IV) |
||
в исходном газе (А), % |
|
_____ |
|
Объемная концентрация оксида |
серы (IV) |
||
в газе после контактирования |
(В),% |
||
при разных температурах |
|
|
|
контактирования (Табл.2.3.4) |
|
|
|
|
|
Таблица 2.3.4 |
|
Зависимость концентрации оксида серы(IV) в газе |
|||
после контактирования от температуры |
|||
|
|
|
|
t, C0 |
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура в лаборатории |
_____оС |
|
Барометрическое |
давление |
_____мм рт.ст. |
Объем катализатора |
_____мл |
|
Доля свободного |
объема катализатора |
_____ |
97
Порядок расчета.
1.По заданному расходу воздуха и значению
объемной концентрации |
оксида |
серы (IV) (А) |
|||
по пропорции |
рассчитывают |
расход |
оксида |
||
серы(IV), л. |
|
|
|
|
|
2. |
Приводят расходы |
воздуха |
и |
оксида |
|
серы(IV) из лабораторных условий к н.у. |
|||||
3. |
По формуле, приведенной в приложении, |
||||
рассчитывают |
степень |
превращения |
оксида |
||
серы(IV) (Х) при заданных температурах.
4.Для наибольшего значения степени
превращения Х |
рассчитывают |
материальный |
|||||
баланс процесса (Табл.2.3.6). |
|
|
|||||
5. |
Для |
трех |
|
температур, |
указанных |
||
преподавателем, |
рассчитывают: |
W - объемную |
|||||
скорость; |
|
- |
время контактирования |
||||
исходных |
веществ |
в |
реакционной |
зоне; |
|||
I |
- интенсивность |
работы |
катализатора; |
||||
|
- |
расходные |
коэффициенты по |
сырью |
|||
(Табл. 2.3.7).
2.3.6. Расчет материального баланса.
Базис для составления материального баланса задается преподавателем. Количество поступающих веществ можно рассчитать, зная расходы воздуха и оксида серы (IV). Количество полученных веществ рассчитывают по уравнению реакции с учетом степени превращения (приложение).
2.3.7.Задание.
1.Рассчитать степень превращения оксида серы (IV) в оксид серы (VI).
2.Построить графические зависимости от
температуры |
равновесной |
(табл. |
2.3.1) |
и |
практической |
степени превращения |
оксида |
серы |
|
(IV).
3. Рассчитать материальный баланс и основные технологические показатели процесса.
98
Таблица 2.3.6
Материальный баланс контактного аппарата для окисления оксида серы (IV)
Базис расчета______
Приход |
|
Расход |
|
||||
|
|
|
|
|
|
|
|
Наименование |
л |
г |
% |
Наименование |
л |
г |
% |
|
н.у. |
|
масс |
|
н.у. |
|
масс |
|
|
|
|
|
|
|
|
Оксид серы (IV) |
|
|
|
Оксид серы (VI) |
|
|
|
Воздух: |
|
|
|
Оксид серы (IV) |
|
|
|
кислород |
|
|
|
кислород |
|
|
|
азот |
|
|
|
азот |
|
|
|
|
|
|
|
Невязка |
|
|
|
|
|
|
|
|
|
|
|
Всего |
|
|
100 |
Всего |
|
|
100 |
|
|
|
|
|
|
|
|
Таблица 2.3.7
Показатели процесса окисления оксида серы (IV)
Т,К |
A, |
B, |
X, |
W, |
,с |
I, |
стех |
практ |
|
% об. |
% об. |
% |
м3/м3 ч |
|
кг/ч м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

99
|
|
|
Приложение |
|
Расчёт степени превращения SO2 в SO3 |
|
|||
(степени контактирования). |
|
|||
При расчете точной степени превращения |
SO2 в |
|||
SO3 необходимо учитывать изменение числа молей при |
||||
протекании реакции. |
|
|
|
|
Если содержание SO2 в газовой смеси до и после |
||||
контактирования |
в |
мольных |
долях |
равно |
соответственно а и b, а степень превращения Х, то число молей SO3, образовавшегося из 1 моля газовой смеси, поступающей на контактирование, равно аХ, а число молей непрореагировавшего SO2 а(1-Х). При этом в соответствии со стехиометрией реакции число
aХ
молей прореагировавшего кислорода составит 2 .
Количество газовой смеси, остающейся после контактирования, в молях:
1 a2Х
Следовательно, мольная доля SO2 в газовой смеси после контактирования
b a( 1 Х ) |
(2.3.7) |
||||||||
|
|
1 |
aХ |
|
|||||
|
|
|
|
||||||
|
|
|
|
|
|
||||
|
2 |
|
|
|
|||||
Из уравнения 2.3.7 выразим степень превращения SO2 |
|||||||||
(в долях единицы): |
|
|
|
|
|
|
|
|
|
Х |
|
a b |
|
||||||
|
|
|
|
|
|
|
(2.3.8) |
||
a( 1 |
b |
) |
|||||||
|
|||||||||
|
|
||||||||
|
|
|
|||||||
|
2 |
|
|
|
|
||||
Поскольку в реальных условиях исходная концентрация SO2 не превышает 10%, величина

100
изменения числа молей не превышает 0,05 и для
приблизительных расчетов ею можно пренебречь. В этом случае уравнение (2.3.7) преобразуется к обычному виду (см. гл. I), характерному для процессов при постоянном объеме:
= |
− |
(2.3.9) |
||
|
|
|||
|
|
|||
Аналогичное уравнение справедливо и при использовании объемных процентов оксида серы(IV) в исходном газе и в газе после контактирования:
=
−
Библиографический список 1. Васильев В.Т., Отвагина М.И. Технология
серной кислоты. М.: Химия. 1985. - 385 с.
2.Кутепов А.М. и др. Общая химическая технология. Учебник для вузов.3-е изд. – М.: ИКЦ
«Академкнига», 2003. - 528 с.
3.Кутепов А.М. и др. Общая химическая
технология. Учебник для технических вузов. 2-е изд. – М.: Высшая школа, 1990 - 520 с.
