
1. Лекции Термодинамика (УЭИ)
.pdf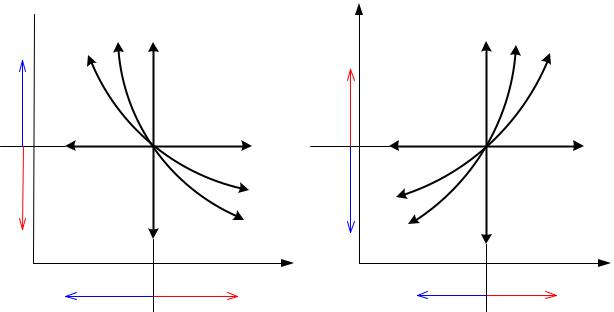
80
На рисунке 5.7 изображены все основные термодинамические процессы, проходящие через одну общую центральную точку. А бесконечно большое количество остальных политропных процессов будет расположено между основными процессами. Все эти процессы подчиняются уравнению
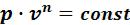 .
.
P
lрасп > 0 lрасп < 0
|
|
|
T |
n=k |
n=±∞ |
|
n=k |
|
|
c=0 |
c=cv |
|
|
n=±∞ |
|
|
n=0 |
|||
n=1 |
|
|
|
|
||
|
|
|
|
c<0 |
|
c=cp |
|
|
|
u > 0 h > 0 |
n=1 |
|
n=1 |
n=0 |
n=0 |
|
D D |
|
||
|
c=∞ |
|
c=∞ |
|||
|
n=1 |
|
0 0 |
n=0 |
|
|
|
|
|
|
|
|
|
|
|
|
u < h < |
c=cp |
|
|
|
|
|
|
|
c<0 |
|
|
|
|
D D |
|
|
|
n=±∞ |
n=k |
|
|
n=±∞ |
n=k |
|
|
|
c=0 |
|
|||
|
|
|
|
c=cv |
|
|
|
|
|
|
|
|
|
lтерм < 0 |
lтерм > 0 |
v |
|
q < 0 |
q > 0 |
s |
|
|
|
Рисунок 5.7 – Политропные процессы
• - диаграмма. На
- диаграмма. На  - диаграмме адиабата (
- диаграмме адиабата (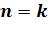 ) проходит круче изотермы (
) проходит круче изотермы (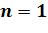 ) , т.к.
) , т.к. 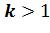 . Т.е. при адиабатном расширении давле-
. Т.е. при адиабатном расширении давле-
ние понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Изохора ( ) делит все поле диаграммы на две области:
) делит все поле диаграммы на две области:
процессы расширения газа, которые на 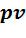 - диаграмме расположены правее изохоры. Они характеризуются положительной термодинамической работой
- диаграмме расположены правее изохоры. Они характеризуются положительной термодинамической работой  .
.
процессы сжатия газа, которые на 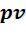 - диаграмме расположены левее изохоры. Они характеризуются отрицательной термодинамической работой
- диаграмме расположены левее изохоры. Они характеризуются отрицательной термодинамической работой 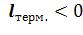 .
.
Изобара (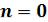 ) также делит все поле диаграммы на две области:
) также делит все поле диаграммы на две области:
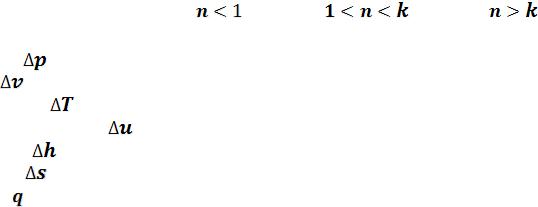
81
процессы с понижением давления газа, которые на 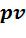 - диаграмме расположены ниже изобары. Они характеризуются положительной располагаемой работой
- диаграмме расположены ниже изобары. Они характеризуются положительной располагаемой работой 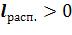
процессы с повышением давления газа, которые на 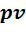 - диаграмме расположены выше изобары. Они характеризуются отрицательной располагаемой работой
- диаграмме расположены выше изобары. Они характеризуются отрицательной располагаемой работой 
•Ts- диаграмма. На Ts- диаграмме изохора ( ) проходит круче
) проходит круче
изобары (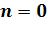 ), т.к.
), т.к.  .
.
Адиабата (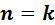 ) делит все поле диаграммы на две области:
) делит все поле диаграммы на две области:
процессы, идущие с подводом теплоты ( ), которые на Ts-
), которые на Ts-
диаграмме расположены правее адиабаты.
процессы, идущие с отводом теплоты (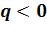 ). Они на Ts-диаграмме расположены левее адиабаты.
). Они на Ts-диаграмме расположены левее адиабаты.
Изотерма ( ) также делит поле диаграммы на две области:
) также делит поле диаграммы на две области:
процессы с повышением температуры газа, которые на Ts-диаграмме расположены выше изотермы. Они характеризуются возрастанием внутренней энергии и энтальпии.
процессы с понижением температуры газа на Ts-диаграмме расположены ниже изотермы. Они характеризуются уменьшением внутренней энергии и энтальпии.
Все политропные процессы при расширении можно разделить на три группы по значению 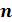 (таблица 5.3):
(таблица 5.3):
Таблица 5.3 – Изменение основных параметров и функций состояния в политропных процессах
Изменение величины |
|
|
|
|
|
|
|
сжатие |
расш-е |
сжатие |
расш-е |
сжатие |
расш-е |
||
|
|||||||
Давление |
+ |
- |
+ |
- |
+ |
- |
|
Объем |
- |
+ |
- |
+ |
- |
+ |
|
Температура |
- |
+ |
+ |
- |
+ |
- |
|
Внутренняя энергия |
- |
+ |
+ |
- |
+ |
- |
|
Энтальпия |
- |
+ |
+ |
- |
+ |
- |
|
Энтропия |
- |
+ |
- |
+ |
+ |
- |
|
Теплота |
- |
+ |
- |
+ |
+ |
- |

82
Термодинамическая ра- |
- |
|
+ |
|
- |
|
+ |
- |
+ |
|
бота |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Располагаемая работа |
- |
|
+ |
|
- |
|
+ |
- |
+ |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Теплоемкость |
|
+ |
|
+ |
|
- |
|
- |
+ |
+ |
I группа |
: Это процессы, расположенные над изотермой. Они про- |
|||||||||
ходят с увеличением температуры ( |
|
), а, следовательно, и увеличением |
||||||||
внутренней энергии ( |
|
|
) |
и энтальпии ( |
|
|
). |
|||
Здесь энтропия увеличивается ( |
|
|
) и, значит, теплота подводится |
|||||||
(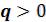 ). Соответственно теплоемкость процесса
). Соответственно теплоемкость процесса  . Согласно I-му за-
. Согласно I-му за-
кону термодинамики теплота, подведенная к газу, расходуется на увеличение внутренней энергии и на совершение им работы расширения 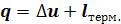 .
.
II группа |
: Это процессы, расположенные между изотермой и |
|
адиабатой. Они проходят с уменьшением температуры ( |
), а, следова- |
|
тельно, и уменьшением внутренней энергии ( |
) и энтальпии |
|
(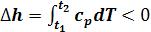 ).
).
Энтропия в этих процессах также увеличивается (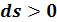 ) и, значит, теплота подводится (
) и, значит, теплота подводится (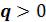 ). Соответственно теплоемкость процесса
). Соответственно теплоемкость процесса 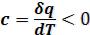
(см. рисунок 6). Термодинамические процессы второй группы характерны тем, что работа расширения совершается как за счет подведенной к газу теплоты, так и за счет внутренней энергии 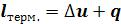 .
.
III группа |
:. Это процессы, расположенные внизу между адиаба- |
||||
той и изохорой. Они проходят с уменьшением температуры ( |
), а, следо- |
||||
вательно, и уменьшением внутренней энергии ( |
) и энтальпии ( |
). |
|||
Здесь энтропия уменьшается ( |
) и, значит, теплота отводится ( |
). Со- |
|||
ответственно теплоемкость процесса  .
.
В процессах этой группы расширение газа происходит с уменьшением его внутренней энергии и отдачей теплоты в окружающую среду 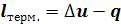 .
.
При сжатии газа все политропные процессы делятся на те же группы, но с противоположными знаками у параметров состояния и теплоты. Теплоемкость процесса в каждой группе, естественно, будет иметь те же знаки, как и при расширении газа (таблица 5.3).
Вопросы для самопроверки
27. Дать определения основным термодинамическим процессам.
83
28.Написать уравнения основных процессов.
29.Написать формулы соотношений между параметрами 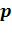 ,
,  и Т для каждого про-
и Т для каждого про-
цесса.
30.Объяснить увеличение температуры при расширении газа в изобарном процессе.
31.Доказать, что в изобарном процессе теплота равна изменению энтальпии.
32.Написать формулы работы изменения объема газа для каждого процесса.
33.Написать формулы располагаемой (полезной) работы для каждого процесса.
34.Почему в адиабатном процессе расширения тела температура убывает, а при сжатии увеличивается?
35.Каково взаимное расположение изотермы и адиабаты на 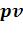 – диаграмме, прове-
– диаграмме, прове-
денных из одной точки при расширении и при сжатии газа?
36.Как графически изображаются на  – и Ts--диаграммах изохора, изобара, изо-
– и Ts--диаграммах изохора, изобара, изо-
терма и адиабата?
37.Какой процесс называется политропным?
38.Написать уравнение политропы и указать, в каких, пределах изменяется показатель политропы.
39.Каковы значения показателя политропы для основных процессов?
40.Написать уравнение теплоемкости политропного процесса и показать, что из данного уравнения можно получить теплоемкости при всех основных термодинамических процессах.
41.В каких политропных процессах внутренняя энергия уменьшается, и в каких увеличивается? Показать на 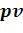 – и Ts- диаграммах.
– и Ts- диаграммах.
42.В каких политропных процессах теплота к газу подводится, и в каких процессах отводится?
43.В каких, политропных процессах и почему теплоемкость будет отрицательной? Что это означает?
44.По каким уравнениям вычисляется изменение энтропии в изохорном, изобарном, изотермном, адиабатном и политропном процессах?
Рекомендуемая литература:
Основная
13.Нащокин В. В. Техническая термодинамика и теплопередача. – М.: Высшая шко-
ла, 1980. – Гл.7.
14.Техническая термодинамика: учебник для вузов/ В.А. Кириллин, В.В. Сычев, А.Е. Шейндлин. – 4-е изд., перераб. - М.: Энергоатомиздат, 1983. -Гл. 7, пп. 7.1-7.5.
15.Баскаков А. П., Берг Б.В., Витт О.К. и др. Теплотехника: учебник для вузов. 2-е изд., перераб. – М.: Энергоатомиздат, 1991. – Гл.4, п.4.1.
Дополнительная
14.Луканин В.Н., Шатров М.Г., Камфер Г.М. и др. Теплотехника: учебник для вузов. - М.: Высшая школа, 1999. - Гл.2, п.2.1.
15.Техническая, термодинамика: Учебник для вузов / Под ред. В.И. Крутова - 2-е изд., перераб, и доп. - М.: Высш. школа, 1981. – Гл.8, §§ 44-49.

84
6 РЕАЛЬНЫЕ ГАЗЫ
6.1 Свойства реальных газов
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой силами взаимодействия, которые имеют электромагнитную и квантовую природу. Эти силы существуют между любыми молекулами при любых условиях и уменьшаются с увеличением расстояния между молекулами. При сближении молекул на малые расстояния силы притяжения резко уменьшаются и переходят в силы отталкивания, достигающие очень больших значений.
Из-за наличия сил взаимодействия между молекулами и конечности их объема законы идеальных газов не могут быть строго применимы к реальным газам. Отступления от законов идеальных газов носят как количественный, так и качественный характер. Количественные отступления проявляются в том, что уравнение Клапейрона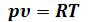 (2.13) соблюдается для реальных газов только приближенно.
(2.13) соблюдается для реальных газов только приближенно.
Качественные отступления носят более глубокий характер. Реальные газы могут быть переведены в жидкое и твердое состояние. Это было бы невозможно, если бы газы строго следовали уравнению Клапейрона.
6.2 Коэффициент сжимаемости
При практических расчётах различных свойств реальных газов находит широкое применение величина Z, которая получила название коэффициента
сжимаемости:
Так как для идеальных газов при любых условиях 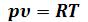 и Z = 1, то величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина Z для реальных газов в зависимости от давления и температуры может принимать значения больше и меньше единицы, и только при очень малых давлениях и высоких температурах она практически равна единице.
и Z = 1, то величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина Z для реальных газов в зависимости от давления и температуры может принимать значения больше и меньше единицы, и только при очень малых давлениях и высоких температурах она практически равна единице.
На рисунке 6.1 представлены коэффициенты сжимаемости для некоторых реальных газов как функции давления при 298 К (для сравнения поведение идеального газа показано пунктиром). При высоких давлениях для всех газов Z > 1, т.е. их труднее сжать, чем идеальный газ, поскольку в этой области преобладают силы межмолекулярного отталкивания. Из рисунка видно, что при более низких давлениях для некоторых газов Z < 1, что объясняется преобладанием межмолекулярного притяжения.
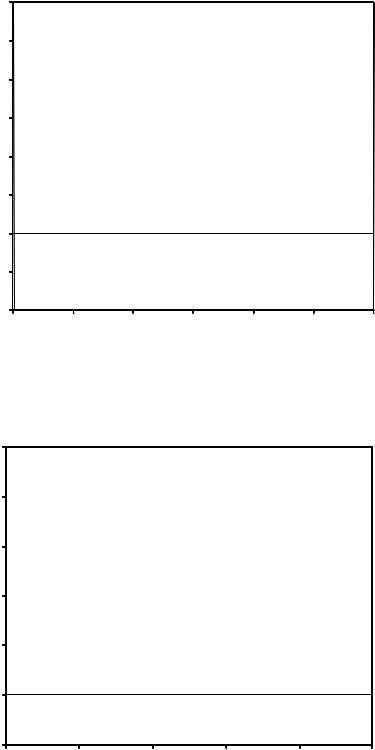
85
При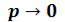 эффект межмолекулярного притяжения исчезает, потому что расстояние между молекулами стремится к бесконечности и для всех газов Z → 1. T.е., в этих условиях все газы ведут себя практически идеально.
эффект межмолекулярного притяжения исчезает, потому что расстояние между молекулами стремится к бесконечности и для всех газов Z → 1. T.е., в этих условиях все газы ведут себя практически идеально.
Коэффициент сжимаемости Z
2,2 |
|
|
2 |
|
|
1,8 |
CH4 |
|
|
||
1,6 |
N2 |
|
|
||
1,4 |
He |
|
|
||
1,2 |
H2 |
|
O2 |
||
|
1
0,8
0,6
0 |
200 |
400 |
600 |
800 |
1000 |
1200 |
Давление, бар
Рисунок 6.1 – Зависимость коэффициента сжимаемости Z некоторых газов от давления
Коэффициент сжимаемости Z
2
-50оС 0оС
1,8
100оС
1,6
300оС
1,4
1,2
1
0,8
0 |
200 |
400 |
600 |
800 |
1000 |
Давление, бар
Рисунок 6.2 – Зависимость коэффициента сжимаемости азота от давления при различных температурах

86
На рисунке 6.2 представлены коэффициенты сжимаемости для азота при разных температурах. По мере уменьшения температуры эффект межмолекулярного притяжения увеличивается (что проявляется в образовании минимума на кривых в области давлений около 100 бар). Минимум на кривых обнаруживается для всех газов, если температура достаточно низка. У водорода и гелия, имеющих очень низкие температуры кипения, этот минимум наблюдается только при температурах значительно ниже 0 оС.
Таким образом, свойства реальных газов как в количественном, так и качественном отношениях значительно отличаются от свойств идеальных газов. Повышение давления и понижение температуры, увеличение концентрации молекул газа и уменьшение расстояния между ними, усиливает отклонения свойств реального от свойств идеального газа. Поэтому все результаты, полученные для реальных газов на основе законов идеальных газов, нужно рассматривать как приближенные и справедливые при очень больших разрежениях
(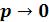 ).
).
Очевидно, что основными причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации–переходу в жидкое состояние.
6.3 Уравнение Ван-дер-Ваальса
Отличие свойств любого реального газа от свойств идеального заставило ученых разрабатывать новые уравнения состояния, которые связывали бы значения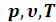 , и давали бы возможность рассчитывать некоторые свойства газов для разных условий, не прибегая к дорогостоящим, не всегда доступным прямым измерениям.
, и давали бы возможность рассчитывать некоторые свойства газов для разных условий, не прибегая к дорогостоящим, не всегда доступным прямым измерениям.
Одной из первых и наиболее успешных попыток аналитически описать поведение реальных газов является уравнение Ван-дер-Ваальса, предложенное голландским физиком Я. Д. Ван-дер-Ваальсом (1873).Это уравнение наглядно показывает качественные особенности реальных газов и их отличие от идеальных.
В первом приближении Ван-дер-Ваальс ввел в своем уравнении две поправки, которые учитывают отклонение реального газа от идеального.
Первая поправка, зависит от объема самих молекул. Уравнение Клапейрона можно представить в виде
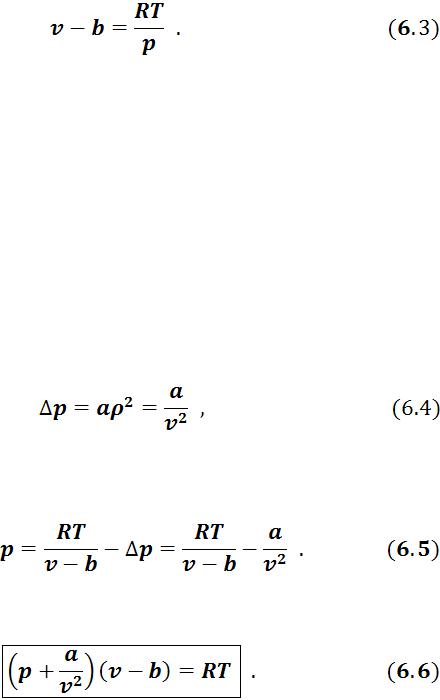
87
При увеличении давления объем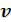 будет уменьшаться, и если
будет уменьшаться, и если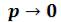 , то
, то 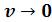 . Это полностью согласуется с определением идеального газа, в котором молекулы не имеют собственного объема.
. Это полностью согласуется с определением идеального газа, в котором молекулы не имеют собственного объема.
Если же рассматривать реальный газ, у которого молекулы занимают конечный объем, и учитывать объем зазоров между молекулами при их плотной упаковке, то свободный объем для движения молекул будет равен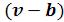 , где величина
, где величина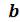 – это тот наименьший объем, до которого можно сжать газ.
– это тот наименьший объем, до которого можно сжать газ.
При этих условиях уравнение Клапейрона принимает другой вид:
Вторая поправка, вводимая в уравнение состояния, учитывает влияние, сил взаимодействия между молекулами.
Видеальном газе молекулы практически свободны в своем движении и удары о стенку сосуда ничем не ограничены, так как сил взаимодействия между молекулами не имеется.
Вреальном газе при наличии сил взаимодействия между молекулами сила ударов о стенку сосуда будет меньше, вследствие того, что все молекулы у стенки сосуда притягиваются соседними молекулами внутрь сосуда. Следовательно, и давление, оказываемое реальным газом по сравнению с идеальным,
будет меньше на величину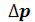 , котораяпредставляет поправку надавление, учитывающую силы взаимодействия между молекулами. Эта поправка
, котораяпредставляет поправку надавление, учитывающую силы взаимодействия между молекулами. Эта поправка
 прямо пропорциональнакак числу притягиваемых, так и числу притягивающих молекул, или прямо пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату его удельного объема:
прямо пропорциональнакак числу притягиваемых, так и числу притягивающих молекул, или прямо пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату его удельного объема:
где 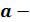 коэффициент пропорциональности, принимающий для каждого газа определенное числовое значение, не зависящее от параметров состояния.
коэффициент пропорциональности, принимающий для каждого газа определенное числовое значение, не зависящее от параметров состояния.
Вводя вторую поправку, получим
В окончательном виде уравнение Ван-дер-Ваальса выглядит следующим образом:
Величина  характеризует внутреннее давление газа или жидкости, появляющееся вследствие наличия сил притяжения между молекулами
характеризует внутреннее давление газа или жидкости, появляющееся вследствие наличия сил притяжения между молекулами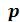 .
.
88
Величина 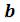 учитывает уменьшение объема, в котором движутся молекулы реального газа, за счет объема самих молекул и объема промежутков между молекулами при их плотной упаковке. Уравнение выведено в предположении, что молекулы газа являются сферически симметричными, и что
учитывает уменьшение объема, в котором движутся молекулы реального газа, за счет объема самих молекул и объема промежутков между молекулами при их плотной упаковке. Уравнение выведено в предположении, что молекулы газа являются сферически симметричными, и что 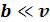 ;
; 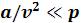 . При больших значениях
. При больших значениях 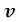 можно пренебречь обеими поправками и уравнение Ван-дер-Ваальса переходит в уравнение состояния идеального газа
можно пренебречь обеими поправками и уравнение Ван-дер-Ваальса переходит в уравнение состояния идеального газа
(2.13).
Наиболее содержательные результаты получаются из уравнения Ван-дер- Ваальса путем анализа его изотерм. Уравнение изотермы можно представить в виде:
Это уравнение третьей степени по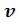 , в которое давление
, в которое давление 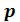 входит в качестве параметра. Поскольку его коэффициенты вещественны, уравнение имеет либо один вещественный корень, либо три корня. Каждому корню на – диаграмме соответствует точка, в которой изобара
входит в качестве параметра. Поскольку его коэффициенты вещественны, уравнение имеет либо один вещественный корень, либо три корня. Каждому корню на – диаграмме соответствует точка, в которой изобара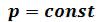 пересекает изотерму. В первом случае, когда корень один
пересекает изотерму. В первом случае, когда корень один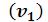 , и точка пересечения будет одна. Так будет при любых давлениях, если температура достаточно высока.
, и точка пересечения будет одна. Так будет при любых давлениях, если температура достаточно высока.
Изотерма имеет вид монотонно опускающейся кривой (на рисунке 6.3 изотермы T4 и T5,). При более низких температурах и надлежащих значениях давления 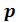 уравнение (6.7) имеет три корня
уравнение (6.7) имеет три корня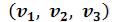 . В таких случаях изотерма имеет волнообразный участок. Она сначала монотонно опускается вниз (участок ac), затем на участке
. В таких случаях изотерма имеет волнообразный участок. Она сначала монотонно опускается вниз (участок ac), затем на участке 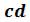 монотонно поднимается вверх, а за точкой
монотонно поднимается вверх, а за точкой 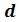 снова монотонно опускается.
снова монотонно опускается.
Изобара пересекает изотерму в трех точках (изотермы Т1 , Т2 и Т3 , рисунок 6.3). При достаточно низких температурах изотерма может заходить в область отрицательных давлений (изотерма Т1 , рисунок 6.3).
пересекает изотерму в трех точках (изотермы Т1 , Т2 и Т3 , рисунок 6.3). При достаточно низких температурах изотерма может заходить в область отрицательных давлений (изотерма Т1 , рисунок 6.3).
При некоторой промежуточной температуре три корня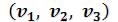 становятся равными. Такая температура и соответствующая ей изотерма называются критическими. Критическая изотерма TK всюду монотонно опускается вниз, за исключением одной точки К, являющейся точкой перегиба изотермы (изотерма ТК , рисунок 6.3). В ней касательная к изотерме горизонтальна.
становятся равными. Такая температура и соответствующая ей изотерма называются критическими. Критическая изотерма TK всюду монотонно опускается вниз, за исключением одной точки К, являющейся точкой перегиба изотермы (изотерма ТК , рисунок 6.3). В ней касательная к изотерме горизонтальна.
Точка К называется критической точкой. Соответствующие ей давление 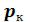 , объем
, объем 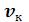 и температура TK называются также критическими. Говорят, что вещество находится в критическом состоянии, если его объем и давление (а, следовательно, и температура) равны критическим.
и температура TK называются также критическими. Говорят, что вещество находится в критическом состоянии, если его объем и давление (а, следовательно, и температура) равны критическим.
Не все состояния вещества, совместимые с уравнением Ван-дер-Ваальса, могут быть реализованы в действительности. Прежде всего, необходимо отбросить состояния с отрицательным абсолютным давлением. Кроме того, необходимо еще, чтобы состояния вещества были термодинамически устойчивы.
89
a2 a3
Р a1
v1
К |
|
T5 |
|
|
|
|
|
||
v1=v2=v3 |
|
T4 |
|
|
|
|
|
||
d3 |
d2 |
TK |
|
|
|
|
|||
c3 |
v3 |
T3 |
|
|
v1 |
|
|||
v2 |
d1 |
T2 |
f3 |
|
c2 |
T1 |
f2 |
||
|
||||
|
|
|
||
|
|
|
f1 |
|
c1 |
|
|
v |
|
|
|
|
Рисунок 6.3 – Изотермы Ван-дер-Ваальса
a2 a3
Р a1
жидкость |
2 |
c3 |
К |
|
|
|
|||
|
|
|
|
|
|
b3 |
|
d3 |
e3 |
|
|
|
|
|
|
b2 |
|
d2 |
|
|
|
|
|
|
|
жидкость |
d1 |
||
|
c2 |
|
+ |
|
b1 |
|
газ |
|
|
|
|
|
|
|
|
c1 |
|
|
|
3 |
|
|
T5 |
|
|
|
T4 |
|
газ |
TK |
|
|
e2 |
|
T3 |
|
|
|
T2 |
f3 |
|
1 |
T1 |
f2 |
|
|
|
|
|
e1 |
|
f1 |
v
Рисунок 6.4 – Изотермы реального газа
