
1. Лекции Термодинамика (УЭИ)
.pdf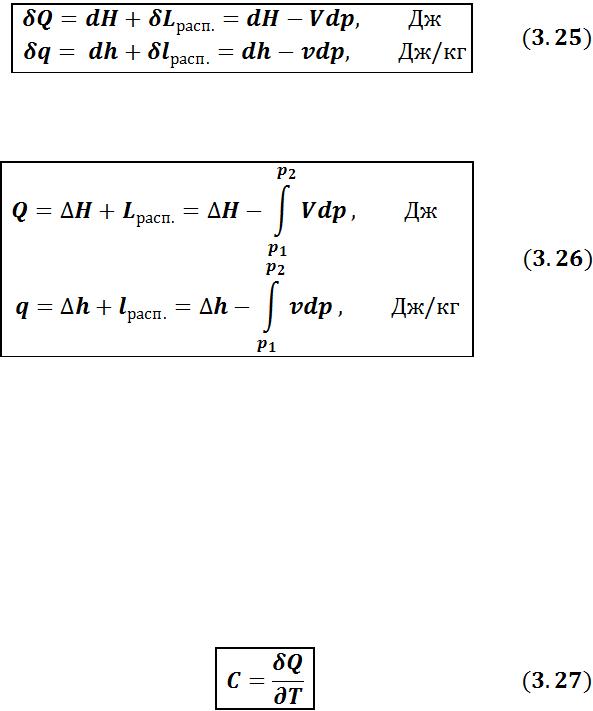
30
б) для открытой системы
•в дифференциальной форме:
в интегральной форме:
3.6Теплоемкость газов
3.6.1Виды теплоемкостей
Сообщение телу теплоты в каком-либо процессе вызывает изменение его состояния и в общем случае сопровождается изменением температуры.
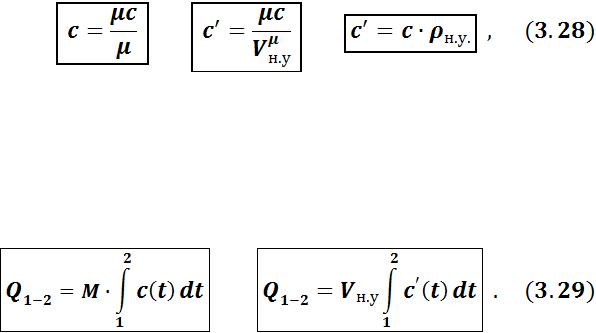
Отношение количества теплоты δQ, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT, называется истинной теплоемкостью тела в данном процессе:
Поскольку количество теплоты δQ зависит от характера процесса, то и теплоемкость системы C также зависит от условий протекания процесса. Одна и та же система в зависимости от характера процесса обладает различными теплоемкостями (от – ∞ до +∞).
31
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают (таблица 3.1):
Таблица 3.1 - Виды теплоемкостей
Единица коли- |
Наименование удельной |
Обозначение |
Размерность |
|
чества вещества |
теплоемкости |
|||
|
|
|||
1 кг |
Массовая |
c |
Дж/(кг·К); |
|
|
|
|
|
|
1 м3 |
Объемная* |
c´ |
Дж/(м3·К); |
|
(при нормальных условиях) |
||||
|
|
|
||
|
|
|
|
|
1 кмоль |
Мольная (молярная) |
с |
Дж/(кмоль·К). |
|
|
|
|
|
Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями:
где – молярная масса газа, кг/кмоль (то же, что и г/моль);
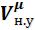 = 22,4∙м3/кмоль – молярный объем газа при нормальных условиях;н.у. – плотность газа при нормальных условиях, кг / м3.
= 22,4∙м3/кмоль – молярный объем газа при нормальных условиях;н.у. – плотность газа при нормальных условиях, кг / м3.
Количество теплоты Q 1-2 , подведенное или отведенное в процессе 1–2, можно рассчитать через истинную теплоемкость:
3.6.2 Теплоемкости при p=const, v=const
Уравнение Майера
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому тепло-
емкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 градус раз-
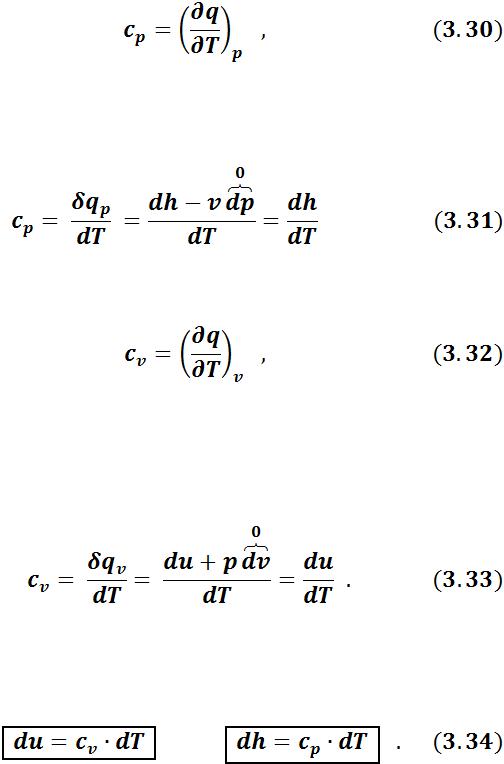
32
личного количества теплоты. Численно величина с может изменяться в пределах от − до + .
Втермодинамических расчетах большое значение имеют:
•изобарная теплоемкость (теплоемкость при постоянном давлении):
равная отношению количества теплоты, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT;
Учитывая первый закон термодинамики, из (3.30) получим:
•изохорная теплоемкость (теплоемкость при постоянном объеме):
равная отношению количества теплоты, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела.
Учитывая первый закон термодинамики, из (3.31) получим:
Для идеального газа и внутренняя энергия, и энтальпия зависят только от температуры. Следовательно:

33
Изобарная и изохорная теплоемкости связаны между собой уравнением Майера.
Из (3.12) получим:
Учитывая (3.34) и уравнение состояния идеального газа, получим:
где |
массовая изобарная теплоемкость, Дж/(кг∙К); |
–массовая изохорная теплоемкость, Дж/(кг∙К);
–удельная газовая постоянная, Дж/(кг∙К).
Визохорном процессе теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в изобарном процессе теплота расходуется и на увеличение внутренней энергии и на совершение работы против
внешних сил. Поэтому 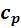 больше
больше 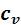 на величину этой работы.
на величину этой работы.
ширении совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
Умножив уравнение (3.4) на 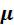 , получим уравнение Майера для 1 кмоля идеального газа:
, получим уравнение Майера для 1 кмоля идеального газа:
где ср – молярная изобарная теплоемкость, Дж/кмоль∙К;cv – молярная изохорная теплоемкость, Дж/кмоль∙К; R0 – универсальная газовая постоянная, Дж/кмоль∙К.
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать с помощью молекулярно-кинетической теории газов.
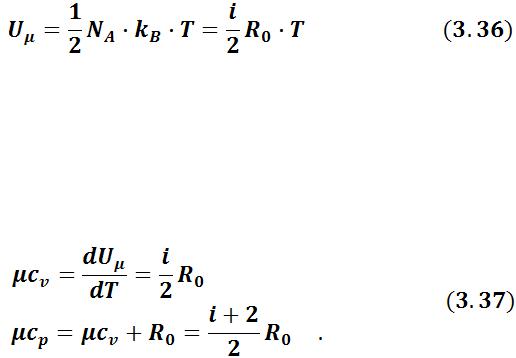
34
3.6.3 Элементы молекулярно-кинетической теории теплоемкости
Классическая молекулярно – кинетическая теория газов рассматривает идеальный газ как совокупность абсолютно жестких молекул, между которыми отсутствуют силы взаимодействия и каждая молекула обладает лишь энергией поступательного и вращательного движений, а сами молекулы рассматриваются как материальные точки.
Численное значение теплоемкости идеального газа позволяет найти теорема о равномерном распределении энергии по степеням свободы молекул.
Согласно этой теореме внутренняя энергия газов равномерно распределяется по степеням свободы поступательного и вращательного движений молекул, и на одну степень свободы молекулы приходится энергия ui = 1/2·kB·T, где kB - постоянная Больцмана (п.2.2).
Внутренняя энергия 1 моля идеального газа запишется как
где NA – число Авогадро;
i – число степеней свободы (минимальное число независимых координат, которые нужно задать для того, чтобы полностью определить движение молекулы в пространстве).
Из уравнения (3.36) следует, что молярные изохорную и изобарную теплоемкости идеального газа можно записать в виде:
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение.
Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками).
Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
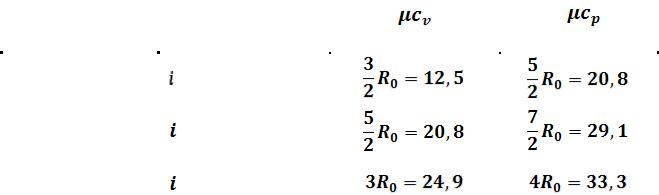
35
Соответственно, мольные теплоемкости одно-, двух- и многоатомных газов равны (таблица 3.2).
Таблица 3.2 - Мольные теплоемкости идеальных газов согласно молеку- лярно-кинетической теории газов
Атомность газа |
Число степеней |
, |
, |
||
свободы, |
i |
кДж/(кмоль К) |
кДж/(кмоль К) |
||
|
|||||
Одноатомный |
= 3 пост. |
|
|
|
|
|
|
|
|
|
|
Двухатомный |
= 3 пост.+2 |
вр. |
|
|
|
|
|
|
|
|
|
Трех- и много- |
= 3 пост.+3 |
вр. |
|
|
|
атомный |
|
|
|||
|
|
|
|
||
|
|
|
|
|
|
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур, однако основной вывод о независимости от температуры эксперимент не подтверждает.
Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
Эта теория устанавливает, прежде всего, несправедливость теоремы о равномерном распределении энергии по степени свободы в области низких и высоких температур.
Суменьшением температуры газа происходит «вымораживание» числа степеней свободы молекулы. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость.
Сувеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит
кувеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Теплоемкость реального газа зависит от давления, правда, очень слабо.
36
3.6.4 Истинная и средняя теплоемкости газов
Теплоемкость реального газа зависит от температуры. Вид этой зависимости (линия 1–2) показан на рисунке 3.5.
c 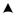
1'
1
cm
4
t1
2 |
 2'
2'
3 |
|
t2 |
t |
|
Рисунок 3.5 – Зависимость теплоемкости газа от температуры
Из определения истинной теплоемкости (3.27) следует, что удельное количество теплоты с помощью истинной теплоемкости определяется по формуле:
т.е. количество теплоты q в процессе определяется площадью под линией процесса (на рисунке 3.5 площадь 1-2-3-4-1).
Чтобы облегчить расчеты и избежать численного интегрирования при определении количества теплоты, в термодинамике введено понятие средней теплоемкости.
Средней теплоемкостью сm данного процесса в интервале темпера-
тур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
37
Для того, чтобы подчеркнуть, что речь идет именно о средней теплоемкости, используется нижний индекс m (medium – средний (лат)).
Подставив (3.38) в (3.39), получим взаимосвязь между истинной и средней теплоемкостями:
По определению средняя теплоемкость является постоянной величиной для данного процесса, поэтому среднее значение удельной теплоемкости сm в интервале температур от t1 до t2 может быть представлено высотой прямоугольника 1’-2’-3-4-1’ (рисунок 3.5), основание которого равно ( t2 - t1 ) и который по площади равновелик фигуре с тем же основанием, но ограниченной линией 1-2.
Удельное количество теплоты с использованием средней теплоемкости определяется по формуле:
3.6.5 Теплоемкость смесей идеальных газов
Теплоемкости газовой смеси рассчитываются по формулам:
где – массовая доля i-того компонента смеси;
–объемная доля i-того компонента;
–объемная доля i-того компонента.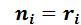 ;
;

38
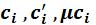 – соответственно, массовая, объемная и мольная теплоемкости i-того компонента.
– соответственно, массовая, объемная и мольная теплоемкости i-того компонента.
Вопросы для самопроверки
18.Определите понятия теплоты и работы.
19.Термодинамическая и располагаемая работы газа. Их определения. Показать на
pv-диаграмме.
20.Внутренняя энергия и энтальпия. Определения, свойства.
21.Научные формулировки первого закона термодинамики.
22.Аналитические выражения первого закона термодинамики для закрытой и открытой систем; в интегральной и дифференциальной форме.
23.Определение теплоемкости, виды теплоемкостей, взаимосвязь между ними.
24.Изобарная и изохорная теплоемкости. Уравнение Майера.
25.Истинная и средняя теплоемкости.
26.Теплоемкость смеси газов.
Список рекомендуемой литературы:
Основная
7.Баскаков А. П., Берг Б.В., Витт О.К. и др. Теплотехника: учебник для вузов. 2-е изд., перераб. – М.: Энергоатомиздат, 1991. – Гл.2.
8.Нащокин В. В. Техническая термодинамика и теплопередача. – М.: Высшая школа,
1980. – §§ 5-1 - 5-6; 6-1 – 6-9.
9.Техническая термодинамика: учебник для вузов/ В.А. Кириллин, В.В. Сычев, А.Е. Шейндлин. – 4-е изд., перераб. - М.: Энергоатомиздат, 1983. - Гл. 2, пп. 2.1 - 2.5.
Дополнительная
6.Сивухин Д.В. Общий курс физики. Т.2, Термодинамика и молекулярная физика. 2-е
изд., испр. - М.: Наука, 1979. - Гл.1, §§1-6, 9; Гл.2, §11.
7.Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур: Пер. с англ. Ю. А. Данилова и В. В. Белого - М.: Мир,
2002. – п.2.1 – 2.3.
8.Бродянский В. М. Вечный двигатель - прежде и теперь. От утопии - к науке, от науки - к утопии. - М.: ФИЗМАТЛИТ, 2001. - 264 с.
9.Краснов А.И. Возможен ли вечный двигатель? М.: Гос. изд-во технико-теорет.
лит-ры, 1956. - 62 с.
39
4 ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Первое начало термодинамики не дает никаких указаний относительно направления, в котором могут происходить процессы в природе. Для изолированной системы, например, первое начало требует только постоянства энергии во всех процессах.
Пусть адиабатически изолированная система состоит из двух тел, взаимодействующих между собой, но не взаимодействующих с другими телами.
Тогда теплообмен между ними подчиняется условию Q1 = – Q2. Теплота Q1, полученная одним телом, равна теплоте Q 2 , отданной другим телом. В каком направлении будет переходить тепло – на этот вопрос первое начало термодинамики ответить не может. Первому началу не противоречил бы, например, процесс, в котором тепло самопроизвольно переходит от тела менее нагретого к телу более нагретому.
Второе начало термодинамики, наоборот, позволяет судить о направлении процессов, которые могут происходить в действительности. Оно, совместно с первым началом, позволяет также установить множество точных количественных соотношений между различными макроскопическими параметрами тел в состоянии термодинамического равновесия.
Основоположником второго начала термодинамики считается французский инженер и физик Сади Карно. В своем сочинении «О движущей силе огня и машинах, способных развивать эту силу» (1824 г.) (значительно ранее от-
крытия первого начала термодинамики Р.Майером, Г. Гельмгольцем и Дж.
Джоулем) Карно исследовал условия превращения теплоты в работы.
Однако, т.к. в то время Карно придерживался теории теплорода (позднее он от нее отказался), ему не удалось дать ясную и четкую формулировку второго начала термодинамики. Это было сделано только в 1850 – 1851 гг. независимо друг от друга немецким физиком Рудольфом Клаузиусом и шотландским физиком Уильямом Томсоном (лордом Кельвином). Они сформулировали основной постулат, выражающий второе начало термодинамики, и вывели из него главнейшие следствия.
4.1 Формулировки второго начала термодинамики
Следуя историческому ходу идей, рассмотрим систему: газ в цилиндре под подвижным поршнем. При сообщении газу количества теплоты Q1 , газ нагревается, расширяется, толкает поршень и совершает при этом работу L1 (рисунок 4.1, процесс 1 - а - 2). Согласно первому закону термодинамики:
