
1. Лекции Термодинамика (УЭИ)
.pdf10
Вопросы для самопроверки
1.Дайте определение термодинамической системы, термодинамического процесса.
2.Виды термодинамических систем, их определения.
3.Равновесные и неравновесные процессы.
4.Основные термодинамические параметры состояния.
5.Что такое давление? Единицы измерения давления. Абсолютное и избыточное давление.
6.Понятие температуры. Единицы измерения температуры.
7.Интенсивные и экстенсивные параметры состояния. Привести примеры.
8.Назовите термические параметры состояния.
Список рекомендуемой литературы
Основная
1.Баскаков А. П., Берг Б.В., Витт О.К. и др. Теплотехника: учебник для вузов. 2-е изд., перераб. – М.: Энергоатомиздат, 1991. – Гл.1.
2.Нащокин В. В. Техническая термодинамика и теплопередача. – М.: Высшая школа,
1980. – §§1-4 - 1-6.
3.Техническая термодинамика: учебник для вузов/ В.А. Кириллин, В.В. Сычев, А.Е. Шейндлин. – 4-е изд., перераб. - М.: Энергоатомиздат, 1983. - Гл. 1, пп. 1.1-1.3.
Дополнительная
1.Луканин В.Н., Шатров М.Г., Камфер Г.М. и др. Теплотехника: учебник для вузов. -
М.: Высшая школа, 1999. - Гл.1, п.1.1.
2.Теплотехника: Учебник для втузов/А.М. Архаров, И.А. Архаров, В.Н. Афанасьев и др.; Под общ.ред. А.М. Архарова, В.Н. Афанасьева. – 2-е изд., перераб. и доп. – М.: Изд-во МГТУ им Н.Э. Баумана, 2004, - Гл. 1, п 1.1.
3.Сивухин Д.В. Общий курс физики. Т.2, Термодинамика и молекулярная физика. 2-е
изд., испр. - М.: Наука, 1979. - Гл.1, §§1-6, 9; Гл.2, §11.

11
2 ИДЕАЛЬНЫЕ ГАЗЫ
2.1 Законы идеальных газов
Идеальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия, а собственный объем молекул принимается равным нулю.
Закон Бойля-Мариотта (1662 г.):
В изотермическом процессе (Т = const) объем идеального газа обратно пропорционален его давлению:
Закон Гей – Люссака (1802 г.):
При изобарном процессе (p = const) объем идеального газа прямо пропорционален его абсолютной температуре:
Закон Шарля (1787 г.):
При изохорном процессе (V=const) давление идеального газа прямо пропорционально его абсолютной температуре:
Обобщенный закон Бойля - Мариотта и Гей – Люссака:

12
Закон Авогадро
В одинаковых объемах различных газов, взятых при одинаковых температурах и давлениях, заключается одинаковое количество молекул N.
Следовательно, различные газы, взятые при одинаковых давлениях и температурах, и имеющих одинаковое число молекул N, занимают одинаковый объем.
Поскольку в одном моле каждого вещества содержится одинаковое число молекул, равное числу Авогадро NА=6,02∙1023 моль-1, то при нормальных физических условиях (p=101325 Па, Т=273,15 К) молярный объем любого газа составит:
2.2 Уравнение состояния идеального газа
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны уравнением состояния вида
Поскольку параметры взаимозависимы, то любой из них может быть однозначно выражен через два других:
Для идеального газа уравнение состояния получается следующим образом. Из молекулярно-кинетической теории газов известно, что давление газа выражается следующим образом:
,
где n - концентрация молекул газа;
kB - постоянная Больцмана, kB = 1,380662 10ˉ23 Дж/К; Т - абсолютная температура газа.
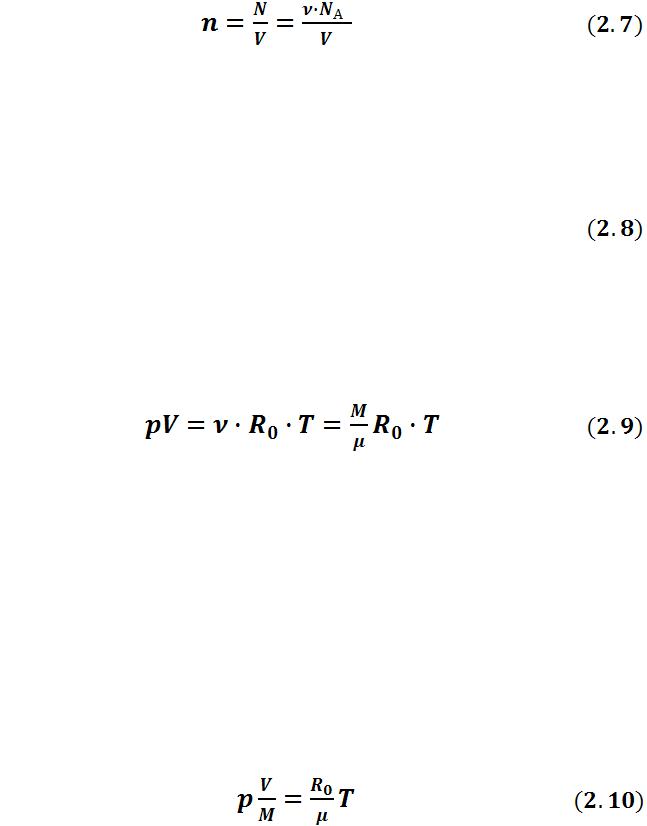
13
Концентрацию молекул можно представить в виде:
|
, |
где N - |
количество молекул газа; |
V - |
объем газа; |
- |
количество молей газа; |
NA - число Авогадро.
Подставив уравнение (2.7) в (2.6), получаем:
 .
.
Произведение констант NАkВ обозначают буквой R0 и называют уни-
версальной газовой постоянной. Ее численное значение равно:
R0 = 8,31434 0,00035 Дж/( моль К).
Окончательно получаем:
Полученное соотношение обычно называют уравнением Клапейрона
или Менделеева-Клапейрона, в котором:
р – абсолютное давление газа, Па, V – объем, м3,
R0 – универсальная газовая постоянная, Дж/(моль К), Т – абсолютная температура, К;
М - масса газа, кг;
В технической термодинамике предпочитают работать с удельными величинами, т.е. величинами, отнесенными к 1 кг газа. Поделив правую и левую части уравнения (2.9) на массу М, получим:
.
υ = V/М — удельный объем , м3/кг. Это объем единицы массы вещества.

14
Между удельным объемом вещества и его плотностью существует очевидное соотношение:
Обозначим через R отношение
,
R — удельная газовая постоянная, Дж/(кг К). Она постоянна только для данного вида газа. Для различных видов газов R принимает различные значения.
Окончательно получаем:
где р– |
абсолютное давление газа, |
Па, |
υ – |
удельный объем, м3/кг, |
|
R – |
удельная газовая постоянная, Дж/(кг К), |
|
Т – |
абсолютная температура, |
К. |
2.3 Смеси идеальных газов
Газовая смесь – это смесь отдельных газов, не вступающих между собой ни в какие химические реакции.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Парциальный объем – это объем газа, входящего в газовую смесь, который он занимал бы один при давлении и температуре смеси.
2.3.1 Закон Дальтона
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
.

15
2.3.2 Способы задания газовых смесей
Состав газовой смеси может быть задан абсолютными (размерными) и относительными (безразмерными) величинами.
Массовой долей называется отношение массы отдельного компонента Мi , к массе смеси Мсм :
.
Очевидно, что
Объемная доля представляет собой отношение парциального объема газа Vi , к полному объему смеси V:
Мольная доля – это отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси Nсм .:
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т в идеально газовом состоянии одинаковы. Поэтому парциальный объем i-го компонента смеси  и объем смеси
и объем смеси 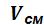 можно вычислить по формулам:
можно вычислить по формулам:
где – объем одного моля;
– число молей i-го компонента смеси.
Разделив первое уравнение на второе получим равенство объемных и мольных долей:
или

16
Массовые и объемные доли часто задаются в процентах. Например, для сухого воздуха
2.3.3 Основные расчетные формулы для смеси газов
• Кажущаяся молекулярная масса смеси 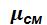 .
.
Ее можно найти через массовые или объемные доли:
•Газовая постоянная смеси газов определяется аналогично удель-
ной газовой постоянной химически однородного газа (формула 2.12):
• Соотношение между объемными и массовыми долями.

17
• Парциальное давление.
Из уравнений состояния для i-го компонента, получим расчетную формулу парциального давления через объемную долю:
Из уравнений состояния для i-го компонента и для всей смеси газов, получим расчетную формулу парциального давления через массовую долю:
отсюда
• Парциальный объем.
Из выражения (2.23), получим:
Вышеприведенные результаты обобщены в таблице 2.2.

18
Таблица 2.2 - Формулы для расчета газовых смесей
Расчетные величины |
Задание состава газовой смеси |
||
массовыми долями |
объемными долями |
||
|
|||
Перевод из одного состава в другой
Удельный объем м3/кг
Плотность смеси, кг/м3
Кажущаяся молярная масса смеси,
кг/кмоль
Удельная газовая постоянная смеси,
Дж/кг∙К
Парциальное давление, Па
Все уравнения и зависимости, полученные для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
19
Вопросы для самопроверки
9.Определение идеального газа
10.Сформулируйте основные законы идеальных газов.
11.Что называется уравнением состояния?
12.Уравнение состояния для идеального газа (в абсолютных и удельных величинах).
13.Определение смеси газов.
14.Дайте определение парциального давления, приведенного объема.
15.Сформулируйте закон Дальтона.
16.Способы задания газовых смесей.
17.Основные расчетные формулы газовых смесей.
Список рекомендуемой литературы
Основная
4.Нащокин В. В. Техническая термодинамика и теплопередача. – М.: Высшая школа,
1980. – Гл.2-3.
5.Баскаков А. П., Берг Б.В., Витт О.К. и др. Теплотехника: учебник для вузов. 2-е изд., перераб. – М.: Энергоатомиздат, 1991. – Гл.4, п.4.3.
6.Техническая термодинамика: учебник для вузов/ В.А. Кириллин, В.В. Сычев, А.Е. Шейндлин. – 4-е изд., перераб. - М.: Энергоатомиздат, 1983. -Гл. 1, пп. 1.4-1.5.
Дополнительная
4.Луканин В.Н., Шатров М.Г., Камфер Г.М. и др. Теплотехника: учебник для вузов. -
М.: Высшая школа, 1999. - Гл.1, п.1.2.
5.Ландсберг Г.С. Элементарный учебник физики. Т.1. Механика. Теплота. Молекулярная физика. М.: Наука, Гл. ред. физ.-мат. лит., 1985. - Гл.13, §§ 221-242.
