
1. Лекции Термодинамика (УЭИ)
.pdf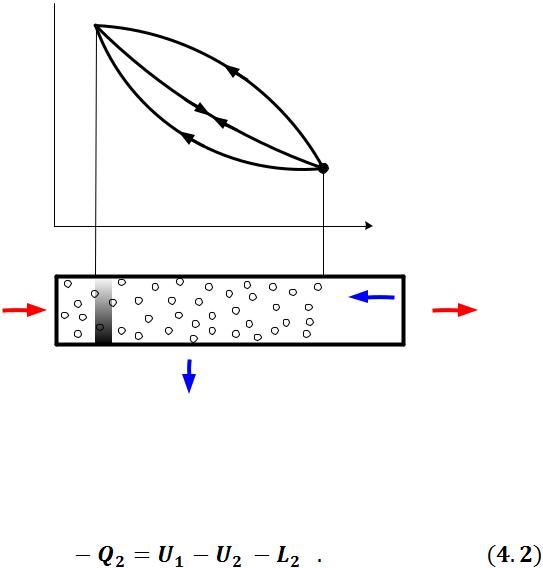
40
При однократном расширении газа в цилиндре можно получить лишь ограниченное количество работы, поскольку наступит момент, когда давление и температура рабочего тела станут равными давлению и температуре окружающей среды, система придет в равновесие с окружающей средой и на этом получение работы прекратится.
Р 
1 
b
a
|
c |
2 |
|
|
|
|
|
|
|
v |
|
Q1 |
|
L2 |
L1 |
|
|
||
|
Q2 |
|
|
Рисунок 4.1- К выводу 2-го закона термодинамики
Следовательно, для повторного получения работы необходимо в процессе сжатия возвратить рабочее тело в первоначальное состояние. При этом затрачивается работа L2 , а газ отдает количество теплоты Q2 :
Таким образом, тепловая машина совершила круговой процесс, в результате которого теплоотдатчик (нагреватель) отдал тепло Q1 , теплоприемник (холодильник) получил тепло Q2 , количество теплоты (Q1 – Q2) пошло на производство работы (L1 – L2 ).
Процесс возвращения тела в начальное состояние может быть осуществлен тремя путями:
Кривая сжатия 2- а -1 совпадает с кривой расширения 1- а -2. В этом случае суммарная работа, совершенная за цикл, равна 0. Практического применения такой цикл не имеет:
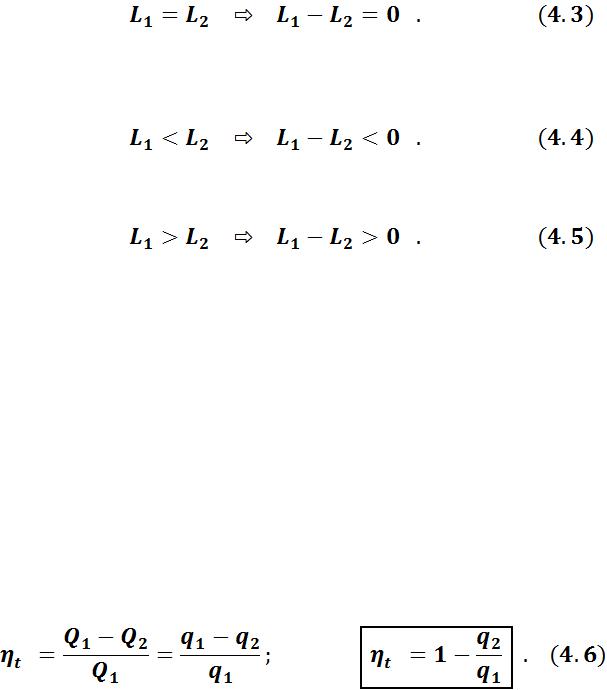
41
Кривая сжатия 2-b-1 располагается над линией расширения 1-a-2, т.е., работа L2 , затраченная на сжатие рабочего тела, превышает работу L1 , полученную при расширении. Суммарная работа цикла отрицательна:
Кривая сжатия 2-c-1 располагается ниже кривой расширения 1-a-2. В этом случае суммарная работа цикла положительна:
Повторяя цикл неограниченное число раз, можно за счет подводимой теплоты получить любое количество работы.
Цикл, в результате которого получается положительная работа, называется прямым циклом. По прямым циклам работают теплосиловые установки, преобразующие теплоту в полезную механическую работу.
Цикл, в результате которого расходуется работа, называется обратным. По обратным циклам работают холодильные установки, тепловые насосы.
Термический КПД и холодильный коэффициент циклов
Термическим коэффициентом полезного действия тепловой машины – это отношение количества теплоты, превращенного в положительную работу за один цикл, ко всему количеству теплоты, подводимому к рабочему телу:
Термический КПД является основным показателем эффективности тепло-
силовых установок, работающих по прямому циклу. Чем больше t тем большая часть подведенной теплоты превращается в полезную работу.
Уравнение (4.6) показывает, что всю подведенную в цикле к рабочему телу теплоту q1 полностью превратить в работу невозможно без отвода некоторого количества теплоты q2 в теплоприемник.
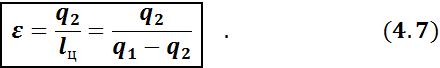
Для оценки эффективности работы холодильных установок, работающих по обратному циклу, вводится понятие холодильного коэффициента ε.
42
Холодильный коэффициент – это отношение количества теплоты, отнятой от холодного источника, к затраченной в цикле работе.
Можно ли построить периодически действующую тепловую машину без
холодильника, т.е. q2 = 0 и t = 1? Такая машина могла бы превращать в работу всю теплоту, заимствованную от одного теплоотдатчика (perpetuum mobile второго рода). Уже Карно понял, что такая машина принципиально невозможна, что подтверждается опытными фактами. Поэтому невозможность построения такого вечного двигателя была возведена в постулат.
Научные формулировки второго начала термодинамики
1Невозможно построить вечный двигатель II рода, т.е. такую периодически действующую машину, которая всю подведенную теплоту превращала бы в работу.
Эта формулировка является обобщением формулировок Томсона и Планка:
•Формулировка У. Томсона (лорда Кельвина): Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара (за счет изменения внутренней энергии).
•Формулировка Макса Планка: Невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счет охлаждения теплового резервуара.
2Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому (теплота – внутренняя энергия) (формулировка Рудольфа Клаузиуса).
Клаузиус все процессы подразделил на самопроизвольные и несамопроизвольные. Клаузиус показал, что все естественные процессы, протекающие в природе, являются процессами самопроизвольными (положительными, некомпенсированными) и не могут сами собой без компенсации протекать в обратном направлении.
Самопроизвольные процессы: переход теплоты от более нагретого тела к менее нагретому; превращение работы в теплоту; взаимная диффузия; расширение газа и т.п.
Несамопроизвольные процессы противоположны. Процессы несамопроизвольные возможны, но они никогда не протекают сами собой без компенсации.

43
Когда в несамопроизвольном процессе происходит преобразование теплоты в работу, то одновременно с охлаждением теплоотдатчика происходит еще изменение термодинамического состояния одного или нескольких тел. Это изменение называется компенсацией превращения теплоты в работу.
Всякий несамопроизвольный процесс может произойти только тогда, когда он сопровождается компенсирующим самопроизвольным процессом.
4.2Энтропия
В1865 г. Р.Клаузиус на основании доказанного ранее соотношения 4.34 (см.п.4.5.1) ввел новую функцию состояния. Он назвал эту функцию состояния энтропией:
Значение энтропии для заданного состояния определяется интегрированием уравнения (4.8):
где S0 и s0 – константы интегрирования.
Основные свойства энтропии
1.Энтропия является функцией состояния термодинамической системы. Изменение энтропии в каком-либо процессе не зависит от характера процесса и однозначно определяется начальным и конечным состоянием газа.
2.Изменение энтропии в обратимом круговом процессе (цикле) равно 0:
3.При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал сле-
дующий принцип: при температуре, стремящейся к абсолютному нулю,

44
энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е. s0 = 0 при
Т = 0 К.
Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
4.Энтропия аддитивна, т.е. энтропия системы равна сумме энтропий всех
еечастей:
5.Для идеальных газов энтропия, в отличие от внутренней энергии и энтальпии, зависит не только от температуры.
Из первого закона термодинамики и уравнения состояния идеального газа выведем формулы для определения изменения энтропии:

45
Интегрируя уравнение (4.14), получим:
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (4.15) – (4.17) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
Энтропия также является калорическим параметром состояния термодинамической системы.
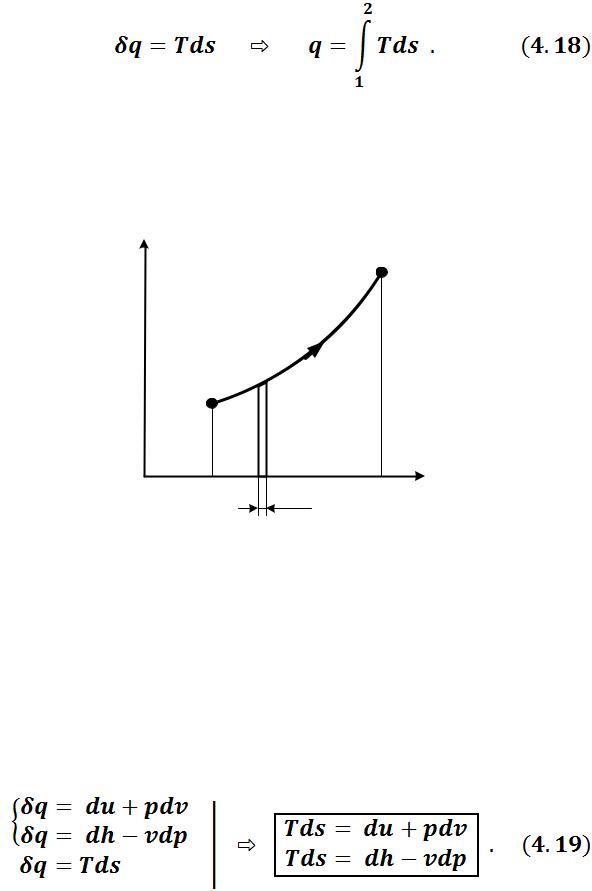
Понятие энтропии позволяет ввести удобную для термодинамических расчетов Тs – диаграмму, на которой (как и на  – диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс – линией (рисунок 4.2).
– диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс – линией (рисунок 4.2).
46
Из уравнения (4.8) следует, что в равновесном процессе
Очевидно, что в Ts – диаграмме элементарная теплота процесса δq изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса. Поэтому Ts – диаграмму называют еще теп-
ловой диаграммой.
T |
2 |
δq T 
1 |
|
q |
|
|
|
s1 |
ds |
s2 s |
Рисунок 4.2 - Ts-диаграмма
Формула (4.18) показывает, что ds и δq имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен.
При подводе теплоты к телу (δq > 0) его энтропия возрастает (ds > 0), а при отводе теплоты (δq < 0) - убывает (ds < 0).
Уравнение (4.18) позволяет преобразовать первый закон термодинамики в термодинамические тождества, в которые входят только параметры и функции состояния:
47
4.3Цикл Карно
4.3.1Прямой цикл Карно
Прямой цикл Карно состоит из двух изотерм и двух адиабат (рисунок
4.3).
Процесс 1–2: изотермический подвод теплоты q1 при температуре Т1 ; Процесс 2–3: адиабатное расширение;
Процесс 3–4: изотермический отвод теплоты q2 при температуре Т2 ; Процесс 2–3: адиабатное сжатие.
Р  1
1
q = 0
T=const
|
lц |
4 |
T |
|
= |
|
c |
|
o |
|
n |
|
st |
2
q = 0
 3
3
T |
|
|
|
|
1 |
q1 |
2 |
|
|
||
T1 |
|
|
|
|
|
qц |
|
T2 |
4 |
|
3 |
|
q2 |
||
|
|
|
v |
s |
Рисунок 4.3 - Прямой цикл Карно в pv- и Ts-координатах
Основные свойства цикла Карно сформулированы в двух теоремах Карно.
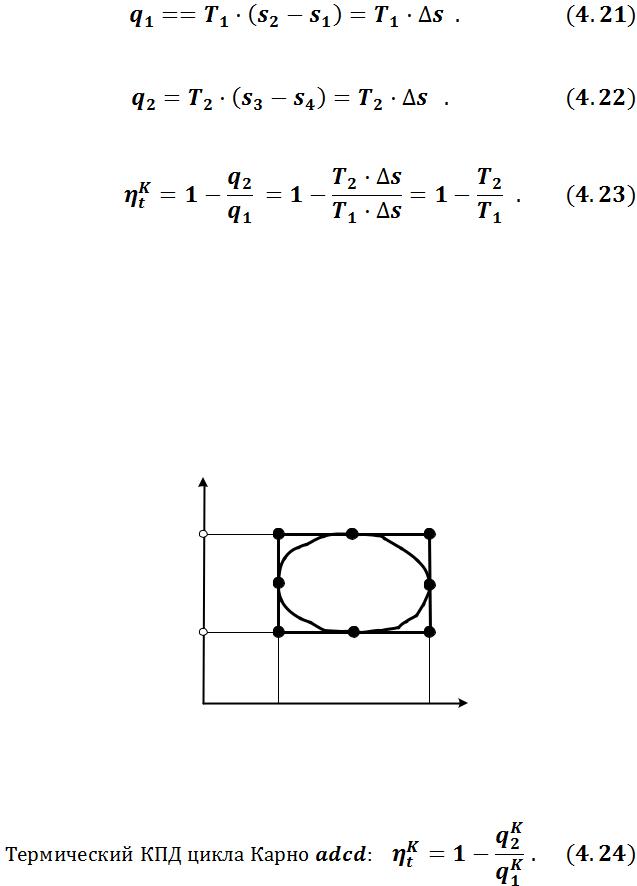
Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя Т1 и холодильника Т2 , но не зависит от устройства машины, а также от вида используемого рабочего тела.
Проще всего доказать теорему с помощью T s – диаграмму (рисунок
4.3).
Из (4.6) термический КПД:
Количество теплоты подведенной в изотермическом процессе 1–2:
48
Количество отведенной теплоты в изотермическом процессе 3–4:
Подставив уравнения (4.21) и (4.22) в выражение (4.20), получим:
Вторая теорема Карно: КПД всякой тепловой машины не может превосходить КПД идеальной тепловой машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника.
На рисунке 4.4 изображен произвольный цикл efgh, осуществимый при наличии бесконечно большого количества источников теплоты. Опишем вокруг этого цикла цикл Карно abсd.
Сравним термические КПД этих циклов.
T |
|
|
|
T1 |
a |
f |
b |
|
|
|
|
|
e |
|
g |
T2 |
d |
h |
c |
|
1 |
2 s |
Рисунок 4.4 - Сравнение произвольного цикла с циклом Карно при одинаковых предельных температурах

49
Количество теплоты, подведенное в цикле Карно (площадь 1d a b c 2), больше количества теплоты, подведенного в цикле efgh (площадь 1efg2):
Количество теплоты, отведенного из цикла Карно (площадь 1dc2), меньше количества теплоты, отведенного в произвольном цикле (площадь 1ehg2):
Следовательно:
4.3.2 Обратный цикл Карно
Осуществим цикл Карно в обратном направлении.
Рабочее тело с начальными параметрами точки 1 (рисунок 4.5) расширяется адиабатно (процесс 1-2), совершая работу расширения за счет внутренней энергии, и охлаждается от температуры Т1 до температуры Т2 .
Дальнейшее расширение происходит по изотерме (процесс 2-3), и рабочее тело отбирает от нижнего источника с температурой Т2 теплоту q2 . Далее газ подвергается сжатию сначала по адиабате (процесс 3-4), и его температура от T2 повышается до T1, а затем - по изотерме (процесс 4-1). При этом рабочее тело отдает верхнему источнику с температурой T1 количество теплоты q1.
Поскольку в обратном цикле сжатие рабочего тела происходит при более высокой температуре, чем расширение, работа сжатия, совершаемая внешними силами, больше работы расширения на величину площади abed, ограниченной контуром цикла. Эта работа превращается в теплоту и вместе с теплотой q2 передастся верхнему источнику.
Таким образом, затратив на осуществление обратного цикла работу lц , можно перенести теплоту от источника с низкой температурой к источнику с
