
1. Лекции Термодинамика (УЭИ)
.pdf20
3 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
I закон термодинамики является частным случаем всеобщего закона сохранения и преобразования энергии, применительно к тепловым явлениям, протекающим в термодинамических системах.
Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества экспериментальных данных и применим ко всем явлениям природы. Он утвер-
ждает, что энергия не исчезает и не возникает вновь, она лишь переходит из
одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
В числе первых ученых, утверждавших принцип сохранения материи и энергии, был наш соотечественник М. В. Ломоносов (1711 - 1765 гг.). Однако только в 50-х годах XIX в. в работах Джоуля, Ленца, Гельмгольца, Клаузиуса была дана окончательная научная формулировка и математическое обоснование закона сохранения энергии.
3.1 Понятия теплоты и работы
Общая количественная мера движения материи во всех его формах называется энергией. В системе СИ единицей измерения энергии является джоуль:
1 Дж = 1 Н м.
Передача энергии от одного тела к другому может происходить двумя способами:
1-ый способ: теплообмен – форма передачи энергии в результате неупорядоченного (хаотического) движения структурных микрочастиц, составляющих макроскопические тела.
Он возможен только при наличии градиента температур и осуществляется либо при непосредственном контакте этих тел (теплопроводность и конвекция), либо в форме передачи энергии в виде электромагнитных волн (излучение). При этом энергия передается от более нагретого тела менее нагретому.
Количество энергии, переданной таким способом от одного тела к другому, называется количеством теплоты, а сам способ – передачей энергии в форме теплоты. Количество энергии, полученное телом в форме теплоты, называется подведенной (сообщенной) теплотой, а количество энергии, отданное телом в форме теплоты – отведенной (отнятой) теплотой.
Подведенная теплота считается положительной (знак «+»). Теплота, отдаваемая системой (отведенная теплота), считается отрицательной (знак «–»).
Из внесистемных единиц измерения теплоты в настоящее время наиболее распространенной является калория (кал):
1 кал = 4,1868 Дж.
21
Полное количество теплоты обозначается Q (Дж), удельное количество теплоты (приходящееся на 1 кг массы системы) - q (Дж/кг).
2-ой способ: работа – форма передачи энергии в результате макроскопического, упорядоченного и направленного движения или в силовых полях или под действием внешнего давления. Рабочее тело должно либо перемещаться в силовом поле (характерно для открытых термодинамических систем), либо изменять свой объем (для закрытых термодинамических систем). Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе – работой.
Если система сама совершает работу, то такая работа считается положительной (знак «+»). Если над системой совершается (затрачивается) работа, то такая работа считается отрицательной (знак «–»).
Полная работа обозначается L (Дж), удельная работа – (Дж/кг)
В общем случае передача энергии в форме работы и теплоты может происходить одновременно, при этом количество теплоты и работа различны.
Количество теплоты, полученное телом, и работа, произведенная телом, зависят от условий перехода тела из начального состояния в конечное. Понятия теплоты и работы возникают только в связи с протекающим термодинамическим процессом. Нет процесса - нет работы (теплоты).
Теплота и работа не являются параметрами состояния. Бесконечно малые приращения теплоты и работы обозначаются δL и δQ, поскольку они не являются полными дифференциалами (в отличие от dp, dυ и dT ).
Втепловых машинах и аппаратах происходит преобразование энергии из одной формы в другую (например, превращение теплоты в работу, и наоборот).
Этот процесс реализуется посредством вещества, которое в таких преобразованиях изменяет свои физические свойства и представляет собой простейшую термодинамическую систему. Такое вещество называется рабочим телом. Оно способно значительно изменять свой объем под действием окружающей среды.
Примеры рабочих тел: водяной пар в паросиловых установках, продукты сгорания топлива в двигателях внутреннего сгорания, фреон в холодильных установках.
3.2Работа газа
Вобщем случае теплота переводится в работу двумя способами:
1. Закрытая система. Рабочее тело, помещенное в цилиндр с подвижным поршнем, нагревают, его давление повышается, и оно совершает работу, расширяясь в цилиндре и приводя в движение поршень (двигатели внутреннего сгорания, паровые поршневые машины). Полезная техническая работа в этом случае совершается за счет так называемой термодинамической работы (или
работы расширения).
22
2. Открытая система. Поток рабочего тела нагревают, его давление повышается, и поток совершает работу, расширяясь в канале и приводя в движение определенным образом ориентированные лопатки турбин, находящиеся на выходе из канала (газовые или паровые турбины). При этом расширение организуют так, чтобы поток газа имел большую скорость, т.е. большую кинетическую энергию. Именно она – кинетическая энергия потока и используется для совершения работы. В этом случае полезная техническая работа совершается за счет располагаемой (потенциальной) работы потока.
3.2.1 Работа расширения
Рассмотрим газ, находящийся в цилиндре с подвижным поршнем (закрытая система, рисунок 3.1). При подводе к цилиндру теплоты газ нагревается и расширяется, толкая при этом поршень и совершая работу. Такая работа, совершаемая при изменении объема газа, получила название термодинамиче-
ской работы (или работы расширения).
Q 
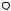
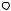

 Dx
Dx  Рисунок 3.1 - Работа расширения газа
Рисунок 3.1 - Работа расширения газа
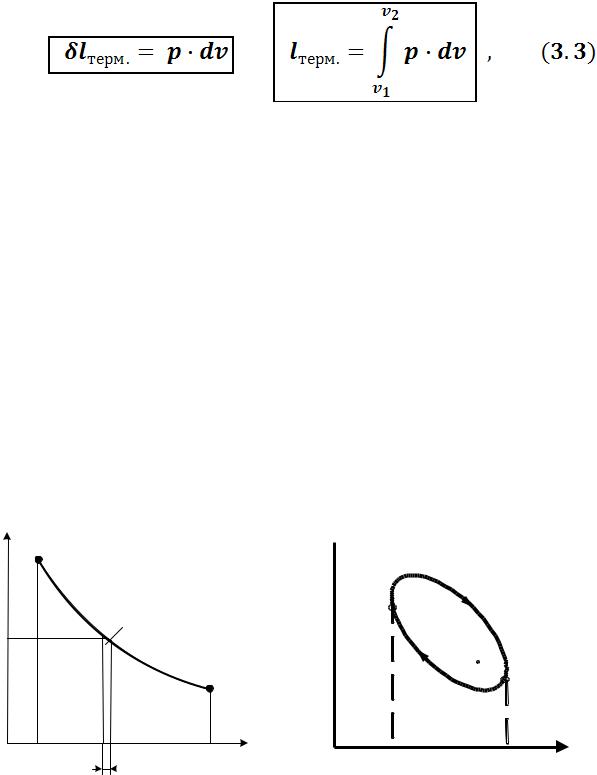
Величина термодинамической работы, совершаемой газом при перемещении поршня на расстояние Dх, равна:
где F – сила, действующая на поршень; А – площадь поршня;
P – давление, оказываемое газом на поршень; DV – приращение объема.
Переходя к пределу, получим:
23
Тогда удельная термодинамическая работа:
где υ – удельный объем.
Выражения (3.2) и (3.3) справедливы и в общем случае равновесного изменения объема любого тела, находящегося под постоянным внешним давлением.
Если газ расширяется (dυ > 0), то термодинамическая работа положи-
тельна, т.е., газ сам совершает работу. Если газ сжимается (dυ < 0), то термодинамическая работа отрицательна (для того, чтобы сжать газ необходимо затратить работу).
В технической термодинамике для исследования равновесных термоди-
намических процессов часто применяют двухосную систему координат pυ, в которой осью абсцисс является удельный объем, а осью ординат – давление.
Термодинамическая работа газа на диаграмме pυ измеряется площадью, ограниченной линией процесса, осью абсцисс и абсциссами крайних точек процесса (рисунок 3.2).
Работа по замкнутому контуру (цикл) равна площади, описанной контуром цикла (рисунок 3.3).
Р |
1 |
|
|
|
|
|
|
|
|
|
|
δlтерм |
|
|
Р |
|
|
|
|
|
|
|
2 |
|
|
v1 |
dv |
v2 |
v |
Рисунок 3.2 - Термодинамическая работа газа
p 
 а
а
1 |
lц>0 |
lц
b
2
V
Рисунок 3.3 – Работа цикла
24
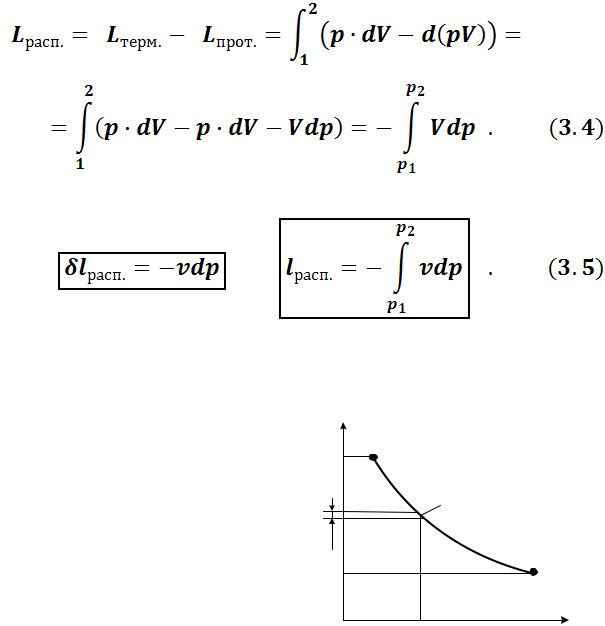
3.2.2 Работа потока
При стационарном течении газа через канал совершается работа, связанная с изменением давления, эта работа называется располагаемой (потенциальной) работой газового потока. Располагаемая работа равна работе расширения потока за вычетом так называемой работы проталкивания (или работы вытеснения массы), затрачиваемой потоком на преодоление давления окружающей среды: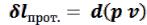 . Подробнее работа проталкивания рас-
. Подробнее работа проталкивания рас-
смотрена в п.7.1.
Таким образом, полная располагаемая работа определяется по формуле:
Удельная располагаемая работа:
Если у газового потока давление в ходе процесса уменьшается (dp < 0), то располагаемая работа потока положительна. Если наблюдается увеличение давления (dp > 0), то располагаемая работа отрицательна.
Располагаемая работа газа на pV- диаграмме измеряется площадью, ограниченной линией процесса, осью ординат и ординатами крайних точек процесса (рисунок 3.4).
Поскольку рV – диаграмма позволяет определять работу процесса, то ее часто называют рабочей диа-
граммой.
Р |
1 |
|
P1 |
|
|
|
|
|
|
|
δlрасп |
dP |
|
|
P2 |
|
2 |
|
v |
v |
Рисунок 3.4 - Располагаемая работа потока газа

25
3.3Внутренняя энергия. Энтальпия
3.3.1Внутренняя энергия
Внешняя энергия тела обусловлена его движением в пространстве и наличием силовых полей (кинетическая и потенциальная энергии). Внутренняя энергия тела – движением молекул и атомов тела и наличием сил межмолекулярного взаимодействия, которые присущи телу при любых условиях.
Внутренняя энергия U – это такая форма энергии, которая не зависит от движения самого тела и относительного расположения среди других тел.
Внутренняя энергия складывается из кинетической энергии поступательного, колебательного и вращательного движения молекул, атомов, внутриатомных и внутриядерных частиц и потенциальной энергии межмолекулярного внутриатомного внутриядерного взаимодействия:
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии, связанные с движением и взаимодействием молекул и атомов. Поэтому в понятие внутренней энергии будем в дальнейшем включать для идеальных газов кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов еще дополнительно и потенциальную энергию межмолекулярного взаимодействия.
Основные свойства внутренней энергии
1.Внутренняя энергия – функция состояния, определяется любой парой параметров состояния системы. Поэтому изменение внутренней энергии в ка- ком-либо процессе не зависит от характера процесса и однозначно определяется начальным и конечным состоянием газа (рисунок 3.5).
2.Изменение внутренней энергии в круговом процессе (цикле) равно 0:
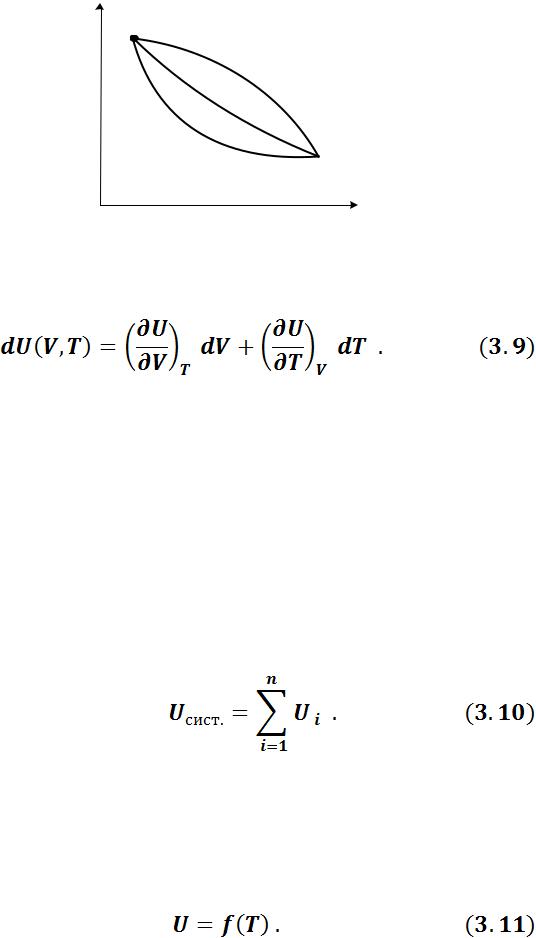
26
Р |
1 |
|
a b
c  2
2
v
Рисунок 3.5 - Изменение внутренней энергии
Отсюда следует, что dU – полный дифференциал, т.е.:
3. Как известно, при Т = 0 тепловое движение молекул и атомов, входящих в молекулы, прекращается, но движение частиц внутри атомов продолжается. Например, движение электронов в атомах не является тепловым движением и имеет место при любых температурах, в том числе и при Т = 0. Т.е., абсолютное значение внутренней энергии методами термодинамики определить невозможно. Однако при термодинамическом анализе системы приходится иметь дело не с абсолютными значениями внутренней энергии U, а с ее изменением в результате происходящих процессов ∆U, поэтому для решения большинства термодинамических задач значение U=0 выбирается произвольно.
4.Внутренняя энергия аддитивна, т.е. внутренняя энергия системы равна сумме внутренних энергий всех ее частей:
5.Для идеальных газов потенциальная составляющая внутренней энергии из (3.6) равна нулю (Uпот = 0), поскольку силы межмолекулярного взаимодействия отсутствуют.
Кинетическая составляющая внутренней энергии газов определяется температурой газа. Отсюда следует, что внутренняя энергия идеального газа зави-
сит только от температуры:
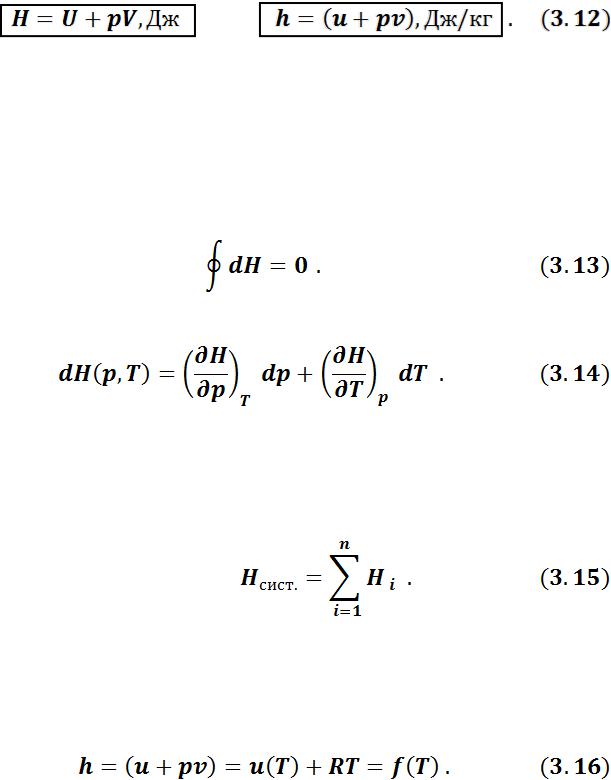
27
3.3.2 Энтальпия
Энтальпия H определяется следующим образом:
Основные свойства энтальпии
1.Энтальпия является функцией состояния термодинамической системы, поскольку определяется через внутреннюю энергию (функция состояния), давление и объем (параметры состояния). Изменение энтальпии в каком-либо процессе не зависит от характера процесса и однозначно определяется начальным
иконечным состоянием газа.
2.Изменение энтальпии в круговом процессе (цикле) равно 0:
dH – полный дифференциал, т.е.:
3. Поскольку энтальпия определяется через внутреннюю энергию, у нее также отсутствует нулевое значение. Физический смысл имеет только изменение энтальпии (∆Н).
4.Энтальпия аддитивна, т.е. энтальпия системы равна сумме энтальпий всех ее частей:
5.Для идеальных газов энтальпия является функцией только температу-
ры: h = f (T).
Учитывая уравнение состояния идеального газа: 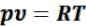 , из (3.12) видно, что энтальпия идеального газа также зависит только от его температуры:
, из (3.12) видно, что энтальпия идеального газа также зависит только от его температуры:
Внутреннюю энергию и энтальпию называют калорическими параметрами состояния.
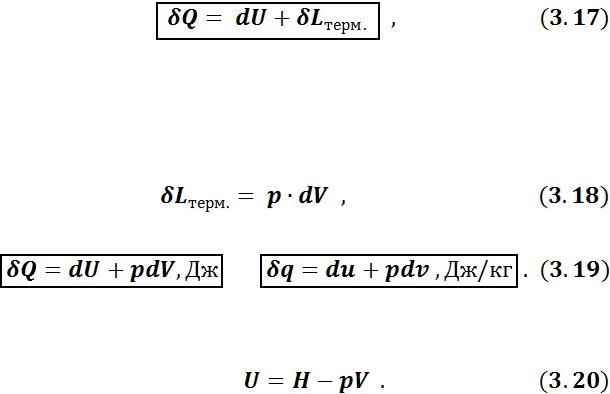
28
3.4Формулировки I закона термодинамики
1.Энергия изолированной термодинамической системы остается неизменной, независимо от того, какие процессы в ней протекают.
2.Невозможно построить вечный двигатель I-го рода, т.е. такую периодически действующую машину, которая совершала бы работу без затраты энергии.
3.5Аналитическое выражение I-го закона термодинамики
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты Q. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU.
Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую термодинамическую работу расширения 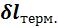 против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики в дифференциальной форме.
Учитывая уравнение (3.2):
получим:
Уравнение 1-го начала термодинамики можно записать и в другом виде. Из определения энтальпии (3.12) следует:

29
После дифференцирования:
Подставив выражение (3.21) в уравнение (3.19), получим:
Выражения (3.19) и (3.22) абсолютно равноправны, однако уравнением (3.19) удобнее пользоваться для закрытых систем, а уравнением (3.22) – для открытых систем. Поэтому уравнение (3.19) называют 1-м законом термодинамики для закрытой системы, а уравнение (3.22) – для открытой системы.
Таким образом, аналитическое выражение 1-го начала термодинамики:
а) для закрытой системы
•в дифференциальной форме:
•в интегральной форме:
