
1. Лекции Термодинамика (УЭИ)
.pdf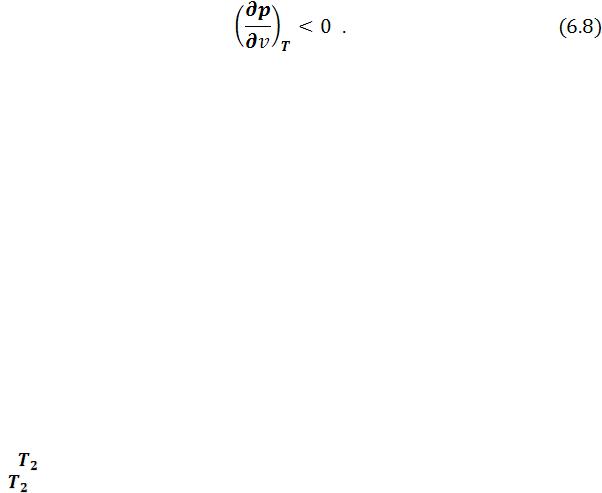
90
Одно из необходимых условий термодинамической устойчивости физически однородного вещества состоит в выполнении неравенства:
Физически оно означает, что при изотермическом увеличении давления объем тела должен уменьшаться. Иными словами, при возрастании 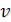 все изотермы должны монотонно опускаться. Между тем, ниже критической температуры на изотермах Ван-дер-Ваальса имеются поднимающиеся участки типа cd (рисунок 6.3). Точки, лежащие на таких участках, соответствуют неустойчивым состояниям вещества, которые практически реализованы быть не могут. При переходе к практическим изотермам эти участки должны быть выброшены.
все изотермы должны монотонно опускаться. Между тем, ниже критической температуры на изотермах Ван-дер-Ваальса имеются поднимающиеся участки типа cd (рисунок 6.3). Точки, лежащие на таких участках, соответствуют неустойчивым состояниям вещества, которые практически реализованы быть не могут. При переходе к практическим изотермам эти участки должны быть выброшены.
Таким образом, реальные изотермы ниже критической температуры распадаются на две ветви ac и  , отделенные друг от друга (рисунок 6.4). Естественно предположить, что этим двум ветвям соответствуют различные агрегатные состояния вещества. Ветви
, отделенные друг от друга (рисунок 6.4). Естественно предположить, что этим двум ветвям соответствуют различные агрегатные состояния вещества. Ветви характеризуются относительно большими значениями объема или малыми значениями плотности; они соответствуют газообразному состоянию вещества. Левые, почти вертикальные части изотерм ac, отражают очень малую сжимаемость жидкости, они соответствуют жидкому состоянию вещества.
характеризуются относительно большими значениями объема или малыми значениями плотности; они соответствуют газообразному состоянию вещества. Левые, почти вертикальные части изотерм ac, отражают очень малую сжимаемость жидкости, они соответствуют жидкому состоянию вещества.
Возьмем достаточно разреженный газ при температуре ниже критической. Исходное состояние его на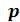 – диаграмме изображается точкой 1 на изотерме (рисунок 6.4). Будем сжимать газ равновесно, поддерживая температуру постоянной. Тогда точка, изображающая состояние газа, будет перемещаться по изотерме вверх. Можно было бы думать, что она достигает крайнего положения
– диаграмме изображается точкой 1 на изотерме (рисунок 6.4). Будем сжимать газ равновесно, поддерживая температуру постоянной. Тогда точка, изображающая состояние газа, будет перемещаться по изотерме вверх. Можно было бы думать, что она достигает крайнего положения 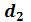 , где изотерма обрывается. Однако в действительности, начиная с некоторой точки
, где изотерма обрывается. Однако в действительности, начиная с некоторой точки 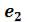 , давление в системе перестает повышаться, и она распадается на две физически однородные части или фазы: газообразную и жидкую.
, давление в системе перестает повышаться, и она распадается на две физически однородные части или фазы: газообразную и жидкую.
Процесс изотермического сжатия такой двухфазной системы изображается участком 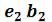 горизонтальной прямой. При этом во время сжатия плотности жидкости и газа остаются неизменными и равными их значениям в точках
горизонтальной прямой. При этом во время сжатия плотности жидкости и газа остаются неизменными и равными их значениям в точках 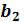 и
и 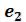 соответственно. По мере сжатия количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка
соответственно. По мере сжатия количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка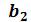 , в которой все вещество перейдет в жидкое состояние.
, в которой все вещество перейдет в жидкое состояние.
Такой ход изотерм впервые был обнаружен на опыте в конце 18 века голландским ученым ван Марумом (1750 - 1837). После ван Mapума последовали многочисленные попытки перевода газа в жидкое состояние путем сжатия. Особенно больших успехов в этом направлении достигли Фарадей (1791 - 1867) и английский физик Томас Эндрюс (1813 - 1885). Эндрюс экспериментально установил, что сжатием газ можно превратить в жидкость только тогда, когда
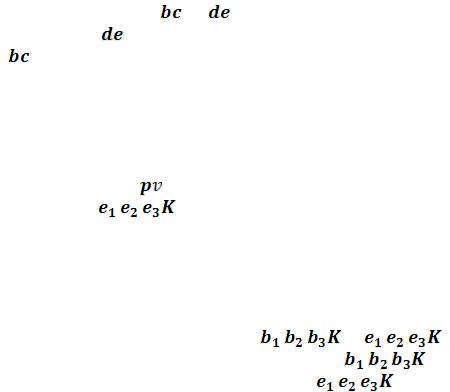
91
его температура ниже критической. Но это невозможно сделать никаким повышением давления, если температура газа выше критической.
Если за исходное состояние вещества взять жидкое (точка 2 на изотерме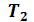 , рисунок 6.4), то при изотермическом расширении точка, изображающая его состояние, будет перемещаться вниз по изотерме, пока не достигнет положения
, рисунок 6.4), то при изотермическом расширении точка, изображающая его состояние, будет перемещаться вниз по изотерме, пока не достигнет положения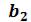 , начиная с которого появится новая газообразная фаза. Дальнейший изотермический процесс расширения двухфазной системы пойдет вдоль горизонтального участка изотермы
, начиная с которого появится новая газообразная фаза. Дальнейший изотермический процесс расширения двухфазной системы пойдет вдоль горизонтального участка изотермы 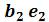 . В точке
. В точке 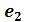 все вещество перейдет в газообразное состояние. Затем изотермическое расширение идет по участку изотермы
все вещество перейдет в газообразное состояние. Затем изотермическое расширение идет по участку изотермы 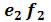 , причем вещество все время остается в газообразном состоянии.
, причем вещество все время остается в газообразном состоянии.
При специальных условиях могут быть реализованы состояния, изобра-
жаемые участками изотерм |
и . Эти состояния называются метаста- |
||
бильными. Участки |
изображают так называемый пересыщенный пар, |
||
участки |
– перегретую жидкость. Обе фазы обладают ограниченной устой- |
||
чивостью. Каждая из них может существовать до тех пор, пока она не граничит с другой, более устойчивой фазой. Например, пересыщенный пар переходит в насыщенный, если в него ввести каплю жидкости. Перегретая жидкость закипает, если в нее попадают пузырьки воздуха или пара.
Кривые b1b2b3K иe1e2e3K, соединяющие концы горизонтальных участков изотерм, делят плоскость – диаграммына две области. Область между кривыми 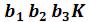 и и изобарой
и и изобарой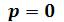 соответствует двухфазным состояниям вещества. Это значит, что каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара.
соответствует двухфазным состояниям вещества. Это значит, что каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара.
Область над кривыми 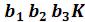 и
и 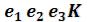 , напротив, соответствует однофазным состояниям. Каждая точка этой области изображает состояние фи-
, напротив, соответствует однофазным состояниям. Каждая точка этой области изображает состояние фи-
зически однородного вещества. Кривые |
и |
получили |
название пограничных кривых, поскольку кривая |
|
отделяет двух- |
фазную область от области жидкости, а кривая |
|
– от области газооб- |
разного состояния. |
|
|
Начальное и конечное состояния 1 и 2 физически однородного вещества в однофазной области можно выбрать какими угодно. Переход из одного состояния в другое может быть произведен вдоль произвольной кривой, соединяющей точки 1 и 2. Если эта кривая (например, вдоль изотермы Т2) пересекает двухфазную область, то будет нарушаться физическая однородность вещества – вещество разделится на жидкость и газ. При выходе из двухфазной области вещество снова станет физически однородным и останется таковым в конечном состоянии 2. Если же кривая перехода обходит двухфазную область (процесс 1-3-2), то никаких скачкообразных превращений вещества из газа в жидкость или обратно наблюдаться не будет – вещество все время будет оставаться физически однородным.
92
Из анализа уравнения Ван-дер-Ваальса применительно к критическому состоянию можно получить выражение критических параметров через константы уравнения 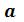 и
и 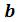 или же определить константы
или же определить константы 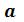 и
и 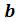 известных критических параметрjd. Учитывая, что уравнение Ван-дер-Ваальса только качественно верно описывает поведение реальных веществ, константы
известных критических параметрjd. Учитывая, что уравнение Ван-дер-Ваальса только качественно верно описывает поведение реальных веществ, константы 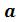 и
и 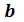 обычно вычисляют на основании экспериментальных данных.
обычно вычисляют на основании экспериментальных данных.
Остановимся несколько подробнее на понятии критического состояния вещества.
Критическая температура и критическое состояние никоим образом не являются понятиями, связанными исключительно с уравнением Ван-дер- Ваальса. Критическое состояние вещества впервые было открыто Д. И. Менделеевым в 1861 г. Критическую температуру Д. И. Менделеев назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т. е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром).
Д. И. Менделеев дал следующее определение: «Абсолютной температурой кипения я называю такую температуру, при которой частицы жидкости теряют свое сцепление (поднятие в капиллярной трубке равно нулю, скрытое тепло равно нулю) и при которой жидкость, несмотря ни на какое давление и объем, вся превращается в пар». Многочисленные опыты с реальными газами полностью подтвердили существование критической точки, в которой исчезает различие между газообразной и жидкой фазами.
Уравнение Ван-дер-Ваальса дает количественное представление о поведении газов, плотность которых не очень велика, и лишь качественное представление о конденсации и критическом состоянии вещества. Поэтому этим уравнением нельзя пользоваться для количественной оценки явлений, протекающих в газе с высокой плотностью.
Кроме уравнения Ван-дер-Ваальса, было предложено много эмпирических или полуэмпирических уравнений состояния реальных газов. За счет увеличения эмпирических постоянных, входящих в эти уравнения, удается достигнуть лучшего согласия с опытом по сравнению с тем, что дает уравнение Ван-
дер-Ваальса. Однако, уравнение Ван-дер-Ваальса благодаря своей простоте и ясному физическому смыслу входящих в него постоянных до сих пор является наиболее распространенным уравнением для анализа качественного поведения реальных газов и жидкостей.
Практически все существующие уравнения состояния применимы лишь в узком интервале переменных либо требуют сложных расчетов. В связи с этим в инженерной практике для расчета реальных газов широкое распространение получили различные таблицы и диаграммы.
93
6.4Водяной пар
6.4.1Изобарный процесс получения водяного пара
Вкачестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и прежде всего в теплоэнергетике, где он является основным рабочим телом. Вода и водяной пар также широко используются в качестве теплоносителей. Поэтому исследование термодинамических свойств воды и водяного пара имеет большое практическое значение.
Парообразование – это процесс превращения вещества из жидкого состояния в газообразное. Парообразование может протекать путем испарения или кипения.
Испарением называется парообразование, которое происходит при любой температуре со свободной поверхности жидкости. Испарение не требует специального подвода теплоты. Как правило, теплота, необходимая для процесса испарения, поглощается из окружающей среды.
Кипение – это парообразование, происходящее при строго определенной, зависящей от состава жидкости и давления окружающей среды температуре, по всему объему жидкости при сообщении ей теплоты.
Производство пара осуществляют в котельных агрегатах (парогенераторах). Полученный пар отправляют к месту использования, откуда он возвращается к парогенератору в виде воды. Процесс производства пара идет при по-
стоянном давлении.
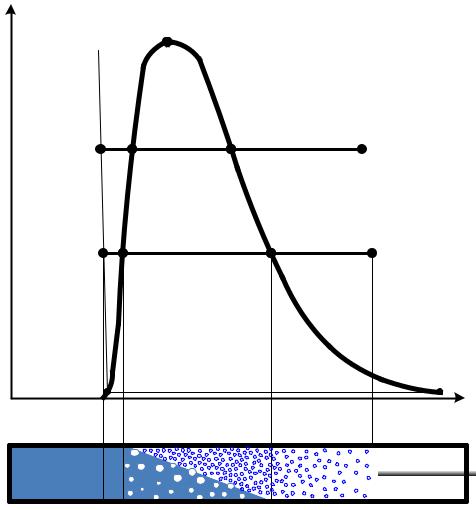
Рассмотрим изобарный процесс получения пара. Для этого 1 кг воды при температуре 0 оС поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу, так чтобы давление, оказываемое на поршень, было постоянным в течение всего процесса. Изобразим процесс парообразования в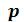 – диаграмме (рисунок 6.5).
– диаграмме (рисунок 6.5).
Начальное состояние воды, находящейся под давлением 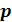 и имеющей температуру 0 оС изобразится на диаграмме точкой A1. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения
и имеющей температуру 0 оС изобразится на диаграмме точкой A1. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения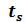 , соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t=4 оС, а затем начинает возрастать. Такой аномалией (увеличением плотности при нагревании в некотором диапазоне температур) обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно. Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой B1.
, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t=4 оС, а затем начинает возрастать. Такой аномалией (увеличением плотности при нагревании в некотором диапазоне температур) обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно. Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой B1.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда - смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой - растет. Температура смеси при этом остается неизменной и равной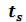 , так как вся теплота расхо-
, так как вся теплота расхо-
94
дуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно-изотермическим.
Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой С1.
Р |
К |
|
0 |
|
= |
|
x |
B2 |
C2 |
D2 |
A2 |
|
|
I |
II |
III |
|
B1 |
C1 |
D1 |
A1 |
|
|
|
|
x |
|
|
= |
|
|
1 |
A’ |
|
A” |
v' |
v" |
v |
Рисунок 6.5 –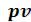 –диаграмма изобарного процесса получения водяного пара I – область не кипящей жидкости; II – область влажного насыщенного пара; III – область перегретого пара;
–диаграмма изобарного процесса получения водяного пара I – область не кипящей жидкости; II – область влажного насыщенного пара; III – область перегретого пара;
Нижняя пограничная кривая A’B1B2K – кипящая жидкость (х = 0); Верхняя пограничная кривая A”C1C2K – сухой насыщенный пар (х = 1).
Насыщенный пар – это пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется.
Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул.
95
При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство, увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
При увеличении объема над поверхностью жидкости, имеющей температуру насыщения, некоторое количество жидкости переходит в пар, при уменьшении объема «излишний» пар снова переходит в жидкость, но в обоих случаях давление пара остается постоянным.
Насыщенный пар подразделяется на влажный насыщенный пар и сухой насыщенный пар.
Сухой насыщенный пар – это насыщенный пар, в котором отсут-
ствует жидкая фаза. Его удельный объем и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров (давлением, удельным объемом или температурой).
Влажный насыщенный пар – это двухфазная смесь из сухого насыщенного пара и кипящей жидкости называется. Для характеристики соот-
ношения различных фаз, содержащихся во влажном насыщенном паре, исполь-
зуют понятия степени сухости и степени влажности.
Степень сухости пара – это массовая доля сухого насыщенного пара во влажном насыщенном паре и обозначается х.
Степень влажности – это массовая доля кипящей воды во влажном паре, равная (1 – х).
Для кипящей жидкости х = 0, а для сухого насыщенного пара х= 1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения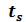 , определяющей это давление) и степенью сухости пара. От начала кипения до полного его завершения, т.е. до стопроцентного выкипания жидкости, к ней надо подвести строго определенное количество теплоты.
, определяющей это давление) и степенью сухости пара. От начала кипения до полного его завершения, т.е. до стопроцентного выкипания жидкости, к ней надо подвести строго определенное количество теплоты.
Теплота парообразования– это количество теплоты, которое необходимо сообщить при постоянном давлении 1 кг нагретой до температуры кипения жидкости для ее превращения в сухой насыщенный пар.
При сообщении сухому насыщенному пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка D1 изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки C1. Таким образом, перегретым паром
называется пар, температура которого превышает температуру насыщенного пара того же давления.

96
Так как удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Рассмотрим процесс парообразования при более высоком давлении (рисунок 6.5). ТочкаA2,соответствующая состоянию 1 кг воды при 0 °С и новом давлении, остается почти на той же вертикали, так как вода практически несжимаема. Точка B2 смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается сухого насыщенного пара (точка C2), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают.
Для воды параметры критической точки К составляют:
Критическая точка является конечной точкой фазового перехода жидкость - пар, начинающегося в тройной точке.
Критическая температура – это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больше критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой. Все газы являются сильно перегретыми сверх Ткр парами. Чем выше температура перегрева (при данном давлении), тем ближе пар по своим свойствам к идеальному газу.
Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного пара, является давление, соответствующее тройной точке. Под тройной точкой понимается то единственное состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А' на рисунке 6.5). Параметры тройной точки для воды:
Процесс парообразования, происходящий при абсолютном давлении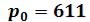 Па, показан на диаграмме изобарой А'А", которая практически
Па, показан на диаграмме изобарой А'А", которая практически
совпадает с осью абсцисс. При более низких давлениях пар может сосущество-
вать лишь в равновесии со льдом. Процесс образования пара непосредствен-
но изо льда называется сублимацией.
Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму A’A1A2 , каждая точка которой соответствует состоя-
97
нию 1 кг воды при 0 °С и давлении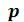 , нижнюю пограничную кривую A’B1B2K, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую A”C1C2K, дающую зависимость удельного объема сухого насыщенного пара от давления.
, нижнюю пограничную кривую A’B1B2K, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую A”C1C2K, дающую зависимость удельного объема сухого насыщенного пара от давления.
Все точки области II между кривыми A’B1B2K и A”C1C2K соответствуют состояниям влажного насыщенного пара, точки кривой A’B1B2K определяют состояние кипящей воды, точки кривой A”C1C2K - состояния сухого насыщенного пара. Влево от кривой A’B1B2K до нулевой изотермы лежит область I некипящей однофазной жидкости, в право от кривой A”C1C2K – область III перегретого пара. Т.о., кривые A’B1B2K и A”C1C2K определяют область насыщенного пара II, отделяя ее от области воды I и перегретого пара III, и поэтому называются пограничными (кривая A’B1B2K – нижняя пограничная кри-
вая; кривая A”C1C2 K – верхняя пограничная кривая). Выше точки К, где по-
граничных кривых нет, находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.
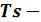 диаграмма водяного пара
диаграмма водяного пара
На рисунке 6.6 показан изобарный процесс получения водяного пара в  координатах. Состояние воды в тройной точке (s0 = 0; Т0 = 273,16 К) изображается в диаграмме точкой А'. Следует отметить, что ввиду аномальности воды (максимальная плотность при +4 °С) вблизи 0 о С изобары жидкости имеют сложное строение, что, однако, мало сказывается на практических расчетах. Поэтому на рисунке 6.6 для упрощения изобара в области жидкости дана, как для нормальной жидкости.
координатах. Состояние воды в тройной точке (s0 = 0; Т0 = 273,16 К) изображается в диаграмме точкой А'. Следует отметить, что ввиду аномальности воды (максимальная плотность при +4 °С) вблизи 0 о С изобары жидкости имеют сложное строение, что, однако, мало сказывается на практических расчетах. Поэтому на рисунке 6.6 для упрощения изобара в области жидкости дана, как для нормальной жидкости.
Влево от нижней пограничной кривой располагается область жидкости I, между пограничными кривыми - двухфазная область влажного насыщенного пара II, вправо и вверх от верхней пограничной кривой - область перегретого пара III. Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси (пар + лед).
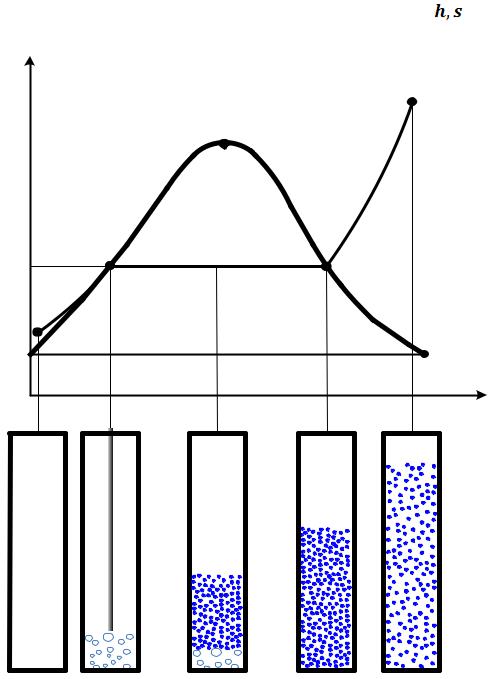
Теплота парообразования r на  диаграмме изображается площадью под линией процесса парообразования ВС. Поскольку с повышением давления (температуры) точки В и С сближаются между собой, теплота парообразования с ростом температуры насыщения Ts уменьшается, пока не обратится в 0 при Ts = TK .
диаграмме изображается площадью под линией процесса парообразования ВС. Поскольку с повышением давления (температуры) точки В и С сближаются между собой, теплота парообразования с ростом температуры насыщения Ts уменьшается, пока не обратится в 0 при Ts = TK .
6.4.2Определение параметров воды и пара
Врасчетной практике, вследствие сложности уравнений состояния для паров, используют таблицы и диаграммы, составленные на основании опытных
итеоретических данных.
Таблицы воды и водяного пара. Справочник «Таблицы теплофизических свойств воды и водяного пара» состоит из нескольких таблиц. Термодинамические параметры кипящей воды и сухого насыщенного пара берутся из таблиц
98
«Термодинамические свойства воды и водяного пара в состоянии насыщения». В этих таблицах термодинамические величины со штрихом (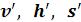 ) относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами (
) относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами (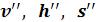 ) – к сухому насыщенному пару.
) – к сухому насыщенному пару.
За нулевое состояние, от которого отчитываются величины принято состояние воды в тройной точке.
T
|
x |
= |
0 |
I |
|
||
|
|
||
|
|
|
Ts B1
A1
A’ 
s'
К
II
r
D1
x |
III |
= |
|
1 |
|
C1 |
|
A” |
s" |
s |
Рисунок 6.6 – Ts– диаграмма изобарного процесса получения водяного пара
I – область некипящей жидкости; |
II – область влажного насыщенного пара; |
III – область перегретого пара; |
r – теплота парообразования. |
Нижняя пограничная кривая A’B1K – кипящая жидкость (х = 0); Верхняя пограничная кривая A”C1K – сухой насыщенный пар (х = 1);
99
Так как состояние кипящей воды и сухого насыщенного пара определяется только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения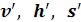 и
и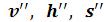 . Кроме этих значений в таблицах приводятся величины теплоты парообразования r и разности энтропий сухого насыщенного пара и кипящей жидкости (
. Кроме этих значений в таблицах приводятся величины теплоты парообразования r и разности энтропий сухого насыщенного пара и кипящей жидкости (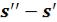 ) .
) .
Поскольку процесс парообразования ВС является одновременно и изобарным и изотермическим (рисунки 6.5 и 6.6), то, используя первый закон термодинамики (3.26) и формулу (4.18), легко доказать, что:
Параметры влажного насыщенного пара определяют по правилу аддитивности по заданному давлению (или температуре) и степени сухости. Поскольку в 1 кг влажного насыщенного пара содержится х кг сухого насыщенного пара и (1-х) кг кипящей воды, то:
Однофазные состояния не кипящей воды и перегретого пара задаются двумя параметрами. По заданным давлению и температуре из таблиц «Термодинамические свойства воды и перегретого пара» находят значения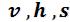 .
.
Внутренняя энергия воды и пара в любом состоянии рассчитывается с помощью выражения (3.12):
 диаграмма водяного пара.
диаграмма водяного пара.
Каждое состояние можно изобразить точкой на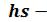 диаграмме. На рисунке 6.7 показана структура
диаграмме. На рисунке 6.7 показана структура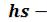 диаграммы для водяного пара, которая строится по числовым данным таблиц водяного пара.
диаграммы для водяного пара, которая строится по числовым данным таблиц водяного пара.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения 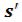 и
и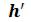 для воды при температуре кипения, а также
для воды при температуре кипения, а также 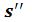 и
и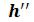 для сухого насыщенного пара, получаем нижнюю (х=0) и верхнюю (х=1) пограничные кривые. Критическая точка К лежит не на вершине, как это было в
для сухого насыщенного пара, получаем нижнюю (х=0) и верхнюю (х=1) пограничные кривые. Критическая точка К лежит не на вершине, как это было в 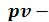 и
и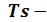 диаграммах, а на левом склоне пограничной кривой.
диаграммах, а на левом склоне пограничной кривой.
