
- •Лабораторная работа № 1 лабораторное оборудование. Техника выполнения лабораторных работ
- •Лабораторная работа №2 эквивалент и молярная масса эквивалента
- •В окислительно – восстановительной реакции
- •Давление насыщенного пара. Определив объем водорода при н.У., вычисляют массу 1 моля эквивалента металла:
- •Выполнение опыта
- •Лабораторная работа № 3 электронная структура атомов и одноатомных ионов
- •Лабораторная работа №4 измерение тепловых эффектов химических реакций и расчет энергии гиббса процессов
- •Лабораторная работа № 5 кинетика химических реакций
- •Лабораторная работа №6 химическое равновесие
- •Опыт 1. Влияние концентрации веществ на химическое равновесие
- •Домашнее задание:
- •Лабораторная работа №7 адсорбционное равновесие
- •Опыт 1. Адсорбция уксусной кислоты активированным углем
- •Домашнее задание
- •Лабораторная работа № 8 свойства водных растворов электролитов.
- •В установку для измерения электропроводности поочередно вводят выше указанные реактивы и подключают установку к сети. Во всех случаях наблюдают за индикаторной лампой используемой установки.
- •Контрольные вопросы и задачи:
- •Ответ: 1,32·10-3 моль/л; 5,16 см2·Ом-1.
- •Лабораторная работа 9 водородный показатель среды рН
- •Лабораторная работа 10 гидролиз солей
- •Пример расчета величины константы гидролиза для соли
- •Лабораторная работа № 11 электродвижущие силы (эдс) и напряжение гальванических элементов
- •1.Измерение эдс
- •2.Напряжение элемента.
- •Лабораторная работа № 12 электролиз
Домашнее задание
Контрольные вопросы и задачи к лабораторной работе №8 «Адсорбционное равновесие». Коровин Н.В., и др., Лабораторные работы по химии, 1986 г., с.67.
Лабораторная работа № 8 свойства водных растворов электролитов.
Цель работы: на опыте убедиться в способности веществ и растворов проводить электрический ток. Изучить зависимость степени диссоциации слабого электролита от его концентрации в растворе. Научиться расcчитывать ионную силу раствора сильного электролита, а также активность ионов этого элемента.
Электролитами называют вещества, диссоциирующие в воде, других полярных жидкостях или расплавах, на ионы и способные проводить электрический ток. Распад вещества на ионы называется электролитической диссоциацией. Перенос тока в растворах и расплавах электролитов осуществляется ионами, поэтому их в отличие от электронных проводников называют ионными проводниками или проводниками второго рода. К электролитам относят соли, кислоты, основания.
Для количественной характеристики
электролитической диссоциации вводится
понятие степени диссоциации: ![]() ,
,
где:
С – концентрация продиссоциировавших
молекул, моль/л; С0
– исходная
концентрация раствора, моль/л;![]()
По величине степени диссоциации все электролиты делят на сильные и слабые. К сильным относят те, степень диссоциации которых равна единице, т. е. С = С0. Электролитическая диссоциация сильных электролитов протекает необратимо:
HNO3
![]() H+
+ NO3-
H+
+ NO3-
NaCl Na+ + Cl-
К сильным электролитам относятся практически все соли, гидроксиды щелочных и щелочноземельных металлов и некоторые кислоты (например HCl, HNO3, H2SO4).
Степень диссоциации слабых электролитов меньше единицы ( С < С0 ).
Их диссоциация протекает обратимо:
CH3COOH
![]() CH3COO-
+ H+
CH3COO-
+ H+
H2SO3 H+ + HCO3-
Константу равновесия электролитической диссоциации слабого электролита называют константой диссоциации. Например, при 298 К:
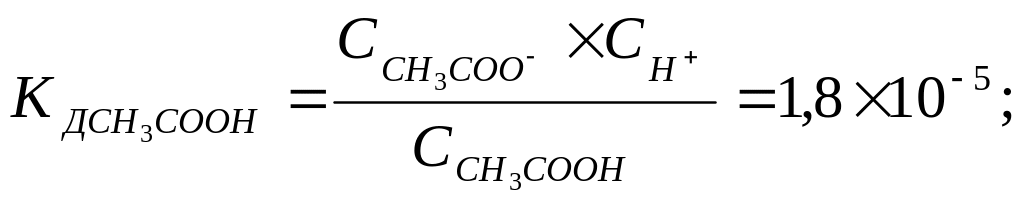

Сравнивая
значения
![]() и
и
![]() ,
можно сказать, что у угольной кислоты
способность к диссоциации на ионы
меньше, чем у уксусной.
,
можно сказать, что у угольной кислоты
способность к диссоциации на ионы
меньше, чем у уксусной.
Степень () и константа диссоциации (Кд) слабого электролита связаны зависимостью (закон Оствальда):
![]() если α<<1,
если α<<1,
то уравнение упрощается:
![]()
![]()
где:
![]() - разведение раствора, л/моль.
- разведение раствора, л/моль.
Из закона разбавления Оствальда следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита.
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем КД по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
В растворах электролитов осуществляются межионные взаимодействия, обусловленные силами притяжения и отталкивания. Наиболее заметны межионные взаимодействия в растворах сильных электролитов.
Для количественной характеристики межионных взаимодействий используется ионная сила раствора (полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда):
I
=
![]()
![]() Cizi2
Cizi2
Зная ионную силу раствора I, можно найти коэффициент f, позволяющий определить некоторую величину а (активность), формально заменяющую концентрацию С при математических описаниях свойств растворов электролитов:
аi = fiCi,
где: fi - коэффициент активности иона, который является функцией ионной силы раствора I и заряда иона zi.
Опыт: Демонстрация электропроводности электролитов и неэлектролитов.
Реактивы и оборудование.
Сахар(т) CH3COOH конц. 16м
Сахар(р-р) CH3COOH 8м
NaCl(т) CH3COOH 4м
NaCl(р-р) CH3COOH 2м
H2O(водопров.) NaOH 1м
H2O(дистил.) NaOH 0,2м
Установка для определения электропроводности.
Проведение опыта:
