
- •Лабораторная работа № 1 лабораторное оборудование. Техника выполнения лабораторных работ
- •Лабораторная работа №2 эквивалент и молярная масса эквивалента
- •В окислительно – восстановительной реакции
- •Давление насыщенного пара. Определив объем водорода при н.У., вычисляют массу 1 моля эквивалента металла:
- •Выполнение опыта
- •Лабораторная работа № 3 электронная структура атомов и одноатомных ионов
- •Лабораторная работа №4 измерение тепловых эффектов химических реакций и расчет энергии гиббса процессов
- •Лабораторная работа № 5 кинетика химических реакций
- •Лабораторная работа №6 химическое равновесие
- •Опыт 1. Влияние концентрации веществ на химическое равновесие
- •Домашнее задание:
- •Лабораторная работа №7 адсорбционное равновесие
- •Опыт 1. Адсорбция уксусной кислоты активированным углем
- •Домашнее задание
- •Лабораторная работа № 8 свойства водных растворов электролитов.
- •В установку для измерения электропроводности поочередно вводят выше указанные реактивы и подключают установку к сети. Во всех случаях наблюдают за индикаторной лампой используемой установки.
- •Контрольные вопросы и задачи:
- •Ответ: 1,32·10-3 моль/л; 5,16 см2·Ом-1.
- •Лабораторная работа 9 водородный показатель среды рН
- •Лабораторная работа 10 гидролиз солей
- •Пример расчета величины константы гидролиза для соли
- •Лабораторная работа № 11 электродвижущие силы (эдс) и напряжение гальванических элементов
- •1.Измерение эдс
- •2.Напряжение элемента.
- •Лабораторная работа № 12 электролиз
Пример расчета величины константы гидролиза для соли
NH4C1 + Н20 NH4OH + HC1
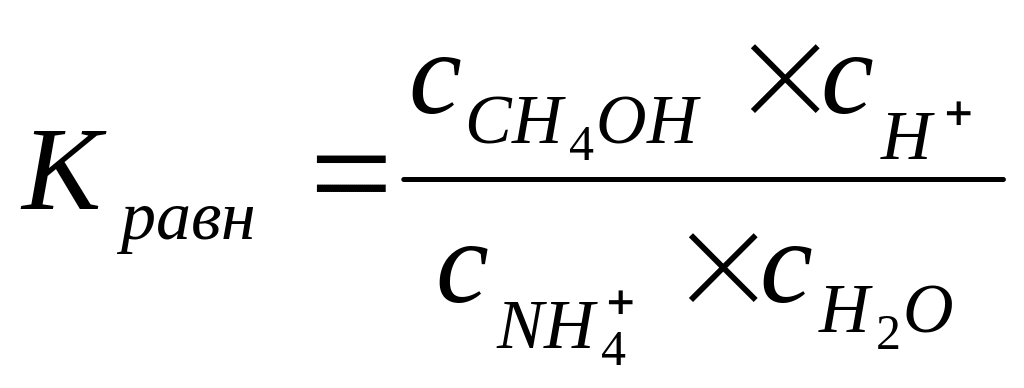 ;
;
![]() ;
;
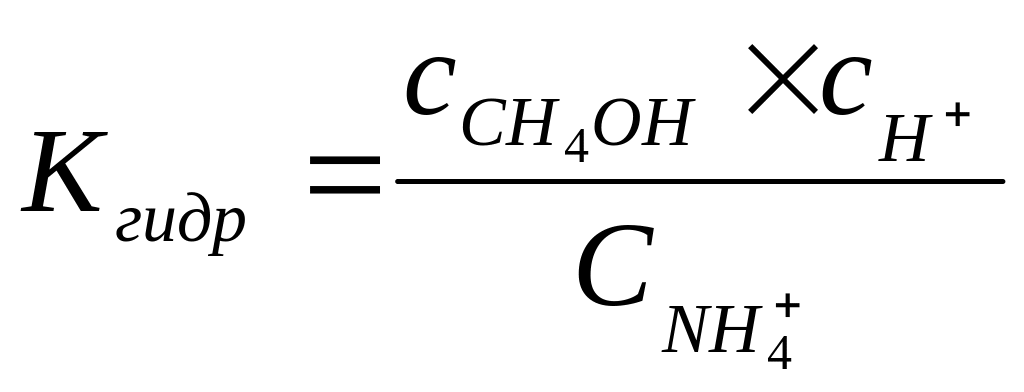 .
.
Умножим числитель и знаменатель на сон-. Получим
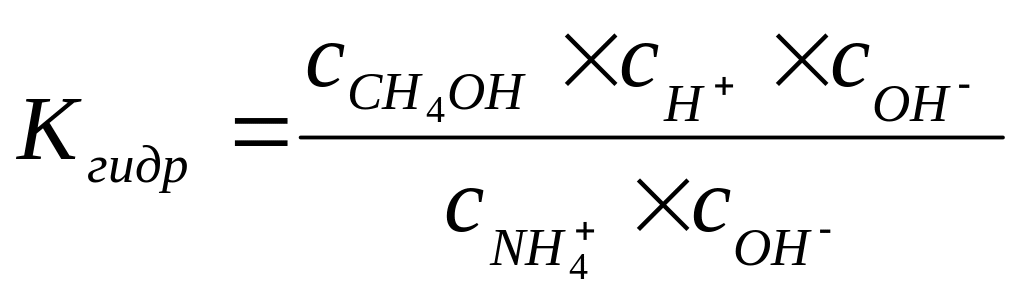 ;
;
или
![]() ;
;
где:
Кw
= 10-14
– ионное произведение воды; К![]() – константа диссоциации (в справочнике).
– константа диссоциации (в справочнике).
Опыт 2. Гидролиз соли, образованной сильным основанием и слабой кислотой.
Рассчитайте навеску для приготовления 100 мл раствора карбоната натрия Na2CO3 заданной молярной концентрации, (задание получите у преподавателя). Получите навеску у лаборанта и приготовьте в мерной колбе раствор Na2CO3. Для приготовления раствора в колбу наливают немного дистиллированной воды, вносят навеску и растворяют ее в этой воде. Потом наливают воды на 0,5-1,0 см ниже метки, после чего доводят до метки, добавляя воду по каплям из промывалки. Затем плотно закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз.
Измерьте рН приготовленного раствора с помощью рН – метра.
Закончите оформление результатов опыта сравнением измеренного и вычисленного значении рН.
Контрольные вопросы и задачи:
1.Имеются растворы солей KCl, NaCl, AlCl3. В каких растворах концентрация иона Н+ равна концентрации иона ОН-? Ответ поясните.
2.Можно ли, пользуясь фенолфталеином, отличить водный раствор Na2SiO3 от водного раствора Na2SO4? Ответ поясните.
3.Можно ли с помощью рН – метра отличить водный раствор KCl от водного раствора NH4Cl? Ответ поясните.
4.Справедливо ли утверждение о том, что водные растворы NaCl и KCl имеют одинаковое значение водородного показателя среды? Ответ поясните.
5.Используя справочные данные, рассчитайте константу гидролиза соли CH3COONa. Ответ:5,710-10.
6.Используя справочные данные, рассчитайте степень гидролиза соли CH3COONa в 0,01 М растворе. Ответ: 2,3910-4 (2,3910-2 %).
Лабораторная работа № 11 электродвижущие силы (эдс) и напряжение гальванических элементов
Цель работы: овладение методикой измерения ЭДС и напряжения гальванических элементов
и изучение зависимости напряжения от плотности тока.
Если в гальваническом элементе протекает суммарная электродная реакция
bB + dD lL + mM
то ЭДС (Еэ) этого элемента записывается уравнением:
 ,
,
где:
![]() - стандартная ЭДС ,-В;
- стандартная ЭДС ,-В;
![]() ;
;
![]() ;
;
![]() ;
;
![]() – активности реагирующих веществ и
продуктов реакции, моль/л.
– активности реагирующих веществ и
продуктов реакции, моль/л.
Например, для реакции:
Zn + 2Ag+ Zn2+ + 2Ag

Так как активности твердых цинка и серебра принимаются равными единице, то уравнение упрощается:
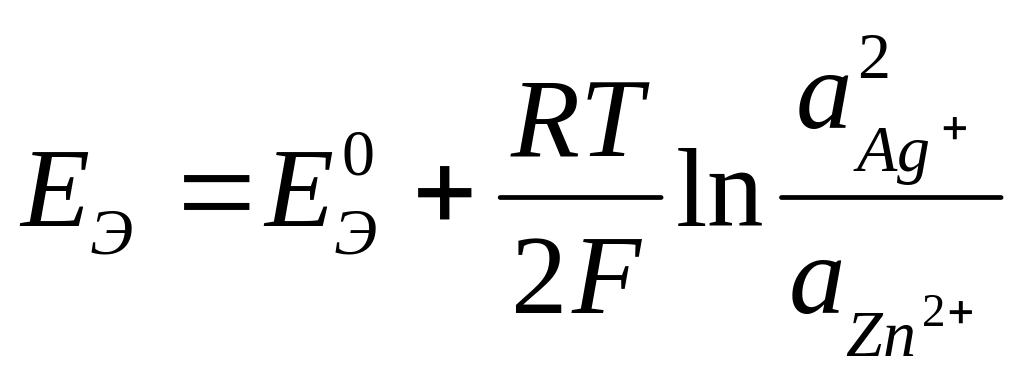
Стандартную ЭДС гальванического элемента можно рассчитать либо по известным значениям стандартной энергии Гиббса реакции:
![]()
либо по разности стандартных равновесных потенциалов электродов:
![]()
Воспользовавшись вторым способом, получим:
E![]() =
0,80B
– ( -0 ,76)B
= 1,56 B
=
0,80B
– ( -0 ,76)B
= 1,56 B
Зная стандартное значение ЭДС (потенциала) и активности ионов, можно рассчитать ЭДС
элемента (равновесный потенциал).
Если в токообразующих реакциях участвуют газообразные вещества, ЭДС элемента зависит от
парциальных давлений этих веществ. Например, ЭДС элемента, в котором протекает реакция:
Zn + Cl2 Zn2+ + 2Cl-
определяют по уравнению
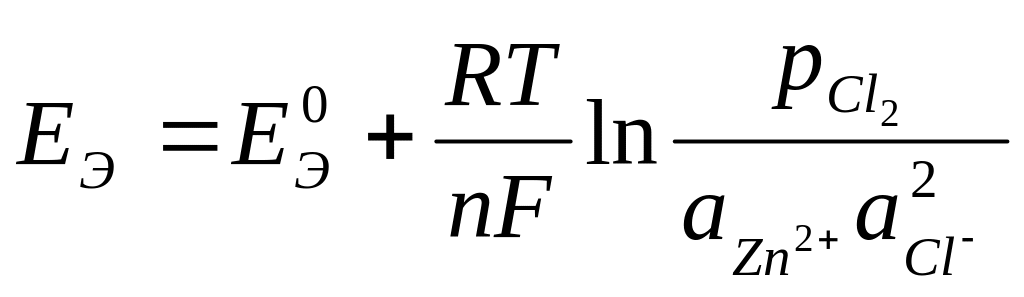 ,
,
где:
![]() - парциальное давление хлора.
- парциальное давление хлора.
Напряжение гальванического элемента меньше ЭДС из–за поляризации электродов и
омических потерь:
U = EЭ – IR – EЭ,
где: I – ток, А; R - омическое сопротивление, Ом; ΔEЭ - поляризация элемента, равная сумме
поляризаций катода и анода, В.
С увеличением плотности тока возрастают поляризация и омическое падение напряжения. Таким образом, при увеличении плотности тока напряжение элемента падает. Кривая зависимости напряжения элемента от силы или плотности тока получила название вольтамперной кривой. По мере работы элемента (разряда) уменьшается концентрация исходных реагентов и увеличивается концентрация продуктов реакции, поэтому в соответствии с уравнением Нернста ЭДС элемента уменьшается. Кроме того возрастает поляризация элемента. Поэтому при разряде элемента напряжение его постепенно падает. Кривая изменения напряжения во времени в процессе разряда называется разрядной кривой элемента.
Опыт 1. Измерение ЭДС и напряжения элемента.
