- •Лабораторная работа № 1 лабораторное оборудование. Техника выполнения лабораторных работ
- •Лабораторная работа №2 эквивалент и молярная масса эквивалента
- •В окислительно – восстановительной реакции
- •Давление насыщенного пара. Определив объем водорода при н.У., вычисляют массу 1 моля эквивалента металла:
- •Выполнение опыта
- •Лабораторная работа № 3 электронная структура атомов и одноатомных ионов
- •Лабораторная работа №4 измерение тепловых эффектов химических реакций и расчет энергии гиббса процессов
- •Лабораторная работа № 5 кинетика химических реакций
- •Лабораторная работа №6 химическое равновесие
- •Опыт 1. Влияние концентрации веществ на химическое равновесие
- •Домашнее задание:
- •Лабораторная работа №7 адсорбционное равновесие
- •Опыт 1. Адсорбция уксусной кислоты активированным углем
- •Домашнее задание
- •Лабораторная работа № 8 свойства водных растворов электролитов.
- •В установку для измерения электропроводности поочередно вводят выше указанные реактивы и подключают установку к сети. Во всех случаях наблюдают за индикаторной лампой используемой установки.
- •Контрольные вопросы и задачи:
- •Ответ: 1,32·10-3 моль/л; 5,16 см2·Ом-1.
- •Лабораторная работа 9 водородный показатель среды рН
- •Лабораторная работа 10 гидролиз солей
- •Пример расчета величины константы гидролиза для соли
- •Лабораторная работа № 11 электродвижущие силы (эдс) и напряжение гальванических элементов
- •1.Измерение эдс
- •2.Напряжение элемента.
- •Лабораторная работа № 12 электролиз
Лабораторная работа №4 измерение тепловых эффектов химических реакций и расчет энергии гиббса процессов
Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
В любом процессе соблюдается закон сохранения энергии: теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии U и на совершение системой работы А над внешней средой (первый закон термодинамики):
q=U + A
Если химическая реакция протекает в открытом сосуде при постоянной температуре (р, T=const) и единственным видом совершаемой работы является работа расширения (А=р V), то тепловой эффект этой реакции равен изменению энтальпии системы:
qP,T = U +рV = H,
где: H=U+pV
При Н > 0 (когда теплота подводится к системе из окружающей среды и q < 0) реакцию называют эндотермической. При Н < 0 (когда теплота выделяется в окружающую среду и q > 0) реакцию называют экзотермической.
Если в уравнении химической реакции указан ее тепловой эффект, уравнение называют термохимическим. Например,
N2(г) + ЗН2(г) = 2NH3(г), Н°298 = - 92,4 кДж
При записи .термохимческих уравнений указывают:
а) агрегатные состояния или аллотропные модификации веществ;
б) условия протекания процесса (Н°298 – стандартный тепловой эффект реакции при 298 К).
Тепловой эффект химической реакции зависит от количества реагирующих и получающихся веществ. Так, например, при нейтрализации в водном растворе 0,1 моль NaOH избытком соляной кислоты выделяется 5,7 кДж теплоты, а при нейтрализации 10 моль NaOH – 570 кДж.
Возможность и пределы самопроизвольного протекания реакции при p,T = const определяют с учетом энергии Гиббса G = H – TS, где Н – энтальпия, S – энтропия, Т – температура.
Изменение энергии Гиббса в ходе химической реакции G называют энергией Гиббса химической реакции. В тех случаях, когда G 0 реакция протекает самопроизвольно. Пределом самопроизвольного течения реакции является условие G = 0.
Величины Н, S и G вычисляют на основании следствий из закона Гесса. Изменение энтропии S, энергии Гиббса химической реакции G так же, как тепловой эффект реакции Н, зависят от количества веществ в системе.
Опыт 1. Определение теплоты нейтрализации сильной кислоты сильным гидроксидом и расчет энергии Гиббса
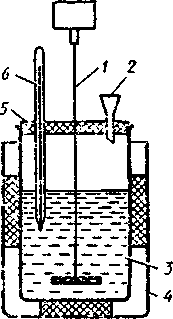
Для измерения тепловых эффектов реакций калориметры или калориметрические установки (рис. 1). В наружный сосуд (стакан на 0,8 л) вставляется калориметрический стакан меньшей вместимостью (0,5 л). во избежании потерь теплоты через стенки стакана между сосудами располагают пробковые прокладки. Калориметрический стакан закрывают деревянной крышкой с отверстиями для термометра (цена деления 0,1 К), мешалки и воронки. Мешалку присоединяют к электромотору или приводят в движение вручную. Теплоту, выделяющуюся или поглощающуюся в калориметре вычисляют по формуле q = c(T2 – Т1), где Т2 и t1 - конечная и начальная температура жидкости в калориметрическом стакане; с - теплоемкость системы, равная c1m1 + с2m2 (m1 и m2 – массы калориметрического стакана и жидкости в стакане; с1 и с2 - удельные теплоемкости стекла и жидкости).
Согласно теории электролитической диссоциации нейтрализации сильной кислоты сильным основанием в разбавленном растворе отвечает уравнению Н + + ОН - = Н2О. Стандартная теплота нейтрализации сильной кислоты сильным основанием равна при 298 К – 55,9 кДж на один моль образующейся воды.
Энтропия системы рассматривается в термодинамике как мера неупорядоченности системы.
|
Данные опыта сведите в таблицу:
По полученным данным определите:
1.Разницу температур (Т2 – Т1);
2.Массу жидкости (m2) в калориметрическом стакане (при расчете считать плотность жидкости равной единице);
3.Теплоемкость системы (при расчете считать удельную теплоемкость стекла с1 = 0,75103 Дж/(кгК), а удельную теплоемкость раствора с2 = 4,18103 Дж/(кгК);
4.Количество теплоты q, выделившейся при реакции;
5.Число
молей нейтрализованной кислоты (щелочи)
или число молей полученной воды (n![]() ),
учитывая заданную молярную концентрацию
и объем раствора;
),
учитывая заданную молярную концентрацию
и объем раствора;
6.Теплоту
нейтрализации Н![]() (кДж/моль
Н2О);
(кДж/моль
Н2О);
7.Сравните полученную теплоту нейтрализации с теоретической и рассчитайте абсолютную и относительную ошибку опыта;
8.Запишите термохимическое уравнение проведенной реакции нейтрализации;
9.Объясните убыль энтальпии в процессе нейтрализации сильной кислоты сильным основанием.