
- •Задачи 21—40
- •Тема 3. Периодическая система д. И. Менделеева и химические свойства элементов
- •Тема 4. Химическая связь
- •Задачи 61—80
- •Тема 5. Окислительно-восстановительные
- •Тема 6. Химические свойства элементов
- •Тема 8. Химическая термодинамика Теоретические основы
- •Тема 9.Химическая кинетика и равновесие
- •Тема10.Электролитическая диссоциация.
- •Тема 11.Растворимость веществ.
- •Тема 12. Гидролиз
- •Тема 14. Коррозия металлов и способы защиты от неё
Тема 11.Растворимость веществ.
Произведение растворимости
Теоретические основы
Растворимостью (S) называется способность вещества образовывать растворы с другими веществами. Количественно растворимость характеризуется концентрацией вещества в насыщенном растворе.
В насыщенном растворе сильного малорастворимого электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например,
BaSO4
< =![]() > Bа2+
+ SO42-
> Bа2+
+ SO42-
в осадке в растворе
Поскольку электролит малорастворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности мало отличаются от единицы, то константа равновесия процесса диссоциации выразится уравнением:

Числитель этой дроби, представляющий произведение концентрации катионов и анионов, есть величина постоянная и называется произведением растворимости (ПР). Таким образом, произведение растворимости насыщенного раствора BaSO4 может быть записано в следующей форме:
ПР
BaSO![]() =[Ba2+][SO42-]
=[Ba2+][SO42-]
![]()
Пусть растворимость BaSO4, равна S моль/л. Тогда концентрации ионов [Ba2+] и [SO42-] также составит S моль/л. Поэтому можно записать: ПР BaSO = S · S = S2
и растворимость равна
S
=![]() .
.
Если молекула электролита при диссоциации образует два или несколько одинаковых ионов, то в выражении для ПР концентрации этих ионов должны быть возведены в соответствующие степени, например:
Cr(OH)3 < = > Cr3+ + 3OH-
S (моль) S 3S
ПР![]() =
[Cr3+
=
[Cr3+![]() ][OH-]3
=
S · (3S)3
= 27 S4
][OH-]3
=
S · (3S)3
= 27 S4
S =![]()
Осадок из раствора выпадает тогда, когда произведение концентраций соответствующих малорастворимому соединению превышает значение ПР.
Пример: Образуется ли осадок Ag2SO4 (ПР=2·10 –5), если слить равные объемы нитрата серебра (С=0,2 моль/л) и сульфата натрия ( С=0,1 моль/л)?
Уравнение диссоциации Ag2SO4:
Ag2SO4
![]()
![]() 2
Ag+
+ SO42–
2
Ag+
+ SO42–
ПРAgNO
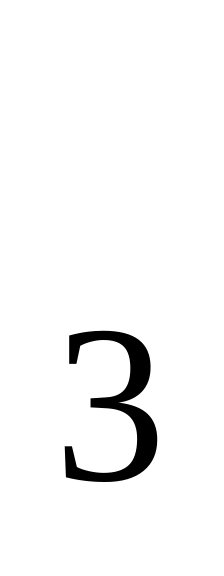 =
[Ag+]2[SO4]2-
=
[Ag+]2[SO4]2-
До сливания [AgNO3] = [Ag+] = [NO3-] = 0,2 моль/л
[Na2SO4] = 1/2 [Na+] = [SO4]2- = 0,1 моль/л
После сливания происходит разбавление в 2 раза:
[Ag+] = 0,1 моль/л , [SO4]2- = 0,05 моль/л
Произведение концентраций ионов, из которых может образоваться осадок AgSO4:
[Ag+]2[SO4]2- = (0,1)2· 0,05 = 5· 10-4> ПР,
т.е. осадок осадок AgSO4 выпадает.
Задачи 61—68
Исходя из значений ПР, вычислить растворимость соединения:
61. Fe(OH)2 ПР= 1· 10 -5
62. Fe(OH)3 ПР= 3,8· 10 –38
63. Ag2CrО4 ПР= 4· 10 –12
64. СаСО3 ПР= 5· 10 –9
65. Ag2SO4 ПР= 2· 10 –5
66. Са3(РО4)2 ПР= 1· 10 –29
67. РвВг2 ПР= 9,1· 10 –6
68. MgNH4PO4 ПР= 2,5· 10 –13
Задачи 69—74
По известным значениям растворимости соединений, найти ПР.
69. Mg(ОН)2 ; S = 1,7· 10 –4 моль/л
70. ВаSO4 ; S = 1,1· 10 –10 моль/л
71. СаСО3 ; S = 6,9 · 10 –5 моль/л
72. РвВг2 ; S = 1,32· 10 –2 моль/л
73. Ag2Cr2О7 ; S = 3,684· 10 –3 моль/л
74. Fe(OH)3 S = 1,937· 10 –10 моль/л
Задачи 75—80
Образуется ли осадок нерастворимого соединения, если смешать равные объемы двух веществ с заданными концентрациями?
75. 0,01 М раствор СаС12 и 0,02 М раствор Nа2SО4 (ПР СaSO = 1,3·10–4).
76. 0,01 М раствор AgNO3 и 0,001 М раствор Н2SО4 (ПРAgCl =1,8·10–10).
77. 0,0001 М раствор СаС12 и 0,0001 М раствор Н3РО4 (ПР Сa (РО )= 1·10–29).
78. 0,02 М раствор Pb(NO3)2
и 0,02 М раствор KBr
(ПРPbBr![]() =9,1·10–6).
=9,1·10–6).
79. 0,01 М раствор FeSО4 и 0,004 М раствор NaОH (ПРFe(OH) =1·10–5).
80. 0,0001 М раствор AgNO3 и 0,001 М раствор Nа2CrО4 (ПРAg CrO =4·10–12).
