
- •Оглавление
- •Тема 2. Строение вещества 6
- •Тема 1. Химический эквивалент. Закон эквивалентов.
- •Тема 2. Строение вещества
- •Тема 3. Основные закономерности протекания химических процессов
- •Тема 5. Растворы электролитов
- •Тема 6. Общие свойства растворов
- •Тема 7. Комплексные соединения
- •Тема 8. Электрохимические процессы
Тема 8. Электрохимические процессы
Гальванический элемент
Задание 1. Дан электрод (см. вариант в табл. 10).
Запишите схему двух гальванических элементов, в которых заданный электрод будет: в одном случае – анодом, в другом – катодом. В одном из случаев в качестве второго электрода используйте газовый водородный электрод.
Для каждого гальванического элемента запишите электрохимическую систему (гальванический элемент), уравнения электродных реакций, суммарной реакции, определяющих работу этого элемента.
Рассчитайте равновесное напряжение гальванического элемента, составленного из заданного электрода и водородного электрода с заданным рН раствора и парциальным давлением водорода.
Задание 2. Гальванический элемент составлен из электродов (см. вариант в табл. 11).
Подберите электролиты и запишите электрохимическую систему (гальванический элемент).
Запишите уравнения электродных реакций и суммарной реакции, определяющие работу гальванического элемента.
Рассчитайте равновесное напряжение гальванического элемента, составленного из указанных электродов с учетом активности потенциалопределяющих ионов (а).
Рассчитайте энергию Гиббса, используя равновесное напряжение гальванического элемента.
Стандартные электродные потенциалы электродов приведены в приложении 6.
Таблица 10
-
Номер
варианта
Электрод
рН
раствора
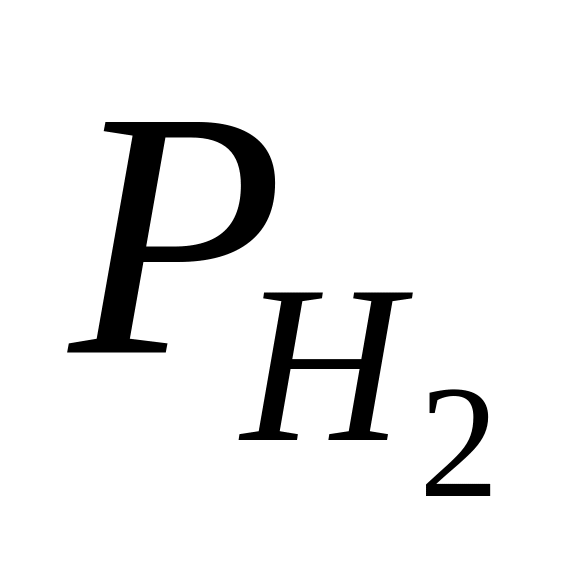 ,
,
мм рт. cт.
1
W|W3+
2
0,1
2
Ag|Ag+
1
0,4
3
Cu|Cu2+
4
0,5
4
Pd|Pd2+
3
0,3
5
Ni|Ni2+
2
0,7
6
Co|Co2+
5
0,4
7
Ag|AgCl,KCl
7
0,8
8
Fe|Fe2+
6
1,5
9
Bi|Bi3+
4
0,2
10
Pb|Pb2+
3
0,5
11
Sn|Sn2+
2
1,2
12
Ti|Ti3+
5
0,9
13
Cr|Cr3+
3
0,4
14
In|In3+
1
0,2
15
Mn|Mn2+
2
1,3
16
Tl|Tl+
4
0,5
17
Pt|Pt2+
3
0,6
18
Cu|Cu+
2
0,7
19
Mo|Mo3+
6
0,4
20
(Pt)Cl2|Cl-
6
0,8
21
Ti|Ti2+
5
1,1
22
Zn|Zn2+
2
0,7
23
Cd|Cd2+
3
0,5
24
Mg|Mg2+
4
1,2
25
Sb|Sb3+
5
0,8
Таблица 11
-
Номер варианта
Электрод I
Электрод II
Активность потенциал определяющих ионов а, моль/л
электрода I
электрода II
1
Ag|AgCl,KCl
Ag|Ag+
0,1
0,02
2
Mo|Mo3+
Zn|Zn2+
0,2
0,8
3
(Pt)F2|F-
Cd|Cd2+
0,3
0,5
4
Mo|Mo3+
(Pt)Cl2|Cl-
0,4
2,0
5
Au| Au+
Sn|Sn2+
0,05
1,5
6
Ag|Ag+
Zn|Zn2+
0,1
1,7
7
Cu|Cu+
Ti|Ti3+
0,6
0,3
8
Pt|Pt2+
Sn|Sn2+
0,03
1,2
9
Bi|Bi3+
Bi|Bi3+
0,05
1,3
10
Mg|Mg2+
In|In3+
1,6
0,2
11
Pb|Pb2+
Ti|Ti2+
0,3
0,5
12
Cu|Cu2+
Cr|Cr3+
0,8
0,2
13
Au|Au3+
Sb|Sb3+
0,03
0,4
14
Pd|Pd2+
Ag|AgCl,KCl
0,01
1,0
15
Fe|Fe2+
Sb|Sb3+
0,8
0,2
16
In|In3+
(Pt)Cl2|Cl-
0,2
1,7
17
Ti|Ti3+
(Pt)F2|F-
0,5
0,8
18
Mn|Mn2+
Zn|Zn2+
0,8
0,5
19
Cr|Cr3+
Ag|AgCl,KCl
0,7
0,1
20
Cd|Cd2+
Pd|Pd2+
0,5
0,04
21
Cu|Cu2+
Cu|Cu2+
2,1
0,1
22
V|V2+
Sn|Sn2+
1,4
0,3
23
(Pt)Cl2|Cl-
Cu|Cu2+
1,5
0,5
24
(Pt)O2|OH-
(Pt)H2|H+
0,5
1,3
25
Pd|Pd2+
Co|Co2+
0,03
0,9
Электролиз водных растворов электролитов
Задание 3. Дан водный раствор электролита (см. вариант в таб. 12), для его электролиза используйте приведенный в таблице анод.
Запишите электрохимическую систему, уравнения электродных реакций.
Укажите рН раствора до электролиза (больше, меньше или равно 7). Если в процессе электролиза меняется рН раствора у электродов, укажите в какую сторону.
Рассчитайте массу или объем (для газа) веществ, выделившихся на электродах при электролизе. Катодный выход металла по току равен 80%, если на электроде протекает две реакции. Если на катоде выделяется только один металл или один газ, выход по току процесса равен 100%. Анодный выход по току 100% во всех случаях.
Таблица 12
Номер варианта |
Раствор электролита |
Ток, А |
Время, ч |
Количество прошедшего электричества, А·ч |
Материал анода |
1 |
AuCl3 |
|
|
8 |
Au |
2 |
AgNO3 |
5 |
7 |
|
Ag |
3 |
NiSO4 |
3 |
5 |
|
Ni |
4 |
Zn(NO3)2 |
|
|
11 |
Zn |
5 |
Cr(NO3)3 |
3 |
7 |
|
C |
6 |
CuSO4 |
3 |
3 |
|
Cu |
7 |
Bi(NO3)3 |
|
|
0,5 |
Bi |
8 |
Pb(NO3)3 |
3 |
2 |
|
Pb |
9 |
FeCl3 |
5 |
7 |
|
Fe |
10 |
CoSO4 |
|
|
0,8 |
Co |
11 |
Pd(NO3)2 |
4 |
0,5 |
|
Pt |
12 |
NaCl |
3 |
7 |
|
C |
13 |
K2SO4 |
|
|
22 |
Pt |
О к о н ч а н и е т а б л. 12
14 |
AuCl |
3 |
5 |
|
C |
15 |
AgNO3 |
3 |
7 |
|
Pt |
16 |
BaCl2 |
|
|
11 |
C |
17 |
SbCl3 |
7 |
3 |
|
Sb |
18 |
Li2SO4 |
7 |
8 |
|
C |
19 |
MnCl2 |
|
|
43 |
C |
20 |
Al2(SO4)3 |
|
|
23 |
Pt |
21 |
SnCl2 |
3 |
7 |
|
Sn |
22 |
CuCl |
|
|
21 |
C |
23 |
NiSO4 |
|
|
12 |
C |
24 |
Hg(NO3)2 |
5 |
11 |
|
Hg |
25 |
FeSO4 |
|
|
17 |
C |
Коррозия металлов
Задание 4. Даны пара металлов и значения рН водной среды (см. вариант в таблица 13).
Оцените возможность коррозии металла в данной электрохимической системе на основании сравнения рассчитанных равновесных потенциалов электродов: водородного, кислородного и данных металлов (равновесные потенциалы металлических электродов принимаем равными их стандартному значению). Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии.
Предложите для данной пары металлов при заданном значении рН катодное и анодное металлическое покрытие.
Запишите электрохимическую схему элементов, образующихся при нарушении целостности покрытия, уравнения электродных реакций при коррозии для этих элементов.
Предложите протекторную защиту для данной пары металлов. Запишите электрохимическую систему, уравнения электродных реакций при протекторной защите.
Запишите электрохимическую систему электрозащиты (катодной) данной пары металлов, уравнения электродных реакций при работе электрозащиты.
Таблица 13
-
Номер варианта
Металлы
рН
1
Cu-Cr
2
10
2
Cu-Fe
3
11
3
Cu-Ni
1
7
4
Fe-Ni
7
2
5
Fe-Cr
12
3
6
Fe-Cd
4
11
7
Fe-Co
3
10
8
Cu-Ag
7
1
9
Cu-Sn
2
9
10
Cu-Pd
1
10
11
Ni-Cr
2
8
12
Fe-Zn
3
11
13
Fe-Pb
8
2
14
Cu-Pb
3
12
15
Fe-In
4
10
16
Ag-Ni
7
2
17
Ti-Cu
3
10
18
Ti-Ni
12
2
19
Ni-Au
10
1
20
Al-Zn
2
7
21
Al-Cd
5
11
22
Al-Ni
9
2
23
Al-Ag
8
3
24
Mg-Cu
12
2
25
Mg-Ni
3
10
приложения
П р и л о ж е н и е 1
Термодинамические характеристики некоторых веществ
при 298 К
Вещество |
f H, кДж/моль |
S, Дж/(мольК) |
f G, кДж/моль |
ВаО(к) |
–557,9 |
70,29 |
–528,4 |
ВаCl2(к) |
–860,1 |
126 |
–810,9 |
ВеО(к) |
–598,7 |
14,1 |
–581,6 |
ВеCl2(к) |
–494 |
63 |
–468 |
Br2(г) |
30,92 |
245,35 |
3,14 |
Сграфит |
0 |
5,74 |
0 |
Салмаз |
1,83 |
2,38 |
2,85 |
СО(г) |
–110,5 |
197,54 |
–137,14 |
СО2(г) |
–393,51 |
213,68 |
–394,38 |
СF4(г) |
–933 |
261,4 |
–888,37 |
ССl4(г) |
–106,7 |
309,7 |
–63,95 |
СН4(г) |
–74,85 |
186,2 |
–50,8 |
С2Н2(г) |
226,75 |
200,82 |
209,21 |
С2Н4(г) |
52,3 |
219,45 |
68,14 |
С2Н6(г) |
–84,68 |
229,5 |
–32,89 |
С6Н6(г) |
82,93 |
269,2 |
129,68 |
CS2(г) |
110,7 |
237,77 |
66,55 |
СаО(к) |
–635,5 |
39,7 |
–605,2 |
Са(ОН)2(к) |
–986,2 |
83,4 |
–898,5 |
СаСО3(к) |
–1207,1 |
92,88 |
–1128,76 |
Cl2(г) |
0 |
222,96 |
0 |
ClF(г) |
–49,9 |
217,82 |
–51,37 |
CuO(к) |
–165 |
42,64 |
–127 |
Cu2О(к) |
–173,2 |
92,93 |
–150,5 |
F2(г) |
0 |
202,67 |
0 |
П р о д о л ж е н и е п р и л. 1
Вещество |
f H, кДж/моль |
S, Дж/(мольК) |
f G, кДж/моль |
FeO(к) |
–263,8 |
58,8 |
–244,3 |
Fe2O3(к) |
–822,16 |
89,96 |
–740,98 |
Н2(г) |
0 |
130,58 |
0 |
HBr(г) |
–35,98 |
198,5 |
–53,5 |
HCl(г) |
–92,3 |
187 |
–95,27 |
HF(г) |
–268,61 |
173,51 |
–270,7 |
HI(г) |
25,94 |
206,3 |
1,3 |
Н2О(г) |
–241,82 |
188,7 |
–228,61 |
Н2О(ж) |
–285,84 |
70,08 |
–237,2 |
Н2S(г) |
–20,17 |
205,6 |
–33 |
I2(г) |
62,24 |
260,58 |
19,4 |
N2(г) |
0 |
191,5 |
0 |
NH3(г) |
–46,19 |
192,66 |
–16,66 |
NF3(г) |
–131,7 |
260,7 |
–84 |
N2F4(г) |
–22 |
317 |
79 |
N2O(г) |
82,01 |
219,83 |
104,12 |
N2O3(г) |
90,22 |
307,1 |
110,5 |
N2O4(г) |
11,11 |
304,35 |
99,68 |
NO(г) |
90,25 |
210,62 |
86,58 |
NO2(г) |
34,19 |
240,06 |
52,29 |
NOCl(г) |
52,59 |
263,5 |
66,37 |
NOF(г) |
65 |
248 |
–51 |
NOF3(г) |
–187 |
277,6 |
– |
(NO2)F(г) |
–109 |
259,3 |
37 |
NH4F(т) |
–463,59 |
71,96 |
–348,45 |
СО2(г) |
–393,51 |
213,66 |
–394,37 |
СО(NH2)2(т) |
–333,17 |
104,6 |
–197,15 |
CS2(г) |
116,7 |
237,7 |
66,55 |
ССl4(г) |
–106,7 |
309,7 |
–63,95 |
Cl2(г) |
0 |
223 |
0 |
О к о н ч а н и е п р и л. 1
Вещество |
f H, кДж/моль |
S, Дж/(мольК) |
f G, кДж/моль |
О2(г) |
0 |
205,04 |
0 |
О3(г) |
142,26 |
238,82 |
162,76 |
РН3(г) |
5,44 |
210,1 |
13,39 |
Р2О5(к) |
–1492 |
114,5 |
–1348,8 |
PCl3(г) |
–287 |
311,7 |
–268 |
PCl5(г) |
–366,94 |
364,47 |
–297,14 |
PОCl3 (г) |
–558,9 |
323,84 |
–512,92 |
F2(г) |
0 |
202,67 |
0 |
PF3(г) |
–956,5 |
272,6 |
–935,66 |
PОF3(г) |
–1252,27 |
284,93 |
–1203,75 |
S(к) |
0 |
31,88 |
0 |
SO2(г) |
–296,9 |
248,1 |
–300,4 |
SO3(г) |
–395,2 |
256,23 |
–370,4 |
SO2Cl2(г) |
–363,17 |
311,3 |
–318,85 |
Si(т) |
0 |
18,83 |
0 |
SiCl4(г) |
–657,52 |
330,95 |
–617,6 |
SiН4(г) |
34,73 |
204,55 |
57,19 |
SiО2(к) |
–903,5 |
46,86 |
–850,7 |
П р и л о ж е н и е 2
Значения констант диссоциации некоторых кислот и оснований
Кислота |
|||||
Название и Формула |
Кд |
Название и Формула |
Кд |
||
Азотистая HNO2 |
|
5,1310–4 |
Сероводородная H2S |
К1 К2 |
1,0510–7 1,310–13 |
Алюминиевая-мета HAlO2 |
|
610–13 |
Сернистая H2SO3 |
К1 К2 |
1,410–2 6,310–8 |
Борная Н3ВО3 |
К1 К2 К3 |
5,810–10 1,810–13 1,610–14 |
Теллуристая H2TeO3 |
К1 К2 |
2,710–3 1,810–8 |
Бромноватистая HOBr |
|
2,510–9 |
Теллуроводородная H2Te |
К1 К2 |
2,310–3 10–11 |
Ванадиевая H3VO4 |
К2 К3 |
1,110–9 410–15 |
Теллуровая H2TeO4 |
К1 К2 |
2,510–9 4,110–11 |
Водорода пероксид Н2О2 |
К1 |
210–12
|
Угольная Н2СО3 |
К1 К2 |
4,510–7 4,810–11 |
Германиевая–мета H2GeO3 |
К1 К2 |
1,710–9 2,010–13 |
Уксусная CH3COOH |
|
1,810–5 |
Иодноватистая HOI |
|
2,310–11 |
Фосфористая H3PO3 |
К1 К2 |
1,610–2 210–7 |
Кремневая–мета H2SiO3 |
К1 К2 |
2,210–10 1,610–12 |
Фосфорная H3PO4 |
К1 К2 К3 |
7,110–3 6,210–8 4,210–13 |
Марганцовистая H2MnO4 |
К1 К2 |
10–1 7,110–11 |
Фтороводородная HF |
|
6,810–4 |
Мышьяковая H3AsO4 |
К1 К2 К3 |
5,610–3 1,710–7 310–12 |
Хлорноватистая HClO |
|
510–8 |
Муравьиная НСООН |
|
1,810–4 |
Хромовая H2CrO4 |
К1 К2 |
1,110–1 3,210–7 |
Селенистая H2SeO3 |
К1 К2 |
2,410–3 4,810–9 |
Циановодородная (синильная) НCN |
|
6,210–10 |
Селеноводородная H2Se |
К1 К2 |
1,310–4 10–11 |
Щавелевая Н2С2О4 |
К1 К2 |
5,610–2 5,410–5 |
О к о н ч а н и е п р и л. 2
Основание |
|||||
Название и Формула |
Кд |
Название и Формула |
Кд |
||
Алюминия гидроксид Al(OH)3 |
К1 К2 К3 |
7,410–9 2,110–9 1,110–9 |
Марганца(II) гидроксид Mn(OH)2 |
К2 |
3,910–4 |
Аммония гидроксид NH4ОН |
|
1,810–5 |
Меди (II) гидроксид Cu(OH)2 |
К2 |
3,410–7
|
Бария гидроксид Ва(ОН)2 |
К2 |
2,310–1 |
Никеля (II) гидроксид Ni(OH)2 |
К2 |
8,3210–4 |
Железа (II) гидроксид Fe(OH)2 |
К1 К2 |
1,210–2 1,310–4 |
Олова (II) гидроксид Sn(ОН)2 |
К2 |
10–12 |
Железа (III) гидроксид Fe(OH)3 |
К2 К3 |
1,8210–11 1,3510–12 |
Ртути (II) гидроксид Hg(OH)2 |
К1 К2 |
410–12 510–11 |
Кадмия гидроксид Cd(OH)2 |
К1 К2 |
8,110–4 4,210–7 |
Свинца (II) гидроксид Pb(OH)2 |
К1 К2 |
510–4 1,410–8 |
Кобальта (II) гидроксид Со(ОН)2 |
К1 К2 |
7,910–5 8,910–6 |
Хрома (II) гидроксид Cr(OH)2 |
К2 |
410–8 |
Кальция гидроксид Са(ОН)2 |
К2 |
5,810–2 |
Хрома (III) гидроксид Cr(OH)3 |
К3 |
~10–10 |
Магния гидроксид Mg(OH)2 |
К2 |
2,6310–3 |
Цинка гидроксид Zn(OH)2 |
К1 К2 |
1,3210–5 2,010–9 |
П р и л о ж е н и е 3
Произведение растворимости ПР некоторых малорастворимых
электролитов при 298 К
Вещество |
ПР |
Вещество |
ПР |
Вещество |
ПР |
Be(OH)2 |
2,0910–19 |
Zn(OH)2 |
3,6910–17 |
Fe(OH)2 |
410–16 |
Mg(OH)2 |
6,7610–12 |
Sc(OH)3 |
210–30 |
Fe(OH)3 |
2,5110–39 |
Ca(OH)2 |
5,510–5 |
Sn(OH)2 |
6,310–27 |
Nd(OH)3 |
7,7610–24 |
Ba(OH)2 |
510–3 |
Pb(OH)2 |
1,210–20 |
Co(OH)2 |
210–16 |
Sr(OH)2 |
3,210–4 |
Cr(OH)2 |
10–17 |
Ni(OH)2 |
6,3110–18 |
Cd(OH)2 |
2,210–14 |
Mn(OH)2 |
1,5810–13 |
Y(OH)3 |
3,1610–25 |
Cu(OH)2 |
210–20 |
|
|
|
|
П р и л о ж е н и е 4
Температуры кипения Ткип, кристаллизации Тплавл,
криоскопическая Ккр и эбуллиоскопическая Кэб постоянные
некоторых чистых растворителей
Растворитель |
Тплавл, С |
Ткип, С |
Ккр,
|
Кэб,
|
Ацетон |
–95,35 |
56,24 |
2,4 |
1,48 |
Бензол |
5,53 |
80,1 |
5,12 |
2,57 |
Вода |
0 |
100 |
1,86 |
0,52 |
Диэтиловый эфир |
–116 |
34,5 |
1,79 |
2,12 |
Сероуглерод |
–111,6 |
46,2 |
3,8 |
2,29 |
Уксусная кислота |
16,75 |
118,1 |
3,9 |
3,07 |
Циклогексан |
6,6 |
80,75 |
20,2 |
2,75 |
Хлороформ |
–63,5 |
61,2 |
4,9 |
3,61 |
Четыреххлористый углерод |
–22,96 |
76,75 |
29,8 |
5,25 |
Этанол |
–114,5 |
78,3 |
1,99 |
1,22 |
П р и л о ж е н и е 5
Константы нестойкости некоторых комплексных ионов
Формула иона |
Кнест |
Формула иона |
Кнест |
Формула иона |
Кнест |
Аммиакаты |
Цианидные комплексы |
Галогенидные комплексы |
|||
[Zn(NH3)4]2+ |
3,510–10 |
[Cu(CN)4]2– |
510–28 |
[BeF4]2– |
4,1710–17 |
[Cu(NH3)2]+ |
1,410–11 |
[Zn(CN)4]2– |
210–17 |
[AuCl4]– |
510–22 |
[Cd(NH3)4]2+ |
2,510–7 |
[Cd(CN)4]2– |
7,761018– |
[PtCl4]2– |
10–16 |
[Hg(NH3)4]2+ |
5,210–20 |
[Ni(CN)4]2– |
310–16 |
[HgBr4]2– |
10–21 |
Гидроксокомплексы |
Роданидные комплексы |
[PtBr4]2– |
3,1610–21 |
||
[PdBr4]2– |
7,9410–14 |
||||
[In(OH)4]– |
210–29 |
[Ag(SCN)4]3– |
2,1410–10 |
[HgI4]2– |
1,4810–30 |
[Be(OH)4]2– |
10–15 |
[Cu(SCN)4]2– |
310–7 |
[CdI4]2– |
7,9410–7 |
[Cu(OH)4]2- |
3,1610–19 |
Нитритные комплексы |
[AgI4]3– |
7,9410–14 |
|
[Zn(OH)4]2– |
2,210–15 |
|
|
||
[Sb(OH)4]– |
510–39 |
[Hg(NO2)4]2– |
2,8810–14 |
|
|
П р и л о ж е н и е 6
Стандартные электродные потенциалы
электродов Е при 298 К
Электрод |
Электродная реакция |
Е, В |
Металлические электроды |
||
Li+|Li |
Li+ + e ó Li |
–3,045 |
K+|K |
K+ + e ó K |
–2,925 |
Cs+|Cs |
Cs+ + e ó Cs |
–2,92 |
Ba2+|Ba |
Ba2+ + 2e ó Ba |
–2,906 |
Ca2+|Ca |
Ca2+ + 2e ó Ca |
–2,866 |
Na+|Na |
Na+ + e ó Na |
–2,714 |
La3+|La |
La3+ + 3e ó La |
–2,522 |
Mg2+|Mg |
Mg2+ + 2e ó Mg |
–2,363 |
Be2+|Be |
Be2+ + 2e ó Be |
–1,847 |
Al3+|Al |
Al3+ + 3e ó Al |
–1,662 |
Ti2+|Ti |
Ti2+ + 2e ó Ti |
–1,628 |
Ti3+|Ti |
Ti3+ + 3e ó Ti |
–1,21 |
V2+|V |
V2+ +2e ó V |
–1,186 |
Mn2+|Mn |
Mn2+ + 2e ó Mn |
–1,180 |
Cr2+|Cr |
Cr2+ + 2e ó Cr |
–0,913 |
Zn2+|Zn |
Zn2+ + 2e ó Zn |
–0,763 |
Cr3+|Cr |
Cr3+ + 3e ó Cr |
–0,744 |
Ga3+|Ga |
Ga3+ + 3e ó Ga |
–0,529 |
Fe2+|Fe |
Fe2+ + 2e ó Fe |
–0,44 |
Cd2+|Cd |
Cd2+ + 2e ó Cd |
–0,403 |
In3+|In |
In3+ + 3e ó In |
–0,34 |
Tl+|Tl |
Tl+ + e ó Tl |
–0,336 |
Co2+|Co |
Co2 + + 2e ó Co |
–0,277 |
Ni2+|Ni |
Ni2+ + 2e ó Ni |
–0,25 |
Mo3+|Mo |
Mo3+ +3e ó Mo |
–0,2 |
П р о д о л ж е н и е п р и л. 5
Электрод |
Электродная реакция |
Е0, В |
Sn2+|Sn |
Sn2+ + 2e ó Sn |
–0,136 |
Pb2+|Pb |
Pb2+ + 2e ó Pb |
–0,126 |
W3+|W |
W3+ + 3e ó W |
–0,05 |
Fe3+|Fe |
Fe3+ + 3e ó Fe |
–0,036 |
Sn4+|Sn |
Sn4+ + 4e ó Sn |
+0,007 |
Ge2+|Ge |
Ge2+ + 2e ó Ge |
+0,01 |
Sb3+|Sb |
Sb3+ + 3e ó Sb |
+0,2 |
Bi3+|Bi |
Bi3+ + 3e ó Bi |
+0,215 |
Cu2+|Cu |
Cu2+ + 2e ó Cu |
+0,337 |
Cu+|Cu |
Cu+ + e ó Cu |
+0,521 |
Ag+|Ag |
Ag+ + e ó Ag |
+0,8 |
Os2+|Os |
Os2+ + 2e ó Os |
+0,85 |
Hg2+|Hg |
Hg2+ + 2e ó Hg |
+0,854 |
Pd2+|Pd |
Pd2+ + 2e ó Pd |
+0,987 |
Pt2+|Pt |
Pt2+ + 2e ó Pt |
+1,200 |
Au3+|Au |
Au3+ + 3 e ó Au |
+1,498 |
Au+|Au |
Au+ + e ó Au |
+1,691 |
Газовые электроды |
||
Pt|H2|H+ |
2H+ + 2e ó H2 |
0,00 |
Pt|H2|OH–, H2O |
2H2O + 2e ó H2 + 2 OH– |
–0,828 |
Pt|Cl2|Cl– |
Cl2 + 2e ó 2Cl– |
+1,36 |
Pt|F2|F– |
F2 + 2e ó 2F– |
+2,87 |
Pt|O2|OH–, H2O |
O2 + 2H2O + 4e ó 4OH– |
+0,401 |
Pt|O2|H+, H2O |
O2 + 4H+ + 4e ó 2H2O |
+1,229 |
Электроды второго рода |
||
Ag | AgCl, Cl– |
AgCl + e ó Ag + Cl– |
+0,222 |
Hg | Hg2Cl2, Cl– |
Hg2Cl2 + 2e ó 2Hg + 2Cl– |
+0,268 |
Литература
Коровин Н. В. Общая химия: учебник для вузов по техническим направлениям и специальностям / Н. В. Коровин.- Изд. 10-е, доп.- М.: Высшая школа, 2008.
Химия: [учебник для вузов по техническим направлениям и специальностям] / А. А. Гуров [и др.].- Изд. 3-е, испр.- М.: Изд-во МГТУ им. Н. Э. Баумана, 2007.
Н. Л. Глинка. Химия. / Под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005.
Глинка Н. Л. Задачи и упражнения по общей химии: [учебное пособие для нехимических специальностей вузов]/ Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной.- Изд. стер.- М.: Интеграл-Пресс, 2008.
Задачи и упражнения по общей химии / Учеб. пособие под редакцией Н.В. Коровина. – М.: Высшая школа, 2004.
Зайцев О.С. Химия. Современный краткий курс. – М.: Изд-во НЦ ЭНАС, 2001.
Суворов А.В., Никольский А.Б. Вопросы и упражнения по общей химии. – СПб: Химиздат, 2002.
Растворимость веществ в воде
Ионы |
Li+ |
Na+ |
K+ |
Be2+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Zn2+ |
Cd2+ |
Hg2+ |
|
Al3+ |
In3+ |
Sn2+ |
Pb2+ |
Sb3+ |
Bi3+ |
Cr3+ |
Mn2+ |
Fe2+ |
Fe3+ |
Co2+ |
Ni2+ |
Cu2+ |
Ag+ |
Au3+ |
OH– |
Р |
Р |
Р |
Н |
Н |
М |
М |
Р |
Н |
Н |
- - |
- - |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
F– |
М |
Р |
Р |
Р |
М |
Н |
Н |
М |
М |
Р |
Г |
М |
М |
М |
Р |
М |
Р |
Н |
Р |
Р |
Н |
Н |
Н |
Р |
Р |
Р |
Г |
Cl– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
И |
Р |
Р |
Р |
|
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Br– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Н |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
М |
|
Р |
Р |
Р |
|
Р |
Р |
Р |
М |
Р |
Р |
М |
|
Р |
|
Р |
Р |
|
|
|
|
|
|
Р |
Р |
Р |
М |
|
I– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
М |
М |
Р |
Н |
Р |
Р |
Р |
Д |
Р |
Р |
Д |
Н |
Д |
|
Р |
Р |
Р |
|
Р |
Н |
Н |
М |
М |
Р |
|
|
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S2– |
Р |
Р |
Р |
Г |
М |
М |
Р |
Р |
Н |
Н |
Н |
- - |
Г |
Н |
Н |
Н |
Н |
Н |
Г |
Н |
Н |
Д |
Н |
Н |
Н |
Н |
Н |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
|
|
Р |
Р |
Р |
М |
М |
Н |
Н |
М |
М |
М |
Н |
Н |
Г |
|
Г |
Н |
|
Н |
Г |
Н |
М |
Д |
Н |
Н |
Н |
|
Р |
|
Р |
Р |
Р |
Р |
Р |
М |
М |
Н |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
|
Р |
Р |
Р |
Г |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Г |
|
Г |
Р |
Г |
Г |
Г |
Р |
Р |
Г |
Р |
Р |
Р |
М |
Г |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
М |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
Н |
Н |
М |
|
М |
Р |
Р |
М |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Г |
Г |
Г |
Н |
Г |
Н |
Г |
Н |
Н |
Г |
Н |
Н |
Н |
Н |
Г |
|
Р |
Р |
Р |
- - |
Р |
Р |
Р |
Р |
Р |
Р |
- - |
|
- - |
- - |
- - |
Р |
- - |
- - |
- - |
Р |
Р |
- - |
Р |
Р |
|
|
- - |
Ионы |
Li+ |
Na+ |
K+ |
Be2+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Zn2+ |
Cd2+ |
Hg2+ |
|
Al3+ |
In3+ |
Sn2+ |
Pb2+ |
Sb3+ |
Bi3+ |
Cr3+ |
Mn2+ |
Fe2+ |
Fe3+ |
Co2+ |
Ni2+ |
Cu2+ |
Ag+ |
Au3+ |
|
М |
Р |
Р |
Н |
М |
М |
Р |
Н |
Н |
Р |
|
|
Н |
Н |
Н |
Н |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Р |
М |
- - |
|
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
Н |
Н |
Г |
Н |
Г |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
|
Р |
Р |
Р |
|
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
Н |
Н |
Г |
Н |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
|
Н |
Р |
Р |
Н |
Н |
М |
М |
М |
Н |
Н |
М |
Н |
Н |
Н |
Н |
М |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
|
Р |
Р |
Р |
Р |
М |
|
М |
М |
Р |
Р |
|
|
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
Р |
Р |
Р |
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
|
|
Р |
Р |
Р |
|
Р |
Р |
Р |
Н |
М |
М |
М |
М |
|
|
|
Н |
|
Н |
|
Н |
|
|
Н |
Н |
М |
Н |
Г |
|
Р |
Р |
Р |
|
М |
Н |
Н |
М |
Н |
Н |
М |
Н |
Н |
Н |
Н |
Н |
|
Н |
М |
М |
М |
Н |
Н |
Н |
Н |
Н |
Н |
HCOO– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
СН3СОО– |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
М |
Р |
|
Р |
Г |
Г |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Г |
CN– |
Р |
Р |
Р |
Г |
Г |
Р |
Р |
М |
Н |
Н |
Р |
-- |
Г |
Н |
Г |
М |
Г |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
SCN– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Н |
Р |
Р |
Р |
Н |
Р |
Г |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
[Fe(CN)6]3– |
Р |
Р |
Р |
|
М |
Р |
Р |
Р |
Н |
|
Н |
Г |
Г |
|
Н |
М |
|
Н |
Г |
Н |
Н |
|
Н |
Н |
Н |
Н |
|
[Fe(CN)6]4– |
Р |
Р |
Р |
|
Р |
Р |
Р |
М |
Н |
Н |
Д |
Г |
Г |
|
Н |
Н |
|
Н |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
Р – вещество растворимо в воде (> 1 г/100 г раствора), М – вещество мало растворимом в воде (0,01–1 г/100 г раствора), Н – вещество не растворимо в воде (< 0,01 г/100 г раствора), Г – вещество необратимо гидролизуется, Д – вещество диспропорционирует при контакте с водой, -- – вещество не существует.
