
№ 4158
54
Х 465
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
ХИМИЯ
Сборник индивидуальных домашних заданий
для студентов технических направлений
дневной формы обучения
НОВОСИБИРСК 2012
УДК
Составители: А.И. Апарнев, к.х.н., доцент
В.К. Варенцов, д.т.н., профессор
Г.К. Лупенко, к.х.н., доцент
Р.Е. Синчурина, ассистент
Рецензенты: Т.П. Александрова, к.х.н., доцент
Работа подготовлена на кафедре химии
Новосибирский государственный
Оглавление
Тема 1. Химический эквивалент. Закон эквивалентов. Окислительно-восстановительные реакции 5
Тема 2. Строение вещества 7
Тема 3. Основные закономерности протекания химических процессов 8
Тема 4. Кинетика химических процессов и химическое равновесие 9
Тема 5. Растворы электролитов 12
Тема 6. Коллоидные растворы 16
Тема 7. Общие свойства растворов 19
Тема 8. Комплексные соединения 21
Тема 9. Электрохимические процессы 23
Приложения 30
Литература 40
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам Коровин Н. В. Общая химия: учебник для вузов / В. Н. Коровин. – М.: Высшая школа, 2008; Глинка Н. Л. Общая химия: [учебное пособие для вузов] / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради (или на отдельных листах) и сдаются преподавателю в сроки, указанные в учебном плане.
Т е м а 1
Химический эквивалент.
Закон эквивалентов.
Окислительно-восстановительные реакции
Задание 1. Даны массы двухвалентного металла (mМе), его оксида (mо) и сульфида (mс) (см. ваш вариант в табл. 1).
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. Установите и запишите химические формулы веществ.
Задание
2. Даны масса
двухвалентного металла (mМе)
и объем кислорода (![]() ),
затраченного на его окисление при н.у.
(см. ваш вариант в табл. 1).
),
затраченного на его окисление при н.у.
(см. ваш вариант в табл. 1).
Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл.
Т а б л и ц а 1
|
Номер варианта |
Задание 1 |
Задание 2 |
Номер варианта |
Задание 1 |
Задание 2 | ||||||
|
mМе, г |
mо, г |
mс, г |
mМе, г |
л |
mМе, г |
mо, г |
mс, г |
mМе, г |
л | ||
|
1 |
3,01 |
3,56 |
4,11 |
17,9 |
1,46 |
14 |
3,74 |
4,99 |
6,24 |
7,42 |
1,41 |
|
2 |
3,22 |
4,01 |
4,80 |
9,4 |
1,61 |
15 |
3,66 |
6,07 |
8,48 |
5,05 |
0,89 |
|
3 |
2,58 |
3,23 |
3,88 |
6,6 |
3,04 |
16 |
2,98 |
4,17 |
5,36 |
5,44 |
1,52 |
|
4 |
3,07 |
3,95 |
4,83 |
7,9 |
1,01 |
17 |
3,22 |
3,93 |
4,64 |
16,56 |
1,65 |
|
5 |
4,07 |
5,18 |
6,29 |
9,8 |
1,87 |
18 |
3,99 |
4,59 |
5,19 |
4,4 |
5,47 |
|
6 |
3,88 |
5,01 |
6,14 |
11,4 |
2,01 |
19 |
3,65 |
4,29 |
4,93 |
3,3 |
1,52 |
|
7 |
2,98 |
3,21 |
3,44 |
6,6 |
3,04 |
20 |
3,72 |
4,25 |
4,78 |
10,36 |
0,56 |
|
8 |
3,34 |
3,79 |
4,24 |
5,8 |
1,62 |
21 |
3,94 |
4,66 |
5,38 |
4,98 |
0,95 |
|
9 |
2,74 |
3,13 |
3,52 |
11,4 |
0,93 |
22 |
2,86 |
3,56 |
4,26 |
21,85 |
1,22 |
|
10 |
2,51 |
2,71 |
2,91 |
4,9 |
0,84 |
23 |
4,41 |
5,52 |
6,63 |
10,64 |
1,12 |
|
11 |
3,17 |
3,43 |
3,69 |
10,84 |
1,08 |
24 |
2,27 |
2,92 |
3,57 |
8,18 |
3,77 |
|
12 |
3,35 |
3,74 |
4,13 |
15,8 |
2,02 |
25 |
2,31 |
2,94 |
3,57 |
15,88 |
2,03 |
|
13 |
4,59 |
5,28 |
5,97 |
9,15 |
1,47 |
26 |
2,14 |
2,66 |
3,19 |
7,3 |
2,04 |
Задание 3. Дана схема реакции (см. в табл. 2):
определите степень окисления атомов элементов, меняющих ее в процессе реакции;
составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;
запишите множители в уравнение окислительно - восстановительной реакции как основные стехиометрические коэффициенты;
подберите стехиометрические коэффициенты остальных участников реакции;
выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Т а б л и ц а 2
|
Номер варианта |
Схема реакции |
|
1 |
KI + KIO3 + H2SO4 I2 + K2SO4 + H2O |
|
2 |
SnCl2 + K2Cr2O7 + HCl SnCl4 + CrCl3 + KCl + H2O |
|
3 |
CuS + HNO3 Cu(NO3)2 + NO2 + H2SO4 + H2O |
|
4 |
KMnO4 + HCl MnCl2 + Cl2 + KCl + H2O |
|
5 |
HNO2 + KMnO4 + H2SO4 HNO3 + MnSO4 + K2SO4 + H2O |
|
6 |
K2Cr2O7 + HBr CrBr3 + Br2 + KBr + H2O |
|
7 |
H2S + Cl2 + H2O H2SO4 + HCl |
|
8 |
I2 + HNO3 HIO5 + NO + H2O |
|
9 |
HNO3 + Zn Zn(NO3)2 + N2O + H2O |
|
10 |
FeS + HNO3 Fe(NO3)2 + S + NO + H2O |
|
11 |
Cr2O3 + KClO3 + KOH K2CrO4 + KCl + H2O |
|
12 |
K2Cr2O7 + KI + H2SO4 Cr2(SO4)3 + I2 + K2SO4 + H2O |
|
13 |
FeCl2 + HNO3 + HCl FeCl3 + NO + H2O |
|
14 |
H2SO3 + HNO3 H2SO4 + NO + H2O |
|
15 |
K2Cr2O7 + SO2 + HCl CrCl3 + KCl + H2SO4 + H2O |
|
16 |
Cl2 + Br2 + KOH KCl + KBrO3 + H2O |
|
17 |
K2Cr2O7 + H2O2 + H2SO4 O2 + Cr2(SO4)3 + H2O + K2SO4 |
|
18 |
NaIO3 + CO + H2SO4 I2 + CO2 + Na2SO4 + H2O |
|
19 |
H2S + HClO3 H2SO4 + HCl |
О к о н ч а н и е т а б л. 2
|
20 |
KCl + KMnO4 + H2SO4 Cl2 + MnSO4 + K2SO4 + H2O |
|
21 |
FeSO4 + KClO3 + H2SO4 Fe2(SO4)3 + KCl + H2O |
|
22 |
Cr2(SO4)3 + Br2 + NaOHNa2CrO4 + NaBr + Na2SO4 + H2O |
|
23 |
MnSO4 + KMnO4 + H2O MnO2 + H2SO4 + K2SO4 |
|
24 |
Sn + HNO3 Sn(NO3)2 + N2 + H2O |
|
25 |
Ca + HNO3 Ca(NO3)2 + NH4NO3 + H2O |
Т е м а 2.
Строение вещества
Задание. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 3):
напишите электронные формулы, подчеркните валентные электроны и определите семейство;
укажите значения квантовых чисел для валентных электронов;
распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
Т а б л и ц а 3
-
Номер
варианта
Формула
вещества
Номер
варианта
Формула
вещества
Номер
варианта
Формула
вещества
1
CF4
10
AlCl3
19
BrF3
2
CCl4
11
GaCl3
20
BeCl2
3
NF3
12
SBr6
21
CS2
4
SiCl4
13
SiBr4
22
SnCl2
5
PI3
14
SbBr3
23
ScBr3
6
AsCl3
15
HgCl2
24
AsF5
7
PCl3
16
PCl5
25
CdF2
8
SeF4
17
SF6
26
SCl6
9
PbCl2
18
InI3
27
BF3
определите степени окисления элементов в молекуле;
составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
охарактеризуйте химические свойства элементов, заполнив таблицу:
|
Элемент |
Формула оксида |
Формула гидроксида |
Формула водородного соединения |
|
|
|
|
|
|
|
|
|
|
|
Химический характер |
|
|
|
Т е м а 3
Основные закономерности протекания
химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 4).
Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин
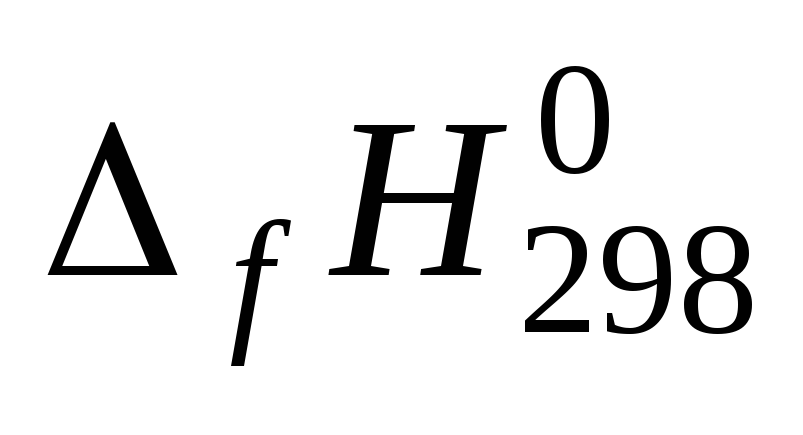 и
и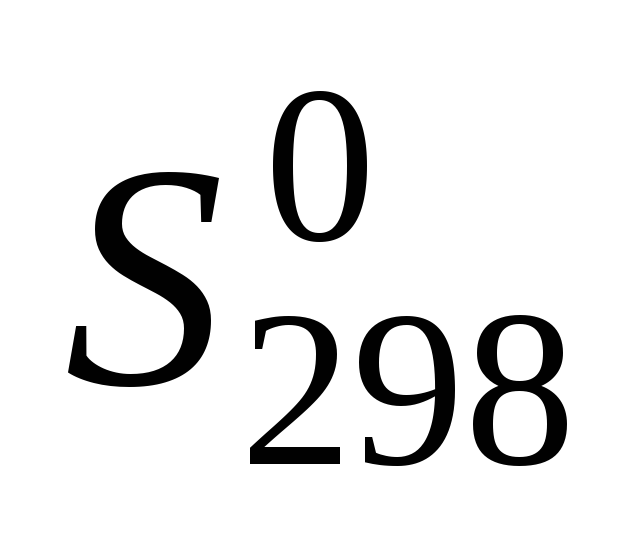 .
.Вычислите изменение энтальпии реакции
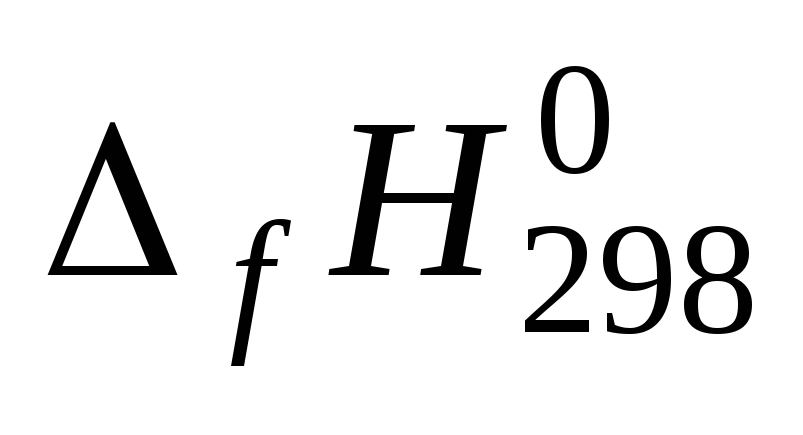 и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции.
и
определите, является ли данная реакция
экзо- или эндотермической. Запишите
термохимическое уравнение реакции.По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции
 .
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак
.
Вычислив изменение энтропии реакции
в стандартных условиях, объясните знак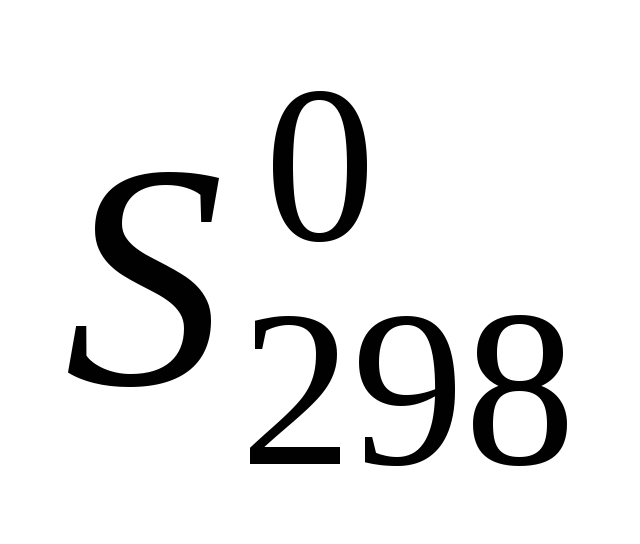 .
.Вычислите энергию Гиббса прямой реакции в стандартных условиях
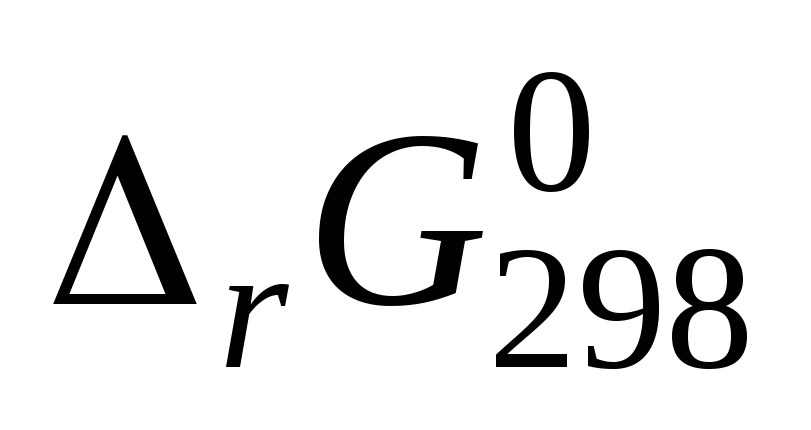 и установите возможность самопроизвольного
протекания реакции.
и установите возможность самопроизвольного
протекания реакции.Определите температуру, при которой реакция находится в равновесии (Тр).
Рассчитайте
 приТ1
= Тр–100,
Т2
= Тр+100.
приТ1
= Тр–100,
Т2
= Тр+100.Постройте график зависимости
 от
Т и обозначьте на графике область
температур самопроизвольного протекания
реакции.
от
Т и обозначьте на графике область
температур самопроизвольного протекания
реакции.Вычислите значения константы равновесия Кc при температурах Тр, Т1 и Т2. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Т е м а 4
Кинетика химических процессов
и химическое равновесие
Задание 1. Дано уравнение реакции (см. вариант в табл. 4).
Запишите кинетические уравнения скоростей прямой
 и обратной
и обратной реакций.
Гомо- или гетерогенной является данная
реакция?
реакций.
Гомо- или гетерогенной является данная
реакция?Рассчитайте скорость прямой реакции
 в начальный момент времени (приСо).
Как изменится скорость прямой реакции
к моменту времени
в начальный момент времени (приСо).
Как изменится скорость прямой реакции
к моменту времени
 ,
когда прореагирует 20 % вещества В?
,
когда прореагирует 20 % вещества В?Рассчитайте увеличение скорости прямой реакции
 при
одновременном повышении давления в
системе в 2 раза и температуры
при
одновременном повышении давления в
системе в 2 раза и температуры на
20С
при
= 2.
на
20С
при
= 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
Запишите выражение для константы равновесия химической реакции через концентрации Кс.
Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V и Т).
Т а б л и ц а 4
|
Номер варианта |
Задание 1, 2 |
Изменение внешних условий | |||||
|
аА + bВ cC + dD |
Cо(А), моль/л |
Cо(В), моль/л |
Сисх |
Р |
V |
Т | |
|
1 |
CН4(г) + Н2О(г) = CO(г) + 3 Н2(г) |
1 |
2 |
↑ |
↓ |
↓ |
↓ |
|
2 |
СS2(г) + 4 Н2(г) = CH4(г) + 2 Н2S(г) |
0,2 |
0,8 |
↑ |
↑ |
↑ |
↓ |
|
3 |
CO2(г) + 2 H2(г) = C(т) + 2 Н2О(г) |
0,8 |
1,5 |
↓ |
↓ |
↑ |
↑ |
|
4 |
2 NF3(г) + O2(г) = 2 NOF3(г) |
2 |
2 |
↑ |
↑ |
↓ |
↓ |
|
5 |
СО2(г) + 4 Н2 = СН4(г) + 2 Н2О(г) |
0,5 |
2 |
↑ |
↑ |
↓ |
↓ |
|
6 |
2 PCl5(г) + О2 = 2 POCl3(г) + 2 Сl2(г) |
0,3 |
1,5 |
↓ |
↓ |
↑ |
↑ |
|
7 |
2 AsCl3(г) + 3 H2(г) = 2 As(г) + 6 НCl(г) |
0,2 |
0,6 |
↑ |
↑ |
↓ |
↓ |
|
8 |
2 СН3ОН(г) + 3 О2 = 2 СО2(г) + 4 Н2О(г) |
3 |
3 |
↓ |
↓ |
↑ |
↑ |
|
9 |
2 NO2(г) + F2(г) = 2 (NO2)F(г) |
3 |
2 |
↓ |
↓ |
↑ |
↑ |
|
10 |
О2(г) + 2 Н2S(г) = 2 S(т) + 2 Н2О(г) |
2 |
3 |
↑ |
↑ |
↓ |
↓ |
|
11 |
2 PF3(г) + О2(г) = 2 POF3(г) |
2 |
3 |
↓ |
↓ |
↑ |
↑ |
|
12 |
S2(г) + 4 CO2(г) = 2 SO2(г) + 4 CO(г) |
1 |
2 |
↑ |
↑ |
↓ |
↓ |
О к о н ч а н и е т а б л. 4
|
Номер варианта |
Задание 1, 2 |
Изменение внешних условий | |||||
|
аА + bВ cC + dD |
Cо(А), моль/л |
Cо(В), моль/л |
Сисх |
Р |
V |
Т | |
|
13 |
2 NO(г) + 2 SO2(г) = N2(г) + 2 SO3(г) |
0,2 |
0,4 |
↑ |
↑ |
↑ |
↑ |
|
14 |
2 CO(г) + 2 H2 = CH4(г) + CО2(г) |
3 |
1 |
↓ |
↓ |
↑ |
↑ |
|
15 |
2 H2S(г) + SO2(г) = 3 S(т) + 2 H2O(г) |
2 |
1 |
↓ |
↓ |
↓ |
↓ |
|
16 |
2 PCl3(г) + O2(г) = 2 PCl3O(г) |
3 |
1 |
↑ |
↑ |
↑ |
↑ |
|
17 |
SiCl4(г) + 2 Н2(г) = Si(т) + 4 HCl(г) |
2 |
3 |
↓ |
↓ |
↓ |
↓ |
|
18 |
2 NO(г) + Cl2(г) = 2 NOCl(г) |
3 |
2 |
↑ |
↑ |
↑ |
↓ |
|
19 |
SО2(г) + 2 Н2S(г) = 3 S(т) + 2 H2O(ж) |
2 |
4 |
↓ |
↑ |
↑ |
↓ |
|
20 |
CCl4(г) + 2 Н2(г) CН4(г) + 2 Cl2(г) |
1 |
3 |
↑ |
↓ |
↑ |
↑ |
|
21 |
2 H2О (г) + 2 Cl2(г) = 4 НCl (г) + O2(г) |
3 |
2 |
↑ |
↓ |
↓ |
↑ |
|
22 |
2 BCl3(г) + 3 Н2(г) = 2 В(т) + 6 HCl(г) |
3 |
3 |
↓ |
↑ |
↓ |
↑ |
|
23 |
CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т) |
1 |
1 |
↑ |
↓ |
↑ |
↑ |
|
24 |
2 H2S(г) + 3 О2 = 2 Н2О(г) + 2 SO2(г) |
0,3 |
0,9 |
↑ |
↑ |
↓ |
↑ |
|
25 |
2 NO(г) + 2 H2(г) = N2(г) + 2 H2O(г) |
3 |
2 |
↓ |
↑ |
↑ |
↓ |
Т е м а 5
Растворы электролитов
Задание 1. Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5).
Определите молярную концентрацию вещества (С), молярную концентрацию эквивалентов вещества (Сэк), массовую долю растворенного вещества (ω, %) в растворе и титр раствора (Т).
Таблица 5
-
Номер
варианта
Вещество
ρ,
г/мл
Концентрация
Сэк, моль/л
ω, %
С, моль/л
1
AlCl3
1,016
2
2
AgNO3
1,194
1,4
3
CaСl2
1,032
4
4
Cu(NO3)2
1,036
0,22
5
Fe2(SO4)3
1,181
20
6
MnCl2
1,068
8
7
Zn(NO3)2
1,067
0,9
8
NiSO4
1,21
2,8
9
ZnSO4
1,084
1,3
10
H2SO4
1,038
6
11
(NH4)2SO4
1,115
20
12
Al2(SO4)3
1,105
1,3
13
Na2CO3
1,05
5
14
K2SO4
1,056
7
15
H3PO4
1,150
3,0
16
Co(NO3)2
1,015
0,11
17
Mg(NO3)2
1,044
6
18
Na2SO4
1,053
6
19
Ba(NO3)2
1,015
0,5
Окончание табл. 5
-
Номер
варианта
Вещество
ρ,
г/мл
Концентрация
Сэк, моль/л
ω, %
С, моль/л
20
FeCl3
1,032
4
21
MnSO4
1,059
6
22
Na2CO3
1,013
2
23
ZnCl2
1,035
0,6
24
MgSO4
1,27
2,54
25
CoSO4
1,08
8
Задание 2. Сколько миллилитров раствора А с заданной массовой долей (%) и плотностью (г/мл) потребуется для нейтрализации раствора В, содержащего определенную массу т растворенного вещества (см. табл. 6)
Т а б л и ц а 6
|
Номер варианта |
Раствор А |
Раствор В | |||
|
Формула вещества |
, % |
, г/мл |
Формула вещества |
m, г | |
|
1 |
H2SO4 |
4 |
1,025 |
КОН |
1,4 |
|
2 |
HCl |
1,36 |
1,005 |
Ва(ОН)2 |
1,71 |
|
3 |
HNO3 |
4 |
1,02 |
Са(ОН)2 |
0,74 |
|
4 |
Н3РО4 |
6 |
1,031 |
КОН |
0,7 |
|
5 |
HCl |
2 |
1,008 |
Sr(OH)2 |
0,61 |
|
6 |
КОН |
1,3 |
1,01 |
H2SO4 |
0,49 |
|
7 |
H2SO4 |
5,5 |
1,034 |
NaOH |
0,4 |
|
8 |
NaOH |
4,2 |
1,045 |
H2SO4 |
0,98 |
|
9 |
КОН |
8,9 |
1,079 |
H2SO4 |
0,98 |
|
10 |
Н3РО4 |
6 |
1,031 |
NaОН |
0,8 |
|
11 |
КОН |
7,8 |
1,068 |
Н3РО4 |
0,33 |
Окончание табл. 6
|
Номер варианта |
Раствор А |
Раствор В | |||
|
Формула вещества |
, % |
, г/мл |
Формула вещества |
m, г | |
|
12 |
NaOH |
6 |
1,065 |
Н3РО4 |
0,98 |
|
13 |
NH4OH |
10,4 |
0,956 |
H2SO4 |
1,47 |
|
14 |
NaOH |
11 |
1,12 |
H2SO4 |
2,94 |
|
15 |
Н3РО4 |
6 |
1,031 |
NH4ОН |
0,7 |
|
16 |
H2SO4 |
2,5 |
1,016 |
NaОН |
0,4 |
|
17 |
Н3РО4 |
2,15 |
1,01 |
NaОН |
0,2 |
|
18 |
HNO3 |
4 |
1,02 |
Ba(OH)2 |
5,13 |
|
19 |
Н3РО4 |
4 |
1,02 |
LiОН |
4,8 |
|
20 |
Н2SО4 |
2,5 |
1,016 |
Ca(ОН)2 |
0,37 |
|
21 |
HCl |
4,4 |
1,02 |
Sr(OH)2 |
0,61 |
|
22 |
H2SO4 |
4 |
1,025 |
Ba(OH)2 |
0,71 |
|
23 |
Н3РО4 |
4 |
1,02 |
Ca(ОH)2 |
1,11 |
|
24 |
H2SO4 |
5,5 |
1,034 |
LiOH |
0,24 |
|
25 |
Н3РО4 |
4 |
1,02 |
KОН |
1,68 |
Задание 3. Имеется раствор слабого электролита (см. вариант в табл. 7).
Запишите уравнения диссоциации и выражения для констант диссоциации (Кд) по всем возможным ступеням, укажите их величины (см. приложение 2).
Рассчитайте степень диссоциации слабого электролита, концентрацию ионов H+ в растворе и рН данного раствора с заданной концентрацией электролита.
Задание 4. Имеется насыщенный раствор труднорастворимого электролита (см. вариант в табл. 7). Вычислите растворимость данного электролита (в моль/л и г/л) в одном литре воды, используя значение произведения растворимости (см. приложение 3).
Задание 5. Имеется раствор соли (см. вариант в табл. 7).
Напишите молекулярное и ионно-молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по I ступени (КгI).
Рассчитайте степень гидролиза (г) и рН раствора соли с заданной концентрацией, учитывая только 1-ую ступень гидролиза.
Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли?
Как изменяться рН раствора соли и окраска индикатора при нагревании и почему?
Таблица 7
|
Номер варианта |
Задание 3 |
Задание 4 |
Задание 5 | ||
|
Вещество |
С, моль/л |
Вещество |
Вещество |
С, моль/л | |
|
1 |
HCN |
0,01 |
Mg(OH)2 |
CdSO4 |
0,02 |
|
2 |
НNO2 |
0,05 |
Fe(OH)2 |
Al(NO3)3 |
0,02 |
|
3 |
HOCl |
0,01 |
Be(OH)2 |
K2Se |
0,03 |
|
4 |
H2GeO3 |
0,02 |
Bi(OH)3 |
Ba(NO2)2 |
0,04 |
|
5 |
HF |
0,1 |
Ga(OH)3 |
CoCl2 |
0,05 |
|
6 |
HOBr |
0,05 |
Cd(OH)2 |
K2TeO4 |
0,02 |
|
7 |
HOI |
0,1 |
Co(OH)2 |
Na3BO3 |
0,01 |
|
8 |
Н2ТеО3 |
0,5 |
Cr(OH)2 |
Na2C2O4 |
0,02 |
|
9 |
H2С2O4 |
0,05 |
Cu(OH)2 |
FeCl2 |
0,05 |
|
10 |
H2SeO3 |
0,02 |
Ni(OH)2 |
FeBr3 |
0,01 |
|
11 |
Н2ТеО3 |
0,01 |
Pb(OH)2 |
NiSO4 |
0,05 |
|
12 |
HOCl |
0,05 |
Sc(OH)3 |
Na2Te |
0,01 |
|
13 |
H3BO3 |
0,01 |
Mn(OH)2 |
K2SiO3 |
0,01 |
|
14 |
H2S |
0,05 |
Pd(OH)2 |
MnSO4 |
0,02 |
|
15 |
H2Se |
0,02 |
La(OH)3 |
Na3AsO4 |
0,05 |
|
16 |
H2SO3 |
0,01 |
Sn(OH)2 |
K2GeO3 |
0,01 |
|
17 |
НNO2 |
0,02 |
Fe(OH)2 |
Cr(NO3)3 |
0,02 |
|
Номер варианта |
Задание 3 |
Задание 4 |
Задание 5 | ||
|
Вещество |
С, моль/л |
Вещество |
Вещество |
С, моль/л | |
|
18 |
H2TeO4 |
0,01 |
Mg(OH)2 |
ZnBr2 |
0,05 |
|
19 |
HCN |
0,02 |
Be(OH)2 |
SnCl2 |
0,02 |
|
20 |
НNO2 |
0,1 |
Bi(OH)3 |
Na3PO3 |
0,01 |
|
21 |
H2SiO3 |
0,05 |
Ga(OH)3 |
K2TeO3 |
0,01 |
|
22 |
H2S |
0,02 |
Sc(OH)3 |
Na2SeO3 |
0,05 |
|
23 |
H2Se |
0,05 |
Zn(OH)2 |
CrCl2 |
0,02 |
|
24 |
H3AsO4 |
0,02 |
Al(OH)3 |
Pb(NO3)2 |
0,05 |
|
25 |
HCOOH |
0,01 |
Со(OH)3 |
Са3(VO4)2 |
0,01 |
Т е м а 6
Коллоидные растворы
Задание. Даны растворы двух реагентов (см. вариант в табл. 8).
Напишите молекулярное уравнение химической реакции образования коллоидной частицы при смешивании двух растворов.
Определите, какой реагент взят в избытке.
Составьте формулу мицеллы, обозначьте и назовите ее составные части.
Определите заряд коллоидной частицы и укажите, к какому электроду будут перемещаться частицы золя в постоянном электрическом поле.
Какой из указанных электролитов будет обладать наилучшим коагулирующим действием. Объясните, почему?
Т а б л и ц а 8
|
Номер варианта |
Раствор I |
Раствор II |
Электролиты, вызывающие коагуляцию | ||||
|
Вещество |
С, моль/л |
V, мл |
Вещество |
С, моль/л |
V, мл | ||
|
1 |
Sr(NO3)2 |
0,05 |
20 |
Na2SO4 |
0,01 |
20 |
KCl, ZnSO4, Na3PO4 |
|
2 |
Pb(NO3)2 |
0,1 |
100 |
KCl |
0,1 |
200 |
K3PO4, CaCl2, Al2(SO4)3 |
|
3 |
FeCl2 |
0,001 |
50 |
Na2S |
0,002 |
50 |
Na3PO4, Ca(NO3)2, Fe2(SO4)3 |
|
4 |
BaCl2 |
0,01 |
100 |
K3PO4 |
0,02 |
100 |
Na3PO4, Ca(NO3)2, Fe2(SO4)3 |
|
5 |
Na2CO3 |
0,5 |
50 |
Ni(NO3)2 |
0,1 |
50 |
K3PO4, CaCl2, Al2(SO4)3 |
|
6 |
CdCl2 |
0,02 |
50 |
KOH |
0,01 |
50 |
K3PO4, CaCl2, Fe2(SO4)3 |
|
7 |
Ni(NO3)2 |
0,02 |
100 |
K2S |
0,02 |
50 |
AlCl3, FeSO4, K3PO4 |
|
8 |
Mg(NO3)2 |
0,5 |
20 |
NaF |
0,1 |
20 |
FeCl3, ZnSO4, Na3PO4 |
|
9 |
AlCl3 |
0,01 |
50 |
K3PO4 |
0,05 |
50 |
ZnCl2, K3PO4, Fe2(SO4)3 |
|
10 |
Ca(NO3)2 |
0,2 |
25 |
K2CO3 |
0,1 |
25 |
AlCl3, CuSO4, K3PO4 |
|
11 |
SnCl2 |
0,05 |
50 |
KOH |
0,01 |
5 |
K3PO4, CaCl2, Al2(SO4)3 |
|
12 |
ZnSO4 |
0,001 |
100 |
K2SiO3 |
0,01 |
100 |
Bi(NO3)3 , CuSO4, K3PO4 |
|
13 |
Bi(NO3)3 |
0,02 |
20 |
K2S |
0,002 |
20 |
Na3PO4, ZnCl2, Al2(SO4)3 |
|
14 |
MnCl2 |
0,05 |
50 |
NaOH |
0,05 |
5 |
K3PO4, CaCl2, Al2(SO4)3 |
|
15 |
(NH4)2SO4 |
0,05 |
20 |
AgNO3 |
0,01 |
20 |
KI, Na3PO4, Al2(SO4)3 |
О к о н ч а н и е т а б л. 8
|
Номер варианта |
Раствор I |
Раствор II |
Электролиты, вызывающие коагуляцию | ||||
|
Вещество |
Сэк, моль/л |
V, мл |
Вещество |
Сэк, моль/л |
V, мл | ||
|
16 |
CuSO4 |
0,02 |
50 |
K2S |
0,01 |
50 |
CaBr2, K3PO4, Al2(SO4)3 |
|
17 |
Hg(NO3)2 |
0,005 |
10 |
K3PO4 |
0,05 |
10 |
NiSO4, K3PO4, Al(NO3)3 |
|
18 |
CoCl2 |
0,05 |
250 |
K2S |
0,1 |
50 |
K3PO4, Na2HPO4 , ZnSO4 |
|
19 |
Fe(NO3)2 |
0,1 |
50 |
Na2CO3 |
0,5 |
50 |
FeSO4, Na3PO4, Al(NO3)3 |
|
20 |
CrCl3 |
0,025 |
20 |
K3PO4 |
0,25 |
20 |
Fe2(SO4)3 , Li3PO4, Cu(NO3)2 |
|
21 |
Sr(NO3)2 |
0,01 |
20 |
Na2SO4 |
0,1 |
20 |
NaCl, ZnSO4, Na3PO4 |
|
22 |
Pb(NO3)2 |
0,1 |
100 |
KCl |
0,01 |
100 |
K3PO4, CaCl2, Al2(SO4)3 |
|
23 |
FeCl2 |
0,02 |
250 |
Na2S |
0,01 |
250 |
Na3PO4, Zn(NO3)2, Fe2(SO4)3 |
|
24 |
BaCl2 |
0,02 |
100 |
K3PO4 |
0,01 |
100 |
Na3PO4, Ca(NO3)2, Fe2(SO4)3 |
|
25 |
Na2CO3 |
0,01 |
50 |
Ni(NO3)2 |
0,05 |
50 |
K3PO4, CaCl2, Al2(SO4)3 |
|
26 |
MnCl2 |
0,01 |
50 |
Na2S |
0,05 |
50 |
K3PO4, CaCl2, Al2(SO4)3 |
|
27 |
Ni(NO3)2 |
0,01 |
20 |
K2S |
0,02 |
20 |
FeCl3, CuSO4, K3PO4 |
|
28 |
Mg(NO3)2 |
0,01 |
20 |
NaF |
0,05 |
20 |
Al2(SO4)3, ZnCl2, Na3PO4 |
|
29 |
AlCl3 |
0,05 |
200 |
K3PO4 |
0,01 |
200 |
ZnCl2, K3PO4, Fe2(SO4)3 |
|
30 |
Ca(NO3)2 |
0,01 |
50 |
K2CO3 |
0,02 |
50 |
AlCl3, CuSO4, K3PO4 |
Т е м а 7
Общие свойства растворов
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в таблице 9.
Температуры кипения, кристаллизации, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Т а б л и ц а 9
|
Номер варианта |
Растворитель |
Растворенное вещество | ||
|
Вещество |
масса, г |
Вещество |
масса, г | |
|
1 |
Этанол С2Н5ОН |
500 |
Сахароза С12Н22О11 |
30 |
|
2 |
Вода Н2О |
500 |
Мочевина (NH2)2СО |
20 |
|
3 |
Уксусная кислота СН3СООН |
100 |
Антрацен С14Н10 |
4,25 |
|
4 |
Хлороформ СНCl3 |
500 |
Пропеновая кислота С3Н4О2 |
7,2 |
|
5 |
Этанол С2Н5ОН |
200 |
Антраниловая кислота NH2C6H4COOH |
4,0 |
|
6 |
Бензол С6Н6 |
250 |
Камфора С10Н16О |
7,55 |
|
7 |
Хлороформ СНCl3 |
250 |
Нафталин С10Н8 |
2,35 |
|
8 |
Вода Н2О |
200 |
Глицерин С3Н5(ОН)3 |
11 |
|
9 |
Этанол С2Н5ОН |
250 |
Салициловая кислота С7Н6О3 |
11 |
|
10 |
Сероуглерод СS2 |
100 |
Бензойная кислота С6Н5СООН |
2,5 |
|
11 |
Вода Н2О |
250 |
Этиленгликоль (СН2)2(ОН)2 |
12,5 |
|
12 |
Циклогексан С6Н12 |
50 |
Пиррол С4Н5N |
0,25 |
О к о н ч а н и е т а б л. 9
|
Номер варианта |
Растворитель |
Растворенное вещество | ||
|
Вещество |
масса, г |
Вещество |
масса, г | |
|
13 |
Бензол С6Н6 |
150 |
Cера S |
0,75 |
|
14 |
Диэтиловый эфир (С2Н5)2О |
50 |
Анилин C6H5NH2 |
0,7 |
|
15 |
Вода Н2О |
250 |
Глюкоза С6Н12О6 |
20 |
|
16 |
Бензол С6Н6 |
50 |
Фенол С6Н6О |
0,9 |
|
17 |
Вода Н2О |
500 |
Метанол СН3ОН |
16 |
|
18 |
Вода Н2О |
100 |
Сахароза С12Н22О11 |
17,1 |
|
19 |
Бензол С6Н6 |
200 |
Трихлоруксусная кислота ССl3СООН |
4,95 |
|
20 |
Уксусная кислота СН3СООН |
200 |
Ацетон (СН3)2СО |
2,8 |
|
21 |
Ацетон (СН3)2СО |
400 |
Глицерин С3Н5(ОН)3 |
9,2 |
|
22 |
Вода Н2О |
100 |
Глюкоза С6Н12О6 |
4,84 |
|
23 |
Четыреххлористый углерод CCl4 |
100 |
Аспирин С9Н8О4 |
1,45 |
|
24 |
Уксусная кислота СН3СООН |
50 |
Антрацен С14Н10 |
1,8 |
|
25 |
Этанол С2Н5ОН |
50 |
Мочевина (NH2)2СО |
1,25 |
Т е м а 8
Комплексные соединения
Задание 1. Дано комплексное соединение (см. вариант в табл. 10).
Укажите: а) внутреннюю и внешнюю сферы, их заряды; б) комплексообразователь, его координационное число и заряд; в) лиганды и их заряд.
Для иона комплексообразователя напишите электронную формулу;
Напишите уравнения диссоциации комплексного соединения в водном растворе и выражение константы нестойкости комплексного иона.
Т а б л и ц а 10
-
Номер варианта
Вещество
Номер варианта
Вещество
1
[Cr(NH3)2(H2O)4]Cl3
14
[Co(NH3)5Br]SO4
2
K2[Pt(NH3)2(NO2)4]
15
[Pt(NH3)3Cl]Cl
3
Na[Co(NO2)4(NH3)2]
16
Mg[Be(OH)F3]
4
K2[Pt(OH)3Cl]
17
[Fe(NH3)5Cl]SO4
5
Na[Pt(NH3)Cl3]
18
Na2[Sb(H2O)Cl5]
6
[Ni(NH3)6]Br2
19
[Zn(NH3)3H2O](NO3)2
7
[Hg(NH3)4](NO3)2
20
K4[Ni(CN)4Cl2]
8
Na[Co(NH3)2(CN)4]
21
Na[Co(CN)4(H2O)2]
9
(NH4)2[Ni(CN)4]
22
Ba[Cu(CN)2Cl2]
10
Ва[Fe(CN)5(H2O)]
23
[Sn(OH)2(H2O)4]Cl2
11
[Co(NH3)4SO4]NO3
24
K2[Cd(CN)2SO4]
12
(NH4)2[Pt(OH)2Cl4]
25
Ca2[Fe(CN)4(OH)2]
13
Ba[Cr(NH3)2Cl4]
26
K2[Co(NH3)5Br]
Задание 2. Дано комплексное соединение (см. вариант в табл. 11).
Запишите первичную и вторичную диссоциацию комплексного соединения в водном растворе, выражение константы нестойкости комплексного иона и ее численное значение (см. приложение 5).
Вычислите концентрации ионов комплексообразователя, лигандов и ионов внешней сферы в растворе комплексной соли с заданной концентрацией (С).
Численные значения констант нестойкости комплексных ионов приведены в приложении 5.
Т а б л и ц а 11
|
Номер варианта |
Вещество |
С, моль/л |
Номер варианта |
Вещество |
С, моль/л |
|
1 |
K2[HgI4] |
0,03 |
14 |
(NH4)2[Ni(CN)4] |
0,02 |
|
2 |
[Cd(NH3)4]SO4 |
0,02 |
15 |
K2[Zn(CN)4] |
0,2 |
|
3 |
K2[Cu(OH)4] |
0,05 |
16 |
[Zn(NH3)4]SO4 |
0,01 |
|
4 |
K3[AgI4] |
0,01 |
17 |
K2[Cu(CN)4] |
0,1 |
|
5 |
K2[Be(OH)4] |
0,1 |
18 |
Na[AuCl4] |
0,01 |
|
6 |
Na2[HgBr4] |
0,01 |
19 |
[Hg(NH3)4](NO3)2 |
0,5 |
|
7 |
Na2[PtCl4] |
0,01 |
20 |
[Cu(NH3)2]Cl |
0,02 |
|
8 |
K[Sb(OH)4] |
0,1 |
21 |
Na[Ag(NO2)2] |
0,01 |
|
9 |
K2[Cu(SCN)4] |
0,5 |
22 |
K2[CdI4] |
0,3 |
|
10 |
Na2[Hg(NO2)4] |
0,02 |
23 |
K2[BeF4] |
0,1 |
|
11 |
Na[In(OH)4] |
0,01 |
24 |
(NH4)3[Ag(SCN)4] |
0,03 |
|
12 |
K2[PtBr4] |
0,1 |
25 |
(NH4)2[PdBr4] |
0,05 |
|
13 |
Na2[Cd(CN)4] |
0,05 |
26 |
Li3[Cr(SCN)6] |
0,05 |
Тема 9
Электрохимические процессы
