
- •Тема 16. Котельные установки……………..………………………………149
- •Тема 17. Использование вэр и охрана окружающей среды………..…..170
- •Введение
- •Часть 1. Термодинамика
- •Тема 1. Основные понятия и определения
- •Предмет и метод термодинамики
- •Объект изучения термодинамики
- •1.3 Параметры состояния термодинамической системы
- •1.4 Уравнение состояния идеального газа. Понятие об идеальных и реальных газах
- •1.5 Газовые смеси
- •1.6 Термодинамический процесс
- •Тема 2. Первый закон термодинамики
- •2.1 Аналитическое выражение первого закона термодинамики. Частные случаи закона
- •2.2 Внутренняя энергия системы
- •2.3 Работа расширения и pv-диаграмма для изображения работы
- •2.4 Работа и теплота
- •2.5 Теплоемкость газов
- •2.6 Энтальпия
- •Тема3. Второй закон термодинамики
- •3.1 Общая характеристика
- •3.2 Энтропия и математическое выражение второго закона
- •3.3 III начало термодинамики
- •3.4 Т,s диаграмма для изображения теплоты
- •3.5 Физический смысл энтропии
- •3.6 Основное уравнение термодинамики и вычисление энтропии
- •Тема. 4 термодинамические процессы идеальных газов в закрытых системах
- •4.1 Изохорный процесс
- •4.2 Изобарный процесс
- •4.3 Изотермический процесс
- •4.4 Адиабатный процесс
- •4.5 Политропный процесс
- •Тема 5. Термодинамические циклы
- •5.1 Круговые процессы
- •5.2 Термодинамическая схема теплового двигателя
- •5.3 Прямой цикл Карно
- •5.4 Обратный цикл Карно
- •Тема 6. Циклы паросиловых, холодильных установок и теплового насоса
- •6.1 Циклы паросиловых установок. Цикл Ренкина
- •6.2 Циклы холодильных установок
- •6.3 Цикл теплового насоса
- •6.4 Эксергия. Эксергический анализ
- •Тема7. Теоретические циклы двигателей внутреннего сгорания
- •7.1 Цикл Отто
- •7.2 Цикл Дизеля
- •7.3 Цикл Тринклера (или Сабатэ)
- •Тема8. Термодинамика потока газов и паров
- •8.1 Уравнение первого закона термодинамики для потока
- •8.2 Истечение газов и паров
- •8.3 Дросселирование. Температура инверсии
- •Часть 2. Теория тепло и массообмена
- •Тема 9. Основы теории теплообмена
- •9.1 Введение. Теплопроводность
- •9.2 Закон Фурье – основной закон теплопроводности
- •9.3 Теплопроводнсть плоской однородной, однослойной стенки
- •9.4 Теплопроводность многослойной стенки
- •9.5 Теплопроводность цилиндрической стенки.
- •Тема10. Конвективный теплообмен
- •10.1 Понятие теплообмена. Закон Ньютона Рихмана
- •10.2 Критерии подобия
- •10.3 Теплоотдача при вынужденном движении теплоносителя
- •10.4 Теплоотдача при свободном движении теплоносителя
- •10.5. Теплоотдача при кипении
- •10.6 Теплоотдача при конденсации пара
- •Тема11. Теплопередача чарез стенку
- •11.1 Понятие теплопередачи, теплопередача через плоскую стенку.
- •11.2 Уравнение теплопередачи.
- •11.3 Теплопередача через цилиндрическую стенку
- •Тема12. Лучистый теплообмен
- •12.1 Понятие лучистого теплообмена
- •12.2 Законы лучистого теплообмена
- •12.3 Теплообмен излучением системы тел в прозрачной среде
- •Тема13. Водяной пар
- •13.1 Процесс парообразования в pv-координатах
- •13.2 Ts и hS диаграмма водяного пара
- •13.3 Параметры состояния жидкости и пара
- •Тема14. Влажный воздух
- •14.1 Понятие влажного воздуха, его характеристики
- •14.3 Сушка материала
- •Тема15. Топливо
- •15.1 Классификация топлива
- •15.2 Состав топлива
- •15.3 Характеристики топлива.
- •15.4. Примеры твердого, жидкого, газообразного топлива.
- •15.5 Процесс горения топлива
- •15.6 Состав и объем продуктов сгорания.
- •15.7 Нефтяные топлива.
- •15.8 Понятие детонации, октанового числа и цетанового числа.
- •Тема16. Котеьные установки
- •16.1 Понятие котла и котельной установки
- •16.1 Паровой котёл и его основные элементы
- •16.3 Паровые и водогрейные котлы
- •16.4 Вспомогательное оборудование
- •16.5 Топка, топочные устройства
- •16.6 Котлы утилизаторы
- •16.7 Тепловой баланс горения
- •Тема17. Использование вэр и охрана окружающей среды
- •17.1 Понятия вэр
- •17.2 Классификация вторичных энергетических ресурсов в промышленности
- •17.3 Использование вторичных энергетических ресурсов промышленности
- •17.4 Расчет вэр на экономическую эффективность
- •Заключение.
4.3 Изотермический процесс
Изотермический процесс характеризуется постоянной температурой Т = const. Кривая изотермического процесса, называется изотермой. Уравнение изотермы в pv – координатах
pv = const. (4.16)
Из уравнения состояния следует, что:
![]() (4.17)
(4.17)
т.е. объем и давление идеального газа обратно пропорциональны. В pv–координатах (рисунок 4.3) изотермный процесс изображается равнобокой гиперболой: 1–2 – процесс расширения, 1–3 – процесс сжатия. В Ts–координатах процесс 1–2 протекает с подводом теплоты а процесс 1–3 – с отводом.

Рис. 4.3 – Изображение изотермического процесса в pv и Ts – координатах
Работа процесса:
 .
(4.18)
.
(4.18)
Так как T = const, то из уравнений
![]() ;
;
![]()
следует, что:
Δu = 0 и Δh = 0. (4.19)
Поэтому вся подведенная к рабочему телу теплота расходуется на совершение работы:
q = l. (4.20)
Из уравнений:
, (4.21)
(4.22)
вытекает, что изменение энтропии в изотермическом процессе
![]() (4.23)
(4.23)
В соответствии с зависимостью с = dq/dT теплоемкость изотермического процесса:
![]() .
(4.24)
.
(4.24)
4.4 Адиабатный процесс
Адиабатный процесс – это процесс, протекающий без теплообмена с окружающей средой:
dq = 0. (4.25)
Из уравнения первого закона термодинамики следует, что:
![]() (4.26)
(4.26)
![]() (4.27)
(4.27)
Поделив первое
уравнение на второе и учитывая, что
![]() ,
получим:
,
получим:
![]() или
или
![]() (4.28)
(4.28)
Откуда:
![]() ,
т. е. (4.29)
,
т. е. (4.29)
![]() .
(4.30)
.
(4.30)
Это уравнение является уравнением адиабатного процесса, а k –показателем адиабаты.
Поскольку k > 1, то в рv –координатах линия адиабаты идет круче изотермы.
Для состояния 1 и 2 при адиабатном процессе, учитывая и pv = RT, получим:
 (4.31)
(4.31)
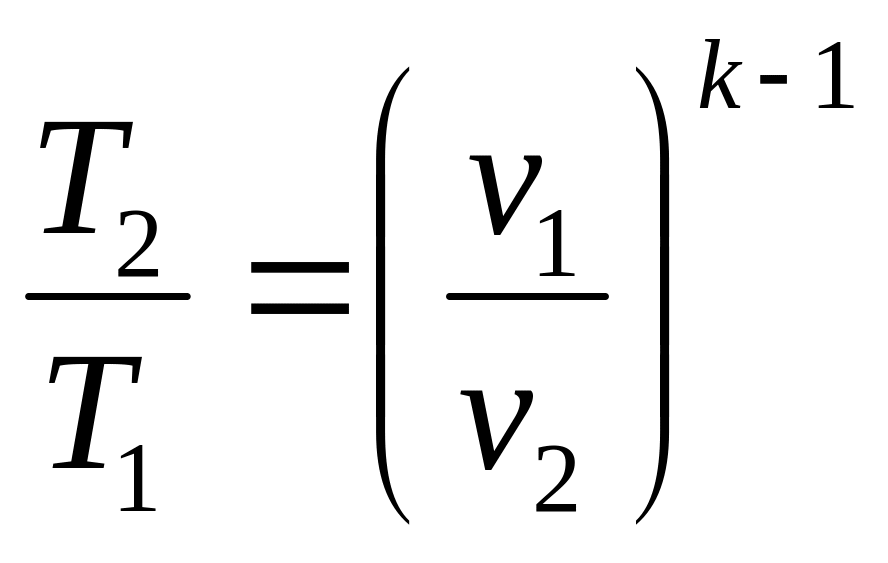 (4.32)
(4.32)
 (4.33)
(4.33)
Согласно первому закону термодинамики, работа расширения совершается за счет внутренней энергии, т.е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку:
![]() .
(4.34)
.
(4.34)
С учетом зависимостей
и
![]() будем иметь:
будем иметь:
![]() .
(4 35)
.
(4 35)
Работа l численно равна площади под кривой 1–2 (рисунок 4.4). В данном случае Δv > 0 и поэтому l > 0.
Рис. 4.4 – Изображение адиабатного процесса в pv и Ts – коордитах
Поскольку при адиабатном процессе. dq = 0, то ds = 0, следовательно, s = const. Адиабатный обратимый процесс является изоэнтропным, т.е. протекает при постоянном значении энтропии. На рисунке 4.4 линия 1–2 соответствует расширению рабочего тела (процесс сопровождается уменьшением температуры), а линия 1 –3 – сжатию рабочего тела. Согласно уравнению с = dq/dT, при адиабатном процессе теплоемкость равна нулю.
