
- •А.П. Баскаков, е.Ю. Павлюк
- •Содержание
- •Предисловие
- •1. Основные понятия и исходные положения термодинамики
- •1.1. Предмет и метод термодинамики
- •1.2. Термодинамическая система
- •1.3. Термодинамические параметры состояния
- •1.4. Уравнение состояния
- •1.5. Термодинамический процесс
- •Контрольные вопросы
- •2. Первый закон термодинамики
- •2.1. Внутренняя энергия
- •2.2. Работа против окружающей среды в закрытой системе
- •2.3. Теплота
- •2.4. Аналитическое выражение первого закона термодинамики для закрытой системы
- •2.5. Теплоемкость газов
- •2.6. Энтальпия
- •Контрольные вопросы и задачи
- •3. Второй закон термодинамики
- •3.1. Энтропия
- •3.2. Изменение энтропии в неравновесных процессах
- •4. Основные термодинамические процессы в газах, парах и смесях
- •4.1. Термодинамические процессы идеальных газов в закрытых системах
- •4.2. Смеси идеальных газов
- •4.3. Термодинамические процессы реальных газов
- •5. Особенности термодинамики открытых систем
- •5.1. Уравнение первого закона термодинамики для потока
- •5.2. Истечение газов и паров
- •5.3. Расчет процесса истечения с помощью h-s диаграммы
- •5.4 Термодинамический анализ процессов в компрессорах.
- •6. Циклы теплосиловых установок
- •6.1. Цикл Карно и второй закон термодинамики
- •6.2. Циклы поршневых двигателей внутреннего сгорания
- •6.3. Цикл газотрубинной установки
- •6.4. Циклы паротурбинных установок
- •6.5. Холодильные установки и тепловые насосы
- •Решения задач и ответы на вопросы
- •Приложение 1
- •Параметры критического состояния
- •Параметры критического состояния
- •620002, Г. Екатеринбург, ул. Мира 19
3.2. Изменение энтропии в неравновесных процессах
Выше говорилось, что в классической термодинамике рассматриваются только равновесные процессы. Реальные процессы в различной степени отличаются от равновесных: иногда незначительно (тогда можно без поправок применять все законы классической термодинамики), иногда – существенно. В последнем случае неравновесность приходится учитывать в расчётах. Этим занимается «неравновесная термодинамика», основателем которой является И. Пригожин.
Уже Р. Клазиус, а затем и И. Пригожин установили, что энтропия является специфической функцией. Она выступает в двух ипостасях. При рассмотрении равновесных систем она качественно не отличается от других известных нам функций состояния – u и h и используется в расчетах наряду с ними. Но она выступает в другом качестве при изучении неравновесных процессов, поскольку только она дает возможность характеризовать степень неравновесности процесса.
Возьмем
термодинамическую систему (рабочее
тело) в равновесном состоянии 1. Это
значит, что его параметры (T1,
v1,
h1,
s1
и т.д.) во всех точках одинаковы. Пусть
эта система, совершив какой-то
термодинамический процесс, перейдет в
состояние 2. Мы не знаем, равновесным
был этот процесс или нет, но мы можем
выждать достаточно времени, чтобы
состояние 2 стало равновесным (т. е. T2,
s2
и т.д. стали одинаковыми по всему объему
тела). В результате мы можем посчитать
изменение любого параметра в этом
процессе, в том числе и
![]() .
.
Рассмотрим принципиальные отличия неравновесных процессов от равновесных на примере расширения газа в цилиндре под поршнем (рис. 3.2), получающего теплоту q от источника с температурой Т1 и совершающего работу против внешней силы Р, действующей на поршень.
Рис. 3.2. Расширение газа под поршнем,
совершающего работу против внешних
сил
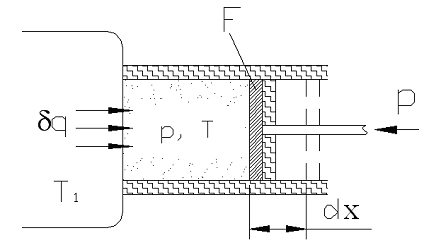
Расширение будет
равновесным только в случае, если
температура газа Т
равна температуре источника (Т = Т1),
внешняя сила Р
равна давлению газа на поршень (Р = pF),
а при расширении газа нет ни внешнего,
ни внутреннего трения. Работа расширения
газа в этом случае равна
![]() ,
а изменение энтропии рабочего тела в
таком процессе
,
а изменение энтропии рабочего тела в
таком процессе
![]() .
.
Невыполнение хотя
бы одного из указанных условий делает
расширение газа неравновесным. Если
неравновесность вызвана трением поршня
о стенки цилиндра, то работа l,
совершаемая против внешней силы Р,
оказывается меньше, чем pdv,
так как часть ее затрачивается на
преодоление трения и переходит в теплоту
qтр.
Она воспринимается газом вместе с
подведенной теплотой q,
в результате чего возрастание энтропии
газа в неравновесном процессе
![]() оказывается больше, чем в равновесном
при том же количестве подведенной от
источника теплоты q.
оказывается больше, чем в равновесном
при том же количестве подведенной от
источника теплоты q.
Если неравновесность вызвана отсутствием механического равновесия (P < pF), поршень будет двигаться ускоренно. Быстрое движение поршня вызывает появление вихрей в газе, затухающих под действием внутреннего трения, в результате чего часть работы расширения опять превращается в теплоту qтр. Работа против внешней силы снова получается меньше, а возрастание энтропии – больше, чем в равновесном процессе с тем же количеством теплоты q.
Если неравновесность
вызвана теплообменом при конечной
разности температур (температура газа
Т
меньше температуры источника Т1),
то возрастание энтропии рабочего тела
оказывается больше, чем
![]() в равновесном процессе из-за снижения
температуры газа.
в равновесном процессе из-за снижения
температуры газа.
Итак, неравновесность всегда приводит к увеличению энтропии рабочего тела при том же количестве подведенной теплоты. Это выражение является одной из формулировок второго закона термодинамики.
Итак, для равновесных
процессов справедливо соотношение
.
Разобранный пример достаточно наглядно
показывает, что в неравновесных процессах
![]() ,
если q
– количество подведенной к системе или
отведенной от нее теплоты, а Т
– температура источника теплоты.
,
если q
– количество подведенной к системе или
отведенной от нее теплоты, а Т
– температура источника теплоты.
В общем виде это можно записать следующим образом
![]() , (3.7)
, (3.7)
причем dsнеравн всегда положительно.
Соотношение (3.7) представляет собой математическую запись второго закона термодинамики.
Для адиабатно изолированных систем, которые по определению не обмениваются теплотой с окружающей средой (q = 0), выражение (3.7) принимает вид
![]() .
(3.8)
.
(3.8)
Если в адиабатно изолированной системе осуществляются равновесные процессы, то энтропия системы остается постоянной.
Самопроизвольные (а значит, и неравновесные) процессы в изолированной системе всегда приводят к увеличению энтропии.
Следует подчеркнуть,
что равенство (3.8) применимо только к
адиабатно изолированным системам. Если
от системы отводится теплота, то ее
энтропия может убывать и при протекании
в ней самопроизвольных (неравновесных)
процессов, когда
![]() в формуле (3.7) больше по абсолютной
величине, чем dsнеравн.
в формуле (3.7) больше по абсолютной
величине, чем dsнеравн.
